来源:小张聊科研平台的“ 课题指南针”公众号,微信公众号搜索“ 课题指南针”即可关注/扫描关注见文末
一转眼,夏天过去了,大家立的减肥flag完成得怎么样?其实,过度肥胖不仅影响体态美观,还会引发一系列代谢相关疾病。

肥胖会增加炎症性皮肤疾病的风险和严重程度,尤其是牛皮癣。肥胖者患牛皮癣的可能性是普通体重人群的2-3倍,而肥胖患者体重减轻可以减轻牛皮癣的严重程度。
有研究发现,高脂肪饮食(HFD)诱导的小鼠肥胖通过促炎巨噬细胞、活化树突状细胞(dc),尤其是产生IL- 17A的gd-T细胞在银屑病皮损处的积累,导致银屑病恶化。
此外,饱和游离脂肪酸(FFAs)如棕榈酸(PA)水平的升高会促进肥胖个体银屑病病变中炎症细胞因子的产生。
为什么关键的皮肤抗炎细胞无法有效控制肥胖个体的这种过度活跃的免疫反应呢?具体机制到底是什么?肥胖又是如何影响牛皮癣疾病进程的?如何结合数据分析得出更有效的结论?
这篇发表在Immunity(IF=43.474)上的干湿结合文章带你一次看透!
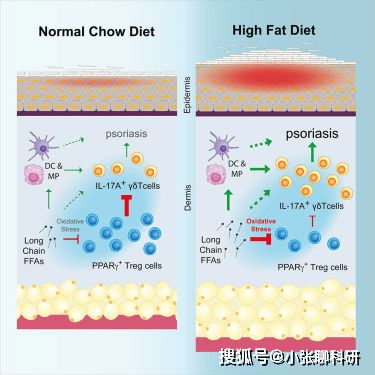 普通人群与肥胖人群对银屑病的不同免疫反应
普通人群与肥胖人群对银屑病的不同免疫反应
01、文章思路
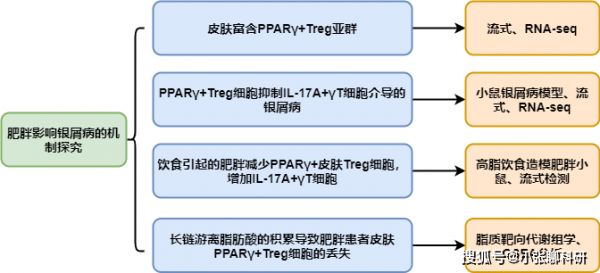
02、研究结果
1. 皮肤中PPARγ+ Treg群体的鉴定
为区分皮肤Treg细胞的潜在转录因子,研究人员从2周龄 Foxp3Cre小鼠的脾脏和皮肤中分选CD45+ TCRβ+ CD4+ Foxp3+ Treg细胞,并进行RNA测序(RNA-seq)分析。发现与脾脏Treg细胞相比,皮肤Treg细胞高表达细胞周期(如Cdk1)、免疫抑制(如IL-10)等相关因子(图1A)。
与这些结果一致的是,基因富集度分析(GSEA)显示皮肤Treg细胞富含与细胞周期和DNA复制有关的基因,且与脾细胞相比,皮肤Treg细胞中的过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor,PPAR)信号通路高度富集(图1B)。
在转录水平上,与脾脏Treg细胞相比,皮肤Treg细胞中的PPARγ更高(图1A)。与脾脏或肺相比,躯干皮肤和耳朵上有更多PPARγ+ Treg细胞(图1C),在2-3周龄时,占皮肤Treg群体的60%-80%,在成年小鼠中略有下降(图1D)。RNA-seq数据分析显示,人类皮肤Treg细胞PPARγ表达比血液中的多(图1E),流式分析表明IL-10的表达也更高(图1F-1H)。
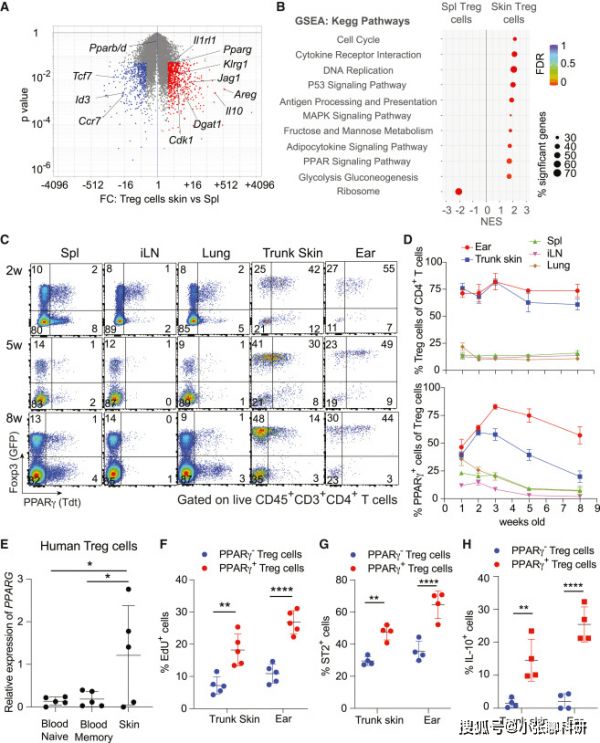 图1. 皮肤PPARγ+Treg细胞的鉴定及特性
图1. 皮肤PPARγ+Treg细胞的鉴定及特性
2. PPAR促进皮肤Treg细胞的积累
为确认PPARγ是否是皮肤Treg细胞积累和维持稳定状态所必需的,研究人员分析了Pparg+/+ Foxp3-cre或Pparg f/f Foxp3-cre小鼠不同组织中的Treg细胞群,发现在围产期和成年鼠中,皮肤中的Treg细胞数量减少,但脾脏和胸腺中的Treg细胞无明显变化(图2A、2B)。2周龄Pparg f/f Foxp3-cre小鼠与Pparg+/+ Foxp3-cre小鼠相比,肺Treg细胞数量略有减少。
对PPARγ+/+Foxp3-cre或PPARγf/f Foxp3-cre小鼠新鲜分离的皮肤Treg细胞的流式检测表明,PPARγ促进皮肤Treg细胞增殖(图2C),但不影响Treg细胞的凋亡(图2D)。
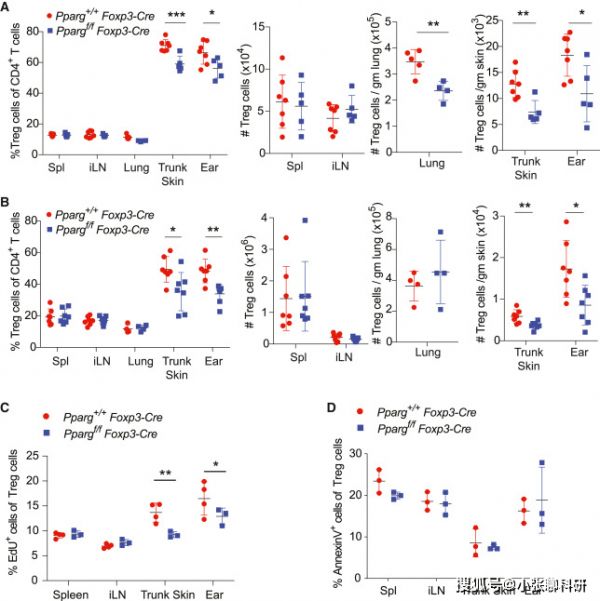 图2. PPARγ促进皮肤Treg细胞稳态
图2. PPARγ促进皮肤Treg细胞稳态
3. PPARγ影响皮肤Treg细胞的表型
为确定PPARγ如何影响皮肤Treg细胞的表型,研究人员对PPARg+/+Foxp3-cre或Ppargf/fFoxp3-cre小鼠的皮肤和脾Treg细胞进行了RNA-seq分析。发现IL10、Klrg1、Dgat1和Jag1等在皮肤Treg中上调,而ID3、Tcf7和CCR7下调(图3A),这表明在没有PPARγ的情况下,大多数皮肤Treg特征基因调控失调。
与这些结果一致的是,GSEA分析显示,与PPARγ缺陷皮肤Treg细胞相比,WT皮肤Treg细胞的主要特征(如PPAR信号通路、P53通路)更加突出(图3B)。
流式细胞仪进一步证实Ppargf/f Foxp3-CRE小鼠的皮肤Treg细胞中ST2、IL-10和KLRG1的表达低于同龄WT小鼠(图3C-3E)。
这些结果证实PPARγ是皮肤Treg细胞产生不同表型的主要影响因素。
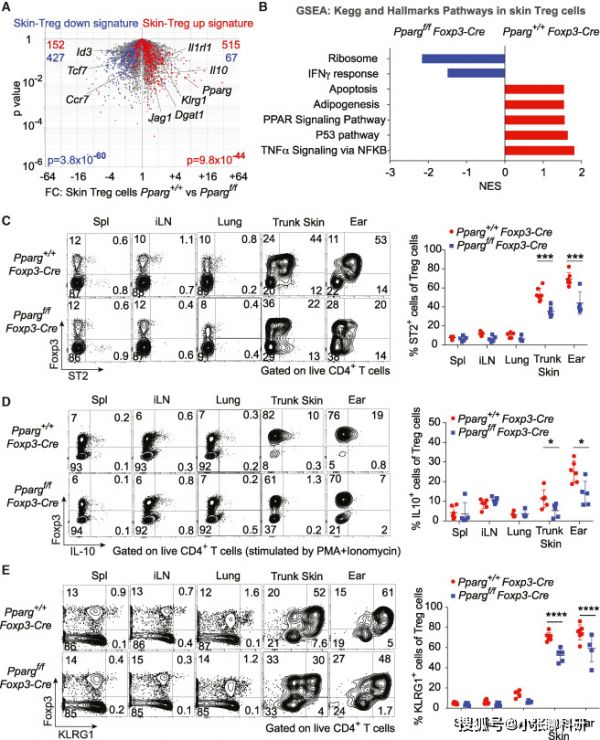 图3. PPARγ影响皮肤Treg细胞的表型
图3. PPARγ影响皮肤Treg细胞的表型
4. PPARγ缺乏Treg细胞控制炎症能力受损
研究人员使用咪喹莫特(Imquimod)诱导了银屑病小鼠模型(该模型非常类似人类银屑病)。结果显示与WT鼠相比,Ppargf/f Foxp3-cre小鼠耳朵表皮增生加重,耳中CD45+白细胞和中性粒细胞总数增加(图4A-4D)。在ImQ治疗后,Ppargf/fFoxp3-cre小鼠耳朵的IL-17A转录量高于Pparg+/+ Foxp3-cre小鼠(图4e)。据此推测,PPARγ缺陷的皮肤Treg细胞无法控制ImQ引起的皮肤炎症可能是因为这些细胞减少和/或功能受损。
进一步研究发现,ImQ治疗的Ppargf/f Foxp3-Cre小鼠的耳朵Treg细胞的数量与Pparg+/+Foxp3-Cre小鼠相当,甚至略高(图4G和4H),这可能是Treg细胞对ImQ处理的Pparg f/f Foxp3-Cre小鼠炎症加重的代偿反应。这些结果表明,PPARγ缺陷的Treg细胞能够在银屑病皮损中蓄积,但不能有效地控制IL-17A+ γδ T细胞介导的银屑病炎症。
IL-10是关键的免疫抑制细胞因子,RNA-Seq和流式分析表明,IL-10主要来自皮肤中PPARγ+ Treg细胞。ImQ处理的Pparg f/f Foxp3-Cre小鼠的耳朵细胞受损,不能产生IL-10。将重组小鼠IL-10注射到ImQ治疗的Pparg f/f Foxp3-Cre小鼠中,可将银屑病的严重程度降低到与Pparg+/+Foxp3-Cre小鼠相当的水平(图4J和4K)。
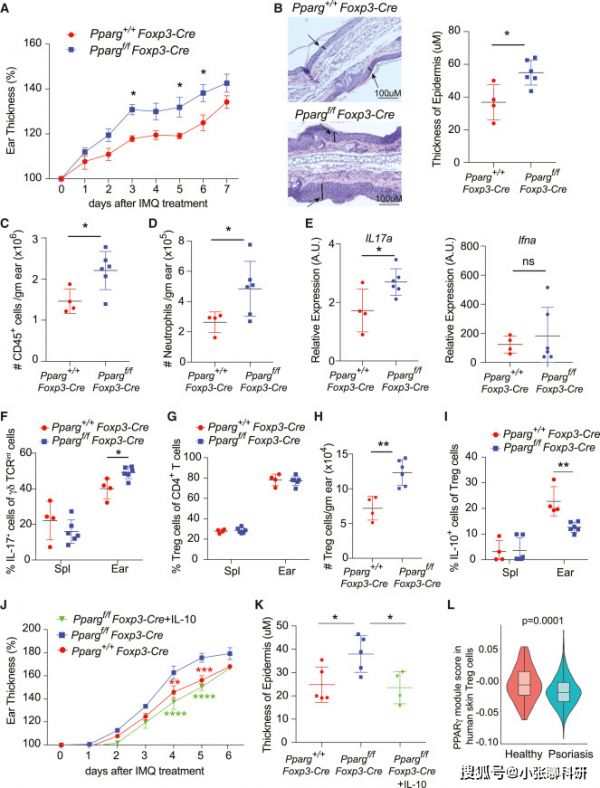 图4. Treg的Pparg特异性缺失加重ImQ诱导的银屑病
图4. Treg的Pparg特异性缺失加重ImQ诱导的银屑病
5. 饲喂HFD的小鼠炎症加剧
研究人员用流式细胞术检测不同组织中Treg细胞数量,食用HFD的小鼠的皮肤PPARγ+Treg细胞群数量低于NCD喂养的小鼠(图5A-5E),在PPARγ+皮肤Treg细胞丢失的同时,服用HFD的小鼠IL-17A+γδ TCRint细胞增加(图5F和5G)。相反,饲喂HFD不影响MP、DC及其PPARγ的表达(图5H-5K)。
高脂饲料喂养的小鼠皮肤CD8+T细胞的数量略有增加,但PPARγ的表达没有受到影响(图5L-5O)。
这些结果表明,HFD喂养减少了PPARγ+皮肤Treg细胞,增加了IL-17A+γδ TCRint细胞。
与此同时,研究人员发现喂食 HFD的小鼠在ImQ治疗后耳朵厚度增加,表皮增生加剧,IL-17A升高,但IFNA没有升高(图6A-6D)。这与耳朵皮肤中PPARγ+Treg细胞的减少和IL-17A+γδT细胞的相对增加有关(图6E-6G)。
噻唑烷二酮(TZD)药物吡格列酮(Pio)是PPARγ45的特异性激动剂,可用来检测肥胖小鼠PPARγ+皮肤Treg群体的能力。研究人员将Pio或DMSO局部应用于喂食NCD或HFD的PPARγ-TdT Foxp3-Thy1.1小鼠的耳朵上,然后在这些小鼠中诱导牛皮癣(图6H)。Pio在很大程度上恢复了PPARγ+皮肤Treg细胞群功能,并减弱了HFD喂养的小鼠的IL-17A+γδT细胞反应(图6I-6L)。Pio处理的HFD喂养的小鼠表皮增生减轻(图6M)。
这些结果表明,HFD诱导的PPARγ+皮肤Treg区的破坏促进了肥胖小鼠IL-17A+γδT细胞介导的银屑病炎症。
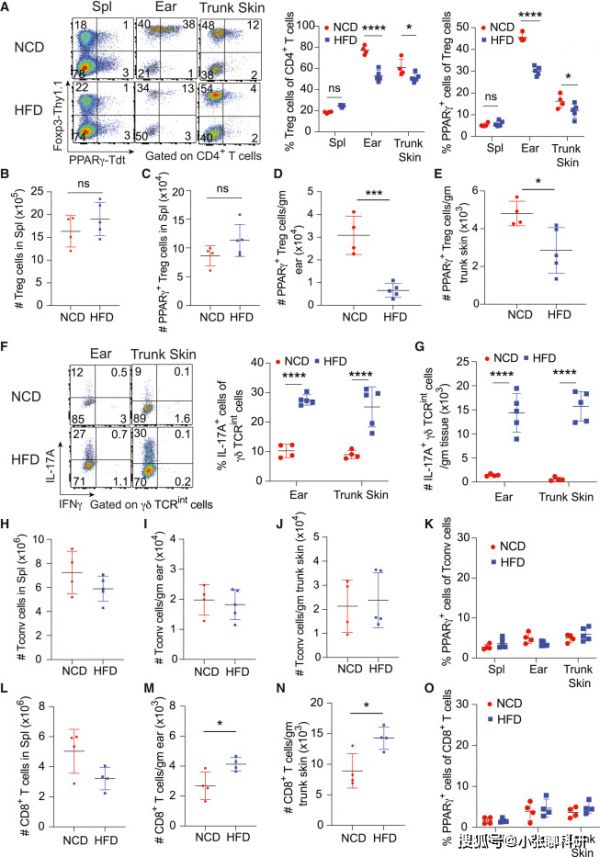 图5. 高脂饮食小鼠皮肤PPARγ+Treg细胞丢失,IL-17+γδ T细胞增加
图5. 高脂饮食小鼠皮肤PPARγ+Treg细胞丢失,IL-17+γδ T细胞增加
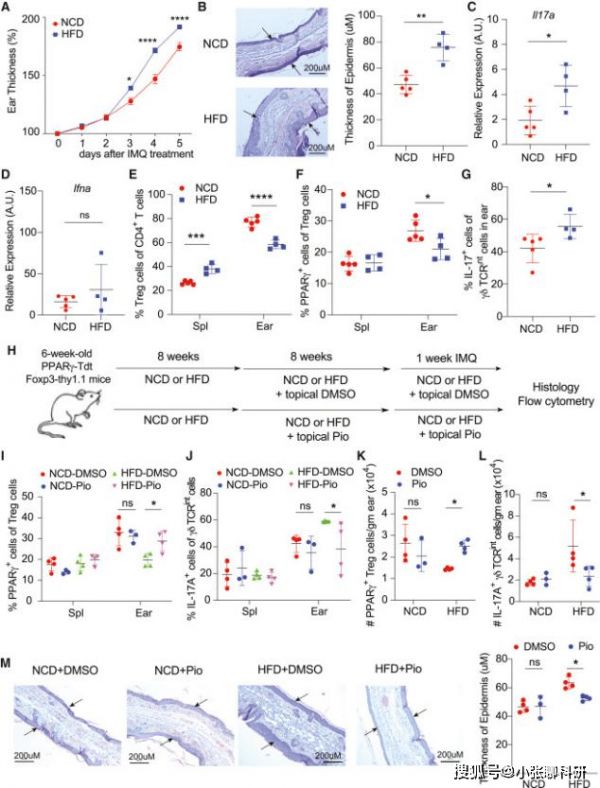 图6. 局部皮下注射减轻白介素17A介导的银屑病小鼠炎症反应
图6. 局部皮下注射减轻白介素17A介导的银屑病小鼠炎症反应
6. 长链游离脂肪酸(FFAs)抑制Treg细胞稳态
为评估喂食HFD是否改变了皮肤中特定的FFA,研究人员对喂食NCD或HFD的小鼠的耳朵进行了靶向脂质组学研究。饱和脂肪酸如棕榈酸(PA)和硬脂酸(SA),是喂食HFD的小鼠耳朵中含量最高的FFA(图7A),这表明脂质可以促进促炎细胞的生成。
体内注射PA可特异性减少PPARγ+皮肤Treg细胞(图7B)。研究人员用BSA单独或BSA-PA处理纯化的皮肤Treg细胞,三天后,使用BSA-PA处理的Treg细胞减少(图7C),可能是由于细胞增殖和存活率降低(图7D和7E),PA对PPARγ+皮肤Treg细胞有明显的抑制作用(图7F)。
PPARγ+皮肤Treg细胞CD36 (一种清道夫受体,参与长链脂肪酸的摄取)的表达高于PPARγ-的细胞 (图7G和7H)。用磺基琥珀酸亚胺油酸酯(SSO)抑制CD36在很大程度上消除了PA的抑制作用(图7I),表明PA对Treg细胞的毒性依赖于CD36。GSEA也有类似发现:PA促进炎症反应,抑制细胞周期、脂质代谢和线粒体稳态相关基因的表达(图7J)。
与这些结果一致的是,MitoTracker深红(MTDR)和MitoSOX红染色显示,PA处理破坏了皮肤Treg细胞中线粒体的动态平衡,增加了线粒体活性氧(ROS)(图7K)。另外,在NCD喂养的小鼠中,耳朵Treg细胞比脾Treg细胞MTDR染色程度更高,而后者在HFD喂养的小鼠中减弱(图7L)。
综上所述,这些结果表明,摄入HFD会导致长链游离脂肪酸的增加,这种脂肪酸优先破坏PPARγ+皮肤Treg细胞中线粒体的动态平衡。
 图7. 肥胖状态下,长链脂肪酸升高导致PPARγ+皮肤Treg细胞丢失
图7. 肥胖状态下,长链脂肪酸升高导致PPARγ+皮肤Treg细胞丢失
03、总结
肥胖是牛皮癣的主要危险因素,先前的研究主要集中在肥胖对促炎性疾病的影响,肥胖相关的皮肤炎症是如何逃脱免疫反应仍然难以捉摸。本研究确定了一个独特的PPAR γ+皮肤Treg细胞群,发现它限制了瘦小鼠IL-17A+gd T细胞介导的炎症反应,然而这些细胞在HFD喂养后减少,导致IL-17A+gd T细胞介导的银屑病炎症过度活跃。
且结合scRNA-seq数据集与GSEA分析,整合了更多数据,使得结果更加可靠。
本研究的局限性在于scRNA-seq数据集的稳定性,它受到以下因素的限制:
一方面,在许多实验中捕获的Treg细胞数量相对较少,基于液滴的scRNA-seq方法对PPARγ转录本的低检测率,未来需要对来自健康人和牛皮癣患者皮肤的纯化Treg群体进行scRNA-seq研究以充分解决这一问题;另一方面,这些PPARγ+Treg细胞在皮肤中的稳定性,它们有可能因某些环境变化而转化为其他类型的Treg细胞,新的追踪工具和遗传老鼠模型应该能够在未来的研究中解决这个问题。原文链接:https://mp.weixin.qq.com/s/3h1Q-H8C9JzSs1LX9rfmTQ返回搜狐,查看更多
责任编辑:






