有机磷酸酯在植物体内的吸收、积累、迁移与转化研究进展
高慧娴, 刘宪斌, 田胜艳, 刘青. 有机磷酸酯在植物体内的吸收、积累、迁移与转化研究进展[J]. 环境化学, 2024, 43(1): 186-198. doi: 10.7524/j.issn.0254-6108.2022060904
GAO Huixian, LIU Xianbin, TIAN Shengyan, LIU Qing. Uptake, accumulation, translocation and transformation of organophosphate esters (OPEs) in plants: A review[J]. Environmental Chemistry, 2024, 43(1): 186-198. doi: 10.7524/j.issn.0254-6108.2022060904
Citation:GAO Huixian, LIU Xianbin, TIAN Shengyan, LIU Qing. Uptake, accumulation, translocation and transformation of organophosphate esters (OPEs) in plants: A review[J]. Environmental Chemistry, 2024, 43(1): 186-198. doi: 10.7524/j.issn.0254-6108.2022060904有机磷酸酯在植物体内的吸收、积累、迁移与转化研究进展
通讯作者:E-mail:liuqing@tust.edu.cn1. 天津科技大学海洋与环境学院,天津,3004572. 环境污染过程与基准教育部重点实验室,南开大学,天津,300350 收稿日期: 2022-06-09 录用日期: 2022-08-21 网络出版日期: 2024-01-19关键词: 有机磷酸酯 /植物 /吸收 /积累 /迁移 /转化.摘要: 有机磷酸酯(organophosphate esters,OPEs)在各类环境介质中被频繁检出,且对生态系统和人体健康存在潜在危害,其环境归趋已成为环境科学领域的热点问题. 植物作为陆生食物链的重要环节,也是污染物的重要存储体之一,关于植物体吸收、积累OPEs及其在植物体内迁移转化的研究,对明确OPEs的环境行为、评价其生态风险以及科学使用和管理具有重要意义. 本文就近年来关于OPEs在植物体内归趋的研究进行汇总,综述了植物吸收OPEs的主要方式、积累以及OPEs在植物体内的迁移与转化行为及其影响因素,并展望了未来研究趋势和发展方向. OPEs主要通过被动扩散被根系吸收;辛醇-水分配系数(octanol-water partition coefficient,Kow)是影响植物吸收、积累和迁移OPEs的关键因素,植物根系对lg Kow值为3.5—9.5间的OPEs吸收速率更快;lg Kow<3的OPEs更易通过植物木质部和韧皮部进行运输. OPEs在植物中的吸收、积累和迁移还受植物根系的蛋白质、脂质含量以及蒸腾能力等生理状况的差异影响. OPEs在植物体内会发生Ⅰ相和Ⅱ相代谢过程,磷酸三酯水解成对应的磷酸二酯是OPEs在植物中的主要转化途径,酸性磷酸酶是参与植物体内OPEs水解反应的关键性酶,细胞色素P450酶和谷胱甘肽S-转移酶也能有效促进OPEs在植物中的转化.
English Abstract
全文HTML
随着溴代阻燃剂(brominated flame retardants, BFRs)被列为持久性有机污染物被禁用或受管控[1],有机磷阻燃剂(organophosphate flame retardants, OPFRs)因其良好的阻燃性能作为BFRs的替代品产量逐年增加[2-4]. 有机磷酸酯(organophosphate esters, OPEs)是一类以磷酸基团为中心,连接不同取代基的化合物,是当前使用量较大的一类OPFRs. 2013年,全球OPEs的年产量达到了62万吨,占到阻燃剂总市场的30%[5]. OPEs还可以作为增塑剂、消泡剂等广泛应用于电子产品、纺织、建筑材料和聚氨酯泡沫等商品生产中[2].
根据取代基不同,OPEs通常被分为烷基取代、芳香基取代和卤代烷基取代等3类,其理化性质因其取代基不同而存在较大差异. 几类目前环境中常检测到的OPEs的理化性质见表1. OPEs作为一类添加型阻燃剂,极易在其生产、使用中经挥发、浸出和机械磨损等过程释放到环境中[2]. 目前,已在水体[6-7]、沉积物[8]、灰尘[9]、土壤[10]等各类环境介质,甚至在极地环境中检测到OPEs[11]. 研究发现,OPEs可以被动物[12-13]和植物[14-16]吸收、积累,对人体和水生生物具有内分泌干扰效应[17],发育[18]、生殖[19]和神经毒性[20]等. OPEs还影响植物光合作用[21],干扰植物脂质代谢[22].
土壤是OPEs赋存的一个重要“汇”,例如,在某塑料制品废弃物处理厂周边农田土壤中OPEs的总浓度高达1250 ng·g-1[14]. 植物作为初级生产者是陆地食物链的重要组成部分[23],也是有机污染物的重要存储体,植物对OPEs吸收、积累和迁移是了解其随食物链传递潜力的基础. OPEs在植物体内的归趋如图1A所示,通常包括吸收、分布、积累、代谢和分泌等过程. 土壤和大气中的OPEs可以被植物根系和叶片吸收并迁移至其他组织[14],还可以在植物体内发生代谢转化,其转化产物的毒性可能较母体化合物更高[24],最后大部分OPEs及其转化产物会积累在植物的不同组织中或少量被根系向外部环境中分泌[25]. 因此,探明植物根系对OPEs吸收、积累、迁移以及OPEs在植物体内的转化为今后OPEs的环境归趋、健康风险评价等研究起到一定指导作用,还可为被OPEs污染区域的植物修复提供理论基础. 本文重点综述了OPEs的植物根系吸收过程及其在植物组织器官归趋,系统分析和整理了影响OPEs在植物中归趋的因素,阐明了OPEs的转化过程及机制,并对目前仍存在的问题及未来的研究关注方向进行总结和展望.
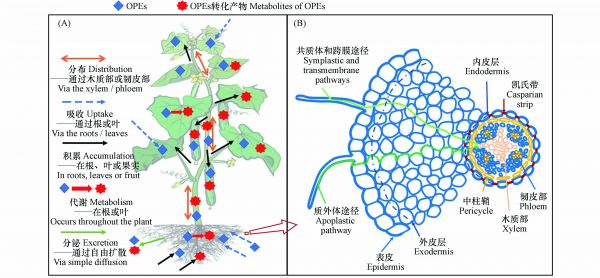
环境中的有机污染物主要通过两种途径进入植物组织:(1)根部吸收:有机污染物从根系表面经过横向运输穿过根系的表皮和皮层进入中柱部分到达根系内部,接着污染物随蒸腾流通过木质部向上迁移至茎、叶等组织[26-27];(2)叶片吸收:饱和蒸气压较大的有机污染物挥发至大气中,伴随干湿沉降到叶片表面,经扩散进入叶片内部;或直接以气态形式通过气孔吸收进入植物体[28-29]. 其中,根系吸收是植物摄入污染物的重要途径. 成熟的植物根部通常由表皮、外皮层、内皮层和中柱鞘构成. 土壤孔隙水中的有机物首先经扩散作用吸附在根表皮,随后分别经质外体途径(物质沿细胞壁通过细胞间隙的输运)、共质体途径(物质通过胞间连丝的输运)及跨膜运输进入根系皮层[30](图1B).
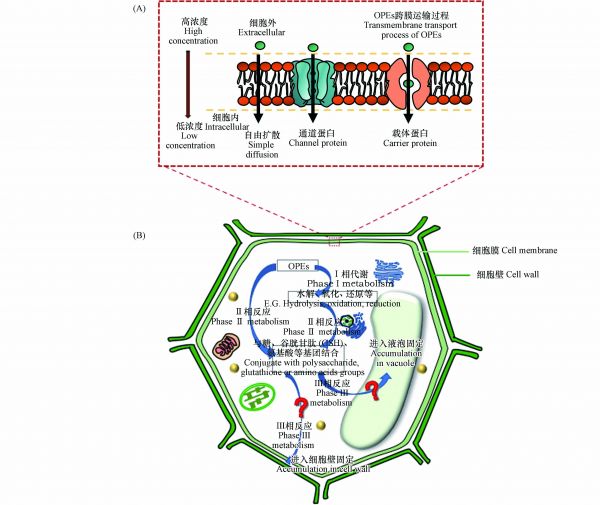
根系对OPEs的吸收也可在蒸腾作用或与蛋白结合等过程驱动下通过质外体或共质体途径被根系吸收[25, 31-32]. 在进入共质体之前,OPEs必须经跨细胞膜运输进入细胞. 物质的跨膜运输可分为被动运输(不耗能)和主动运输(耗能)过程. 其中被动运输又包括自由扩散和协助扩散. 前者由物质的浓度梯度驱动,后者主要由通道和载体蛋白协助吸收(图2A). 目前的研究发现OPEs主要通过被动运输方式被草莓(Fragaria ananassa)根系细胞吸收[25],并且除自由扩散外,不同取代基OPEs的促进扩散过程存在明显差异[31],其中TCEP(氯代烷基OPEs)是由水通道蛋白介导的促进扩散,TnBP(烷基取代OPEs)可通过阴离子通道扩散进入根系细胞,而TPhP(苯环取代OPEs)既可通过水通道,又可通过阴离子通道被植物根系吸收.
植物根系对OPEs吸收受其自身的理化性质、植物生理学特性以及环境条件等众多因素的共同调控. 表2列出了不同种类的植物根系在不同培养体系中对OPEs的吸收情况,统计发现OPEs的理化性质是决定其在植物根部吸收的关键因素. OPEs因其分子结构和取代基不同,造成其正辛醇-水分配系数(octanol-water partition coefficient, Kow)差异较大,导致其在植物中的吸收特征差异较大. 研究表明,植物根系对OPEs的吸收速率常数与其lg Kow呈显著正相关(P < 0.05)[32],表明疏水性强的OPEs(lg Kow = 3.5—9.5)比亲水性强的OPEs(lg Kow = 1—3)在植物根系的吸收速率更快[33-34].
除OPEs自身结构和理化性质外,植物种类和生理学特性(包括脂肪、蛋白质、多糖和水等)、蒸腾强度都会影响植物对有机污染物的吸收. 不同种类植物其生理学特性的差异是决定OPEs被根系吸收的重要因素. 尤其是植物根系生理学特性的差异会影响植物根系对OPEs的吸收速率[32]. 植物根系的蛋白质和植物蒸腾量对OPEs吸收的影响最大. 植物根系一般通过两种机制来吸收OPEs:其一,较亲水的OPEs主要通过蒸腾作用被植物根系吸收,植物的蒸腾量越大,其根系吸收这类OPEs的速率越快,如TCPP和TBOEP等OPEs的根系吸收速率常数与植物的蒸腾量呈显著正相关(P < 0.05)[32];其二,对于疏水性较强的OPEs,可以通过与植物根系和质外体中的蛋白质尤其是非特异性脂质转移蛋白(non-specific lipid transfer proteins, nsLTPs)结合[35],进而携带着OPEs进入根部并在根部脂肪中(膜和储存脂质)进行分配,最终使OPEs积累在植物根部[32]. 植物的质外体中含有包含nsLTPs在内的大量蛋白质,已有研究通过分子对接证明,OPEs与小麦TaLTP1.1蛋白的结合能与lg Kow呈显著的负相关(P < 0.005)[35],小麦根系中的非特异性转运蛋白TaLTP1.1可以与较强疏水性的OPEs结合,因此强疏水性OPEs(如TPhP和TEHP)在小麦根部吸收速率较快.
环境条件的变化也会影响植物根系对OPEs的吸收,土壤中的有机污染物需要从土壤颗粒中解吸在孔隙水中溶解才能被植物所吸收,土壤有机质是土壤中有机物的重要吸附剂之一,其控制有机污染物在土壤-植物系统中的吸附和吸收过程. 因此,土壤中有机质含量的差异会影响OPEs在土壤中的分布,从而改变其在植物中积累特征[36]. 研究发现,在溶解性有机碳含量较高的暗棕壤中生长的植物,其根系对OPEs的吸收能力明显强于生长于赤红壤中的植物[37]. 此外,在受重金属污染土壤中,土壤pH值越低越有利于溶解性有机碳与重金属结合形成更多有效态重金属,导致植物根系受损、细胞膜渗透性增加,最终促进植物根系对OPEs的吸收[37-38].
1.2. 植物根系对OPEs 的积累有机物污染物被植物根系吸收进入外皮层后,一部分亲水性强的物质会随蒸腾流进入内皮层,随后进入维管组织中,经木质部迁移至植物茎叶中,而亲脂性强的物质被根中有机组分(如脂质、蛋白质和多糖等)吸附固定并在根中积累[39]. 常用根系的富集因子(root concentration factors, RCFs)表示有机污染物在植物根中的积累能力. 研究发现,OPEs的RCFs与其lg Kow呈显著正相关(P < 0.05)[14, 31-32, 34-35]. 例如,当OPEs在植物根系达到富集平衡时,疏水性强的TEHP(lg Kow = 9.49)的RCF值在不同植物中均最高[32]. 然而,随着暴露时间延长,在植物根系中富集的卤代OPEs所占比例升高. 研究发现,莱州湾湿地的盐地碱蓬(Suaeda sals (L.) Pall.)中卤代OPEs,如TCEP和TCPP,平均含量达到了1.38—16.5 ng·g−1干重(dry weight, dw),占OPEs富集总量的52.3%,而烷基和芳基取代的OPEs比例只有39.4%和21.6%[40]. 由于相比烷基和芳基取代OPEs,氯代OPEs在植物中难以发生生物转化[35, 41]. 研究发现,氯代OPEs在根系的lg RCF随氯原子数量的增加而增加[34]. 如小麦对3种氯代OPEs吸收实验发现,小麦根系对TDCPP(含6个氯原子)的lgRCF值为2.18,对TCPP和TCEP(均含有3个氯原子)的lg RCF值分别为1.97和1.82.
也有研究将OPEs分为直链取代基(open-chain, OC)和环状取代基(electron-ring, ER)两类,ER-OPEs的富电子结构对其在土壤中生物有效性和迁移性起着重要作用,磷酸基团由芳基或环状的烷基包围,这些结构可以作为电子供体形成富电子云,促使这种结构的OPEs与植物根表面电荷相互作用,促进其在根表面的吸附[37]. 因此植物根部中ER-OPEs含量相对较高,占根部总OPEs的64%—89%,而地上部ER-OPEs(250—4300 ng·g−1)和OC-OPEs(240—4900 ng·g−1)的含量比较相近,对比这两类OPEs的RCF发现,ER-OPEs的RCFs值(0.36—3.2)均高于OC-OPEs的RCFs(0.042—0.26),说明ER-OPEs更容易被植物根部吸收[37]. 当OPEs进入根系后,不同植物生理特性的不同导致了OPEs积累情况的不同. 对比OPEs在4种植物的积累情况,发现小麦根系的脂肪含量最低导致OPEs在其中的积累量最少[32]. 进入细胞后,亲水性较强的TCEP(lg Kow = 1.63)主要分布于细胞液中,而疏水性强的TPhP(lg Kow = 4.7)则主要分配在细胞壁和脂质含量较高的细胞器中[31] ,说明除脂肪外,植物中的多糖成分也会影响OPEs在植物中的积累. 细胞壁中的多糖可以和芳基OPEs结合,减少其在植物中的跨膜运输[42],导致芳基OPEs(如TPhP)在植物细胞壁中的积累量相比于细胞器中的积累量更高[31],因此,植物细胞壁也是疏水性OPEs在根系积累的另一重要场所. 植物自身生长情况也会影响OPEs的积累,植物对OPEs的积累能力会随着其生长逐渐增强,到达完熟期的植物(如水稻和玉米)对OPEs的积累量最高[43-44],植物的生物量的增加可能是其积累能力增加的原因.
土壤中OPEs在植物根系的积累还与土壤总有机碳(total organic carbon, TOC)含量密切相关. OPEs在植物根系的RCF与土壤TOC含量呈负相关[37, 45-46]. 无论是亲水性OPEs(如TCEP和TCPP)还是疏水性OPEs(如TDCPP、EHDPP和TPhP等)在植物中的RCF均随土壤中TOC含量增加而降低[25],这是由于随OPEs疏水性的增加,其与土壤TOC的亲和力较强,越容易被土壤吸附,进而导致疏水性强的OPEs难以从土壤中解吸进而降低其生物可利用性[45].
2. OPEs在植物中的迁移(Translocation of OPEs in plants)OPEs在植物中会发生与其他有机物相同的传输过程,即通过木质部和韧皮部迁移至其他组织中[27, 47-48]. 一方面,OPEs由木质部迁移至地上部[32, 35, 49];另一方面,OPEs经韧皮部发生从“源”到“汇”运输[50-52],茎叶中经韧皮部转运的OPEs最终积累在植物的根部和果实中[25, 30](图1A). OPEs在进入维管组织前需要通过凯氏带,凯氏带在质外体(表皮的细胞外空间)和维管组织之间起疏水屏障的作用,仅由质外体途径吸收的物质必须穿过至少一个脂质双分子层才能进入木质部或韧皮部(图1B). OPEs被植物根系吸收后,经由木质部的转运过程是地上部OPEs的主要来源[32]. 一般认为lg Kow = 1—3的非离子型化合物更容易通过凯氏带,经在木质部向上迁移能力最强[47],这对OPEs同样适用,亲水性较强的OPEs(如TCEP、TCPP、TnBP、TBOEP等)在被根吸收后容易随蒸腾流经木质部运输至地上部[14, 32, 34]. 此外,TCEP和TCPP等亲水OPEs被发现在果实(如草莓)中检测到,表明其也可以经韧皮部运输[53]. 分根实验也同样证明亲水性较强的OPEs(如TCPP和TBOEP等)可通过韧皮部发生迁移[32, 52].
目前大量研究发现,OPEs在植物中的木质部迁移能力与其疏水性有关[14, 32, 34, 54]. 研究中常用迁移系数(translocation factor, TF)表征化学物质在木质部的迁移能力,TF是化学物质在植物地上部的浓度与在植物根部浓度的比,其数值越大表明化学物质经植物木质部向植物地上部转运能力越强. OPEs的lg Kow与TF值呈显著负相关性(P < 0.005)[14, 32, 49, 52],表明亲水性OPEs比疏水性OPEs有更强的向地上部迁移能力[14, 35, 54-55]. 因此TCEP和TnBP等亲水性强的OPEs在木质部的迁移能力更强且更容易积累在植物地上部;而lg Kow > 4.5的OPEs(如TPhP、TCrP等)会吸附在根表皮上,或与皮层细胞壁多糖及脂质等结合,导致其纵向运输的阻力增加难以迁移[56]. 同样,OPEs在韧皮部的迁移能力随其lg Kow的降低而增加:lg Kow < 3的TCPP、TCEP和少量TBOEP可以通过韧皮部迁移[32, 52],而lg Kow > 4.5的TPhP和TEHP极难通过韧皮部从植物地上部运输回根部[32].
OPEs在植物体内的迁移还受植物生理特性影响. 蒸腾作用被认为是亲水OPEs向上运输的主要动力[57],且植物的蒸腾能力越强,其根系中OPEs向地上部的运输速率越快. 亲水性强的OPEs(如TCPP等)其地上部吸收速率常数与植物的蒸腾量呈显著正相关(P < 0.05)[32],表明蒸腾能力更强的植物(如胡萝卜等)相比于蒸腾能力弱的植物(如生菜等)能更有效地将较亲水OPEs从根部运输至地上部. 一些疏水性OPEs如TPhP和TEHP也能部分迁移至地上部分,一方面是由于根尖的凯氏带尚未发育完全,或某些植物(如萝卜(Raphanus sativus L.)[58]和胡萝卜[59]等)的下胚轴缺乏凯氏带[60],使得少量疏水OPEs可以进入中柱鞘,经木质部转运[61],因此TEHP在萝卜中的TF值相比于其他植物要高得多[54];另一方面,木质部汁液中含有多种蛋白质[62],这些蛋白质可能有助于疏水OPEs从根向地上部转运.
3. OPEs在植物中的转化(Transformation of OPEs in plants)OPEs已被证实可以在动物[63-64]和人[65-66]的体内发生转化,在植物中也不例外[33, 52]. 研究发现植物中的酶体系和补脱氧核糖核酸序列(cDNA)与动物肝脏中的相似,对外源有机污染物也具有相似的代谢作用和代谢途径[67]. 因此,研究人员提出了“绿色肝脏”的概念,把植物作为降解有机污染物的重要场所[68]. 外源有机物在植物中代谢一般可以分为3个阶段,即Ⅰ相代谢、Ⅱ相代谢和Ⅲ相代谢. Ⅰ相代谢一般包括水解、氧化还原等过程,将羟基、羧基等极性基团引入有机污染物中使其极性更强;Ⅱ相代谢主要是有机污染物与生物体内小分子,包括糖、谷胱甘肽(glutathione, GSH)、氨基酸、硫酸等基团结合,其结合产物亲水性增强[65];Ⅲ相代谢主要是将Ⅱ相代谢产物通过转运蛋白运输至液泡中或质外体[69-70],使其进入在植物液泡中积累,或与细胞壁的纤维素、木质素等结合固定在细胞壁中,从而降低其毒性,避免干扰植物的其他正常生理生化过程[71]. 已有研究表明,OPEs可以通过Ⅰ相代谢和Ⅱ相代谢在植物体发生转化[31, 33, 35, 52](图2B).
水解反应和氧化反应是参与OPEs在植物中Ⅰ相代谢的重要转化过程(图3),其中OPEs在植物中水解生成对应的磷酸二酯是其在植物中的主要转化过程[31, 33, 35]. 研究发现,不同取代基OPEs在24 h内快速水解为对应的二酯,随后很少一部分磷酸二酯进一步水解为单酯[33](图3). 在OPEs的水解反应中,酸性磷酸酶(acid phosphatase, ACP)是催化OPEs水解的关键性酶[33]. 尤其是在外部环境缺磷的条件下,植物产生和向外分泌的大量的ACP会加速植物体内或暴露溶液中OPEs的水解[33]. 另外,由于不同取代基OPEs与酶的结合亲和性以及结合方式的不同,会造成OPEs水解速率的差异. 通过大量实验结合密度泛函理论(density functional theory, DFT)计算证明,与芳基OPEs和烷基OPEs相比,氯代烷基OPEs(如TDCPP)在植物体内较难发生水解,其水解速率最慢[31, 33, 35, 52].

此外,氧化反应也是OPEs在植物中重要转化途径(图3),细胞色素P450酶(cytochrome P450, CYP450)通过多种生物合成反应和解毒过程,在促进植物生长发育和保护植物免受逆境胁迫方面起重要作用[72]. OPEs的生物转化过程中,CYP450的主要作用是氧化OPEs中的碳原子生成羟基化产物[73],生成的羟基化产物还可能被进一步氧化生成羧基化产物[33]. 通过OPEs与小麦CYP71C6v1的分子对接也证实小麦中的CYP450酶是催化非氯代OPEs转化的主要酶[35]. 在氧化反应过程中,非氯代OPEs(如TBOEP、TPhP、TiBP和EHDPP等)更容易在植物体内被代谢和转化. 与氯代OPEs相比,非氯代OPEs与CYP71C6v1的结合能绝对值更大,且随OPEs的lg Kow 增大,与CYP71C6v1结合能力越强[35],表明疏水性强的OPEs更容易与CYP71C6v1的空腔对接并和活性位点结合,进一步证明了非氯代OPEs更容易被CYP450催化代谢,进而生成更多的Ⅰ相代谢产物[33, 35]. 研究还发现,除了水解反应和氧化反应外,烷基OPEs(如TBOEP)还可在植物中发生脱烷基化反应[35],氯代OPEs也被证实可在植物体内发生还原脱氯过程,其转化产物已被检测到[33].
与人类或动物体相似,OPEs在植物体中也可发生Ⅱ相代谢过程,但是,OPEs因其取代基不同,其Ⅱ相结合产物也有较大差异(图3). 研究发现,氯代OPEs与小麦谷胱甘肽S-转移酶(glutathione S-transferases, GSTs)中的TaGST4-4负电结合能更强[35],表明GSTs是Ⅱ相代谢过程催化氯代OPEs转化的主要酶,因此GSH结合态产物是氯代OPEs在植物中的主要Ⅱ相代谢产物[33, 35]. 而非氯代OPEs则与其他生物小分子结合,生成包括甲氧基结合态产物、葡萄糖醛酸结合态产物、硫酸结合态产物、半胱氨酸结合态产物等更多结合态产物[33, 35].
与动物不同的是,一般认为,Ⅲ相代谢是植物所特有的. 目前,在植物中已经发现了一些特定转运蛋白,他们能主动将结合态的外源污染物进行跨膜转运[74]. 已有研究[75]发现植物ABC转运蛋白可以将GSH结合的药物运输进入液泡中积累;MRP(multidrug resistance associated protein)蛋白(一种ABC转运体)能将GSH结合的DNP等有机物运输至液泡中[75]. 但是,有关OPEs的Ⅲ相代谢过程尚不清楚,需要进一步研究.
4. 结论与展望(Conclusions and prospects)目前,国内外针对环境介质-植物中OPEs的吸收积累、迁移及代谢行为的研究还处于起步阶段,目前的研究可得到以下3点结论:(1)OPEs可被植物根系吸收,并经木质部和韧皮部在植物体内进行迁移;(2)OPEs理化性质(lg Kow、分子结构等)、植物生理学特性(脂肪、蛋白质含量和蒸腾作用强度等)和环境条件(培养介质的性质、共存物质的影响等)是影响植物根系对OPEs的吸收、积累和迁移的重要因素;(3)OPEs也会在植物体内酶(ACP、CYP450、GST等)催化下发生水解、氧化、还原及结合等转化,最终造成OPEs及其代谢产物会在植物体内积累. 但目前仍然有如下问题需要深入研究:(1)大量研究关注OPEs的根系吸收过程,而OPEs通过叶片的吸收途径也不容忽视,因此有必要研究不同理化性质OPEs的叶片吸收途径(气孔、角质层等)和机理;(2)目前尚未发现OPEs的Ⅲ相代谢过程,因此有必要研究OPEs及其转化产物在Ⅲ相代谢过程中的转运体和最终富集场所(液泡或细胞壁);(3)不同环境条件(温度、pH、有机质含量、营养条件等)会影响植物的生长及生理变化,进而影响植物对污染物的吸收、迁移和转化. 因此研究不同环境条件下OPEs在植物中的行为和过程,将有助于对解释实际环境中OPEs的环境行为提供新思路. 以筛选出吸收、富集能力强并将OPEs降解为低毒化合物的植物物种,为OPEs的植物修复提供理论与技术支持.
参考文献 (75)相关知识
饮食中有机磷酸酯暴露现状及其对消化系统影响的研究进展
环境污染物联合暴露的人体健康累积风险评估研究进展
微塑料的人体富集及毒性机制研究进展
研究进展
造血干细胞移植治疗神经系统疾病的研究进展
肠道菌群利用膳食纤维及其与人体健康关系研究进展
汪丽萍:全谷物中生理活性物质的研究进展与展望
基于生物有效性的蔬菜重金属健康风险精细化评估研究进展
植物油健康营养强化与功能化
科研|土壤健康评估指标、框架及程序研究进展
网址: 有机磷酸酯在植物体内的吸收、积累、迁移与转化研究进展 https://www.trfsz.com/newsview193759.html
推荐资讯
- 1男女激情后不宜做哪些事 4181
- 2从出汗看健康 出汗透露你的健 3839
- 3早上怎么喝水最健康? 3633
- 4习惯造就健康 影响健康的习惯 3283
- 5五大原因危害女性健康 如何保 3187
- 6连花清瘟、布洛芬等多款感冒药 2957
- 7男子喝水喉咙里像放了刀子一样 2455
- 810人混检核酸几天出结果?1 2225
- 9第二轮新冠疫情要来了?疾控中 2219
- 10转阴多久没有传染性?满足四个 2163






