综述丨PLANT CELL: 植物与微生物在质外体中的相互作用
编译:微科盟小木,编辑:微科盟小编、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
质外体是连接组织和器官之间细胞的连续植物区室,是植物和微生物之间相互作用的首个位点之一。植物细胞壁(CW)占据了质外体的大部分,由多糖、相关蛋白质和离子组成。这个细胞的动态部分构成了微生物的基本物理屏障和营养来源。同时,植物细胞壁在跨界检测、识别和对其他生物的反应中发挥着重要作用。因此,植物和微生物都能以多种方式改变植物细胞壁及其环境,从而从相互作用中获益。本综述讨论了微生物与植物接触和通讯过程中植物细胞壁上发生的关键过程。最后,我们认为需要考虑这些局部和动态变化,以充分理解植物-微生物相互作用。
论文ID
原名:Plant-microbe interactions in the apoplast: Communication at the plant cell wall
译名:质外体中的植物-微生物相互作用:植物细胞壁上的通讯
期刊:The Plant Cell
IF:12.085
发表时间:2022.2
通讯作者:Clara Sánchez-Rodríguez
通讯作者单位:苏黎世联邦理工学院生物系
DOI:10.1093/plcell/koac040
综述目录
1 前言
2 植物CW
3 植物CW环境的微生物修饰
3.1 CW多糖
3.2 质外体pH
3.3 CW离子
4 植物CW强化防御
4.1 CW多糖
4.2 ROS和木质素
4.3 软木脂
5 总结与展望
主要内容
1 前言
质外体是植物质膜和外表面之间的区室。这个空间包含了质膜蛋白的胞外结构域;细胞壁(CW)多糖、蛋白质、多酚和离子,还有水和空气。质外体在植物生物学中具有重要作用,包括光合作用、蒸腾作用、水分和养分的吸收以及信号分子的移动(图1)。在所有非病毒微生物定植植物期间,质外体是最初建立相互作用的空间,也是入侵者在宿主体内度过大部分(如果不是全部)生命周期的地方。因此,质外体作为植物-微生物通讯的界面是一个高度活跃的场所。
微生物和植物之间的相互作用从共生到寄生都有。根据病原体在宿主中的不同生活方式,病原体被进一步分类为生物营养型、坏死营养型和半生物营养型,尽管对于这些分类的准确性存在一些争议。无论相互作用的类型是什么,微生物都需要植物CW的松弛和降解,一方面是为了获得营养,另一方面是为了创造生长空间。其中一些植物CW改变是由入侵者释放的CW片段引起的,这些片段会被宿主通过质膜模式识别受体(PRRs)识别为损伤相关分子模式(DAMPs),PRRs结合释放的CW片段(图2A)。其他PRRs识别微生物相关分子模式(MAMPs),例如通过植物质外体酶的作用从真菌CWs释放的几丁质寡聚体。PRRs识别MAMP和DAMP会触发植物模式触发的免疫(PTI),导致重要的质外体改变作为基础防御,如质外体pH变化、Ca2+从CW释放和内流到细胞质,以及活性氧(ROS)的产生。对入侵者的信号转导和转录反应的激活,被各种植物激素信号放大,导致复杂的防御反应。植物对每一种感染的反应具有特异性,但包括程序性细胞死亡、抗菌肽的分泌、病程相关蛋白(PRs)和进入质外体的蛋白酶,以及CW的结构修饰。微生物必须绕过这些质外体防御才能在植物中生存。为此,微生物进化出了不同的机制以尽量减少宿主对它们的检测,并阻止MAMP/DAMP触发的防御。
近几十年来,植物对分子模式感知反应的研究一直是植物抗逆性研究领域的热点。鉴于新兴的方法,如高分辨率显微镜、固态核磁共振等结构解析技术和复杂的计算模拟,植物CW的架构和机械结构正在重新获得其在该领域的主导作用。因此,在本篇综述中,我们将避免讨论有关DAMP/MAMP感知、随后的细胞内信号通路和一些下游反应的细节,这些在其他地方已经得到了广泛的讨论。相反,我们侧重于关注植物CW作为相互作用中的活性元素,描述它如何被微生物修饰并被植物强化,以及这与离子运动和细胞外蛋白质活性的变化之间的关系。本综述主要关注致病性微生物,不包括互惠共生菌和病原体之间的详尽比较。
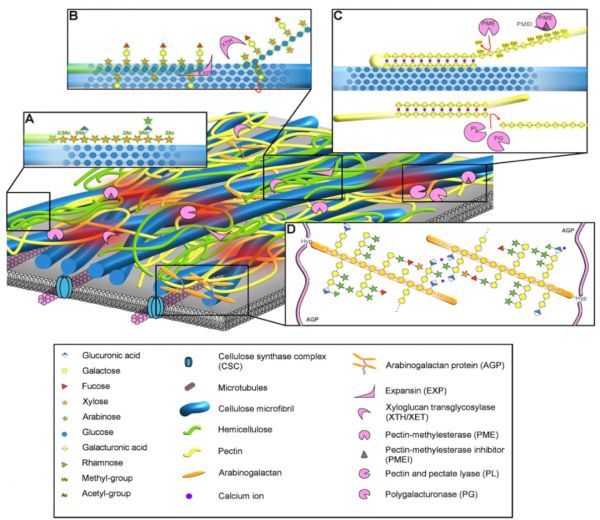
图1 初生细胞壁的结构模型。
基于洋葱表皮CW的AFM图像:纤维素微原纤维(蓝色原纤维)嵌入果胶(黄色链)、半纤维素(绿色链)、阿拉伯半乳聚糖蛋白(线性蛋白骨架为粉红色,糖基化羟脯氨酸残基为橙色)和其他植物CW蛋白(粉红色)。被称为生物力学热点(红色阴影)的有限区域被认为对CW力学有很大的贡献,可能包括纤维素和其他分子之间的接触位点。纤维素微原纤维由纤维素合酶复合物沿着微管在质膜上合成,而其他多糖则在高尔基体上合成并在质外体组装。(A)木聚糖通过氢键与纤维素微原纤维的亲水性表面结合,其构象与纤维素中的葡聚糖链相同。(B)基于分子动力学模拟,木葡聚糖与纤维素的疏水性表面结合,但这种相互作用的细节需要进一步研究。这种相互作用被扩张蛋白(EXP)和木葡聚糖内转糖基酶(XTH/XETs)修饰。扩张蛋白是一种非水解蛋白,通过一种未知的机制引起CW松弛,最有可能的是通过分离相互作用的半纤维素和纤维素。XTH将木葡聚糖链转糖基化到纤维素的葡聚糖链上,形成新的共价键,用红色标出。XTHs还可以生成木葡聚糖-木葡聚糖连接,或水解木葡聚糖(图中未显示)。(C)同型半乳糖醛酸被果胶甲基酯酶(PMEs)去甲基化,而PMEs又被果胶甲基酯酶抑制剂(PMEIs)抑制,从而调节果胶的甲基化状态。PME-去甲基化的半乳糖醛酸区结合Ca2+(紫红色圈),在分子内或分子间形成二聚蛋盒结构。Ca2+结合的果胶似乎与纤维素有关,尽管这种相互作用的细节尚不清楚。去甲基化的同型半乳糖醛酸的大小通过果胶酸和果胶裂解酶以及多聚半乳糖醛酸酶(PLs和PGs)的裂解而减小。(D)阿拉伯半乳聚糖蛋白的葡萄糖醛酸残基可以结合Ca2+,这可能会导致二聚化。
2 植物CW
植物CW是一种异质混合物,主要由多糖组成。由于CW组分之间的相互作用,不同CW的性质不同,甚至在同一细胞周围也是如此。为了适应不断变化的细胞和器官需求,可以通过质外体蛋白、改变离子浓度和沉积新材料来修饰CW特性。本节我们主要描述了真双子叶植物初生细胞壁的组成,以模式植物拟南芥(Arabidopsis thaliana)为例。然而,多糖的类型和结构(特别是半纤维素和果胶)在系统发育上各不相同,以前在其他地方已经讨论过。在同一植物中,CW的组成和厚度在不同的组织中有所不同,如木质部导管和应拉木的CWs,尽管这超出了本文的讨论范围。
CW多糖包括纤维素、半纤维素和果胶。纤维素是由纤维素合酶复合物在质膜上合成(图1),而果胶和半纤维素则在高尔基体中合成。在纤维素合成过程中,β-1,4-葡聚糖链组装成半结晶微纤维,形成CW的结构基础,有助于其强度、组织结构和功能。据报道,纤维素通过其结构相似的β-1,4-糖苷键与半纤维素结合(图1A和B)。半纤维素的组成复杂,在不同的系统发育类群中各不相同,但半纤维素都具有主链β-1,4-糖苷键,尽管有些半纤维素具有额外的主链糖苷键。这些相互作用被认为影响细胞壁强度,这由许多半纤维素突变体所显示的发育缺陷所支持。半纤维素与纤维素微原纤维的结合可以防止纤维素聚集,并使微纤维相互交联或与不同的CW组分(如酚醛聚合物木质素)交联。防止纤维素聚集对于维持微纤维在壁的不同薄层中的方向可能很重要,这可能有助于抵抗不同方向的机械力。微纤维之间或与其他成分之间的任何潜在交联,都可以防止微纤维的滑动,这被认为有助于细胞扩张。纤维素和半纤维素木葡聚糖之间的相互作用位点称为生物力学热点,可影响细胞壁的生物力学特性,并被认为是扩张蛋白(图1B)的靶标,这是一种可使CW松弛的蛋白质。生物力学热点的确切结构尚不完全清楚。木葡聚糖内转糖基酶(XTH/XETs,图1B)也可重塑木葡聚糖并将其与纤维素和其他木葡聚糖共价连接。在一些植物中也发现了类似具有重塑活性的其他半纤维素多糖。质外体CW修饰蛋白,如扩张蛋白和XTH/XETs的作用受pH的调节。
与结构相似的纤维素和半纤维素相比,植物CWs(尤其是真双子叶植物)的其他主要多糖成分是果胶。果胶主要由半乳糖醛酸(HG)组成,这是一种可以用不同的糖分支装饰的骨架,形成不同的果胶多糖,包括鼠李糖半乳糖醛酸-II。HGs以乙酰化和大量甲基酯化的形式分泌。一旦到达质外体,它们被CW果胶甲基酯酶(PMEs)去甲基化,并被果胶乙酰酯酶去乙酰化。PME活性受果胶甲基酯酶抑制剂(PMEIs)以及其他因素的调节,如可以切割PME的自抑制结构域的蛋白酶。PME活性受到pH的严重影响,通过改变PMEIs和PMEs的相互作用,以及通过改变PMEs的持续合成能力,从而影响去甲基化残基块的形成。HG的去甲基化区域可以结合Ca2+,产生所谓的“蛋盒”结构,形成凝胶(图1C)。蛋盒被认为可以使不同的果胶链二聚化,从而影响细胞壁的机械性能。Ca2+结合在体外受HG乙酰化的影响,这可能也会影响主链的构象。尽管HG的主链形状与半纤维素和纤维素不同,但它也能与纤维素相互作用(图1C)。这种相互作用的程度和果胶的刚度与去甲基化呈正相关。与此相一致的是,蛋盒HG在空间构象上似乎更接近纤维素。Ca2+的结合使得HG的构象及其与纤维素的相互作用受pH的调节,因为HG在低pH时的质子化阻止了与Ca2+的离子相互作用。另一方面,HG去甲基化可使细胞壁松弛,使细胞扩张。在表皮CW中观察到的HG去甲基化被预测允许CW的这些区域的扩张,导致表皮细胞中叶的形成,尽管该模型存在争议。多聚半乳糖醛酸酶(一种水解HG的酶,其中一些更喜欢去甲基化的HG作为底物)的过表达也会导致细胞扩张的增加和果胶-纤维素相互作用的减少,这表明较小的果胶与纤维素的相互作用更少。因此,据报道果胶去甲基化可增加或减少CW刚度,这取决于所使用的实验系统。总之,尽管去甲基化可能使HG链交联并与纤维素结合,但它也使HG更容易被果胶裂解酶和水解酶消化,这些酶更喜欢带电荷的果胶,这可能解释了对CW力学的矛盾影响。其中一些不同的影响可能是由于产生的去甲基化模式的差异,这可能使果胶或多或少地螯合钙或被裂解酶和水解酶切割。
一些果胶和半纤维素木聚糖已被报道与阿拉伯半乳聚糖蛋白(AGPs)共价连接,尽管尚不清楚这种相互作用有多广泛。AGPs位于多糖和蛋白质之间的界面,其蛋白质主链大部分未展开且高度糖基化(图1D)。AGP侧链末端的葡萄糖醛酸(GlcA)残基可与Ca2+结合。大多数典型的AGPs通过糖基磷脂酰肌醇(GPI)锚定附着在质膜上,但也有一些释放到细胞壁中。CWs还含有非多糖聚合物木质素和软木脂。木质素是一种疏水性苯丙烷聚合物,可以与其他CW组分交联,包括多糖和潜在的蛋白质。果胶单体在细胞质基质中生物合成,并在质外体中由漆酶和过氧化物酶蛋白聚合。木质素的聚合受到严格的时空控制,通常存在于特定组织中,如木质部导管、纤维细胞和凯氏带,它也可以在对病原体的反应中产生。软木脂是一种疏水性脂基聚合物,可形成感染或损伤细胞CWs的一部分。
我们现在对CW多糖之间的一些主要相互作用进行了较为详细的描述(图1)。但这些相互作用及其与CW,特别是整个细胞或组织的涌现特性的关系的内聚模型仍在开发中。这与植物-微生物相互作用特别相关,我们需要了解CW的性质和结构如何与疾病的发展相关联。
3 植物CW环境的微生物修饰
3.1 CW多糖
微生物需要对植物CW进行修饰,以与宿主进行适当的相互作用。为此,它们利用具有重要CW松弛作用的非催化蛋白,如扩张蛋白和扩张蛋白样蛋白,松弛蛋白和膨胀素,这些蛋白最近被综述。与这些蛋白质一起,入侵者分泌一系列CW降解酶(CWDEs),根据其催化机理和序列相似性,将其分类为碳水化合物活性酶数据库(CaZY)中的家族:糖基水解酶(GH)、多糖裂解酶(PL)、碳水化合物酯酶(CE)和辅助活性(AA)家族,包括裂解性多糖单加氧酶(LPMO)。CWDEs去除取代基,破坏多糖之间的相互作用并将其打碎成更小的片段,从而影响CW结构,尽管这些影响尚不清楚(一些潜在结构变化的模型如图2所示)。病原体分泌的CWDEs的数量和种类多少与它们的生活方式和宿主有关。一般来说,坏死营养型细胞的基因组中CaZY家族的数量高于生物营养型细胞。这在很大程度上是因为坏死营养型细胞杀死了宿主细胞,而不是利用它们作为初级代谢物的持续供应,因此它们必须降解并以CW的复杂聚合物为食。相比之下,许多生物营养菌和共生微生物的CWDEs数量减少,可能转而依赖内源性植物CWDEs。
病原体CWDE突变体提供了强有力的证据,表明特定多糖的降解对疾病的发展至关重要。一些纤维素酶库减少的病原体的毒力受损。例如,细菌Dickeya dadantii和Clavibacter michiganensis中单一纤维素酶的缺失降低了可见疾病症状的严重程度。9种预测的纤维素酶(GH6和GH7家族成员)的敲除也降低了稻瘟病菌(Magnaporthe oryzae)的毒力,这可能是由于乳突形成增加或真菌的乳突降解能力降低。然而,最近的数据表明,具有低纤维素降解能力的尖孢镰刀菌(Fusarium oxysporum)通过质外体的速度更快,具有高毒力,但腐生生长和繁殖受损。因此,纤维素是某些病原体致病的重要结构屏障,而对于其他病原体而言,纤维素的降解对腐生阶段很重要。
半纤维素和果胶的降解也与发病机制有关。木葡聚糖的降解似乎对某些丝状病原体的感染很重要,如大豆疫霉菌(Phytophthora sojae)和尖孢镰刀菌突变体,当缺乏单一GH12木葡聚糖酶时,它们的毒性要小得多(图2B)。相比之下,Botrytis cinerea木葡聚糖酶的水解活性对其在植物中的功能并不重要,虽然无论其活性如何,该酶都会诱导细胞死亡。同样,两种黄萎病菌(Verticillium dahliae)GH12木葡聚糖酶也会导致棉花(陆地棉(Gossypium hirsutum)的细胞死亡,降低真菌的毒力,在没有这些酶的情况下,真菌的毒性会更强。
其他半纤维素对抗病性也很重要,有大量的报告表明了病原菌木聚糖酶在被子植物病害发展中的重要性。真菌V. dahliae和M. oryzae、细菌Xanthomonas oryzae和卵菌Phytophthora parasitica中的木聚糖酶突变体的毒力降低。但木聚糖酶活性并不总是必要的,即使是对木聚糖含量高的植物的侵染(如小麦),小麦和大豆禾谷镰刀菌(Fusarium graminearum)侵染中,木聚糖酶表达调控因子的缺失对症状几乎没有影响,尽管木聚糖酶活性下降。禾谷镰刀菌PMEs对果胶的去甲基化增加了有症状感染小麦小穗的百分比。V. dahliae中的果胶酸裂解酶、R. solanacearum中的多聚半乳糖醛酸酶(以及其他例子)以及致病疫霉菌(Phytophthora infestans)中新发现的HG-特异性LPMO中的突变会损害毒力(图2B)。另一方面,禾谷镰刀菌多聚半乳糖醛酸酶突变体在小麦和大豆中的毒力与野生型真菌相似。很明显,一些植物CW降解对发病机理和共生很重要,大多数物种需要降解多种多糖,但降解特定CW组分的重要性因不同微生物物种而异,例如CWDE突变体增强或不影响毒力。CW降解的重要性可以被其他CW组分的降解所掩盖;例如,木聚糖和果胶降解对禾谷镰刀菌的重要性只有在失去这两种活性的双突变体中才明显。从微生物CWDE突变体的角度,特别是甘露聚糖和阿拉伯半乳聚糖的角度来看,各种多糖在植物防御中的作用尚未得到充分研究。在某些情况下,主要的困难是解决某些植物的挑战,如裸子植物,它们具有高甘露聚糖含量。
病原体需要CWDEs才能有效建立疾病;但CWDE活性的产物可以被植物识别为DAMPs,从而激活免疫反应。来自HG的低聚半乳糖醛酸(OGs);来自纤维素、混合连接葡聚糖和木葡聚糖的纤维寡糖;来自木聚糖的木寡糖;据报道,来自β-1,3葡聚糖的与胼胝质相似的低聚糖以及木葡聚糖-寡糖均能激活PTI。来自不同聚合物的寡糖诱导不同的免疫反应;木葡聚糖-寡糖和OGs均能减轻B. cinerea和Hyaloperonospora arabidopsidis感染引起的疾病严重程度,但只有OGs在应用于叶子时会诱导ROS爆发。纤维寡糖在拟南芥中也没有诱导ROS爆发,但却上调了防御基因的转录,如WRKY30。
植物可以精确地解码低聚糖。例如,将半乳糖和岩藻糖二糖添加到七糖木葡聚糖衍生的寡糖中使其能够抑制生长素诱导的黄化豌豆(Pisum satium)茎的伸长。这些来自同一聚合物的不同低聚糖可能是不同CaZYmes的产物。例如,GH30木聚糖酶比GH11木聚糖酶产生更长的木寡糖,而且葡萄糖醛酸取代在这两种木寡糖上的位置不同。植物和病原体在其基因组中的CaZYme家族存在差异;例如,许多真菌分泌GH12木葡聚糖酶(图2B),许多细菌编码GH30木聚糖酶,这些GH家族在杨树(Populus trichocarpa)和拟南芥基因组中都不存在。因此,植物可能会将生长过程中来自其自身GHs的CW降解产物与入侵者GHs释放的CW降解产物区分开来。
PRRs对DAMP的感知是植物免疫和病理研究中最活跃的领域之一,也是人们经常讨论的话题。然而,对于大多数DAMPs来说,它们的PRRs是未知的,识别此类蛋白质将继续成为一个重要的研究领域,因为我们要确定特定的但相似的寡糖结构如何产生不同的植物反应。这个领域特别复杂,因为需要PRRs来检测非常具体的结构,但也需要检测高度不相关的结构。例如,受体CERK1参与检测短链混合连接葡聚糖寡糖(MLGs)和β-1,3-葡寡糖,但不参与检测长链β-1,3-葡寡糖。尽管cerk1突变体在区分不同大小的相似结构方面具有这种特异性,但它在检测多种MAMPs(如几丁质、LPS和肽聚糖)时受到影响。出乎意料的是,最近证明CERK1对在拟南芥、水稻(Oryza sativa)和大麦(Hordeum vulgare)中检测混合MLGs至关重要,尽管这在拟南芥中存在争议,因为不同的实验小组在技术上类似的实验中显示了相反的结果。有趣的是,只有单子叶植物(而非真双子叶植物)的CWs中含有MLGs。在卵菌CWs中发现了结构相似的MLG,因此,检测MLG-寡糖的能力可能对于真双子叶植物检测来自卵菌的MAMPs而不是来自它们自身CWs的DAMPs很重要。
为了减少DAMP诱导的PTI,病原体试图控制植物对多糖DAMPs的感知。出于这个目的,一些微生物会分泌蛋白质来隔离DAMPs,从而阻止其与相应的PRRs结合,例如Ralstonia solanacearum凝集素结合含有木葡聚糖的岩藻糖。其他病原体也进化出了CWDEs,其降解产物尚未被植物识别为DAMPs,比如卵菌中的果胶溶解多糖单加氧酶(LPMOs)。LPMOs因其降解结晶和顽固性多糖的能力而对木质纤维素分解的贡献而闻名。因此,卵菌可能进化出了一种新的LPMO活性,其产物预计会减弱PTI,这可能模仿了植物通过产生氧化的OGs来减轻PTI的机制。果胶LPMOs在降低防御激活方面的新作用是一个推测性想法,还需要进一步研究。
与氧化多糖降解具有免疫逃逸功能的观点相反,一种纤维素特异性LPMO的产物在拟南芥中引起免疫反应,其中一些比广泛接受的DAMP纤维二糖更强。此外,一些病原菌表达AA7酶,该酶被认为可以氧化寡糖,并可能是降低病原体产生的DAMPs的免疫原性的重要因素。有趣的是,植物利用AA7酶来降低DAMPs的免疫激活能力。未来对植物和病原体DAMPs稳态的研究将继续影响该领域。DAMP产生的负面影响可能超过CW结构破坏的好处。因此,消除某些微生物CWDEs可以增加它们的致病性,这可能是减少DAMP产生的副作用。例如,两种M. oryzae混合连接葡聚糖酶突变体的致病性增加性,因此,由这些蛋白的活性形式产生的DAMPs会导致宿主中的MAP激酶激活。
最近,已经证明CWDEs可以是MAMPs。一些无催化活性的CWDE突变蛋白诱导PTI,这表明酶本身,而不仅仅是它们产生的DAMPs被植物识别。三种十字花科(Brassicaceae)植物已被证明可以识别三种不同的短肽,这些短肽来源于真菌,可能是卵菌,多聚半乳糖醛酸酶。许多其他植物物种没有将这些多聚半乳糖醛酸酶识别为MAMPs,这表明CWDE衍生的MAMPs对一些相互作用具有高度特异性。这些肽埋藏在多聚半乳糖醛酸酶的疏水核心中,表明存在消化CWDEs并释放这些新MAMPs进行识别的植物蛋白酶。虽然胞外蛋白酶在植物免疫中的重要性已被证实,但其在从病原体CWDEs中释放MAMPs方面的潜在功能仍有待充分研究。
植物CW的微生物操作不仅会产生化学信号,还会产生机械信号。虽然CW松弛和细胞分离对于促进感染和为微生物细胞或摄食结构(如吸器和丛枝)的生长创造空间是必要的,但植物细胞可以感知质膜和CW所经历的机械力的变化,这在其他地方最近已经讨论过。机械传感对于产生免疫反应很重要,因为一些机械敏感蛋白中的突变体,如小电导样(MSL)质膜通道的机械敏感通道,在一些下游细胞壁强化反应和植物激素水平中受到影响。由植物进化而来的复杂的检测系统整合了所有这些信号,激活了包括强化CW在内的免疫反应,这将在后面讨论。
与CWDE和CW松弛蛋白中的微生物突变体一起,在某些CW组分的生物合成中受损的植物用于了解基于CW的抗病性,最近在其他地方进行了综述。这种方法产生了重要的见解,特别是对CW结构、CW完整性监测和植物激素之间的相互作用。例如,纤维素和果胶合成缺陷会影响茉莉酸、乙烯和水杨酸等的反应,而半纤维素合成缺陷会影响油菜素内酯和独脚金内酯的反应。即使在具有相同CW组分缺陷的突变体中,这种反应也具有高度特异性。例如,不同的木质素合成突变体在被激活的特定防御基因中几乎没有重叠。随着植物CW突变体的研究,微生物CWDEs在植物中的表达表明,这些酶介导的多糖结构变化或酶本身被植物感知。例如,靶向果胶或木聚糖的真菌乙酰酯酶的过表达会导致防御基因表达增加。具有果胶或木聚糖乙酰化缺陷的细胞壁合成突变体具有抗性表型,表明这种多糖结构的重要性。尽管有这些有趣的发现,但对CW中多糖结构作用的解释由于这些突变体中CW修饰所产生的各种激素和代谢变化而变得复杂。此外,某一CW组分的改变也会影响整个CW结构。因此,了解整个CW结构对于评估某一突变的影响至关重要。
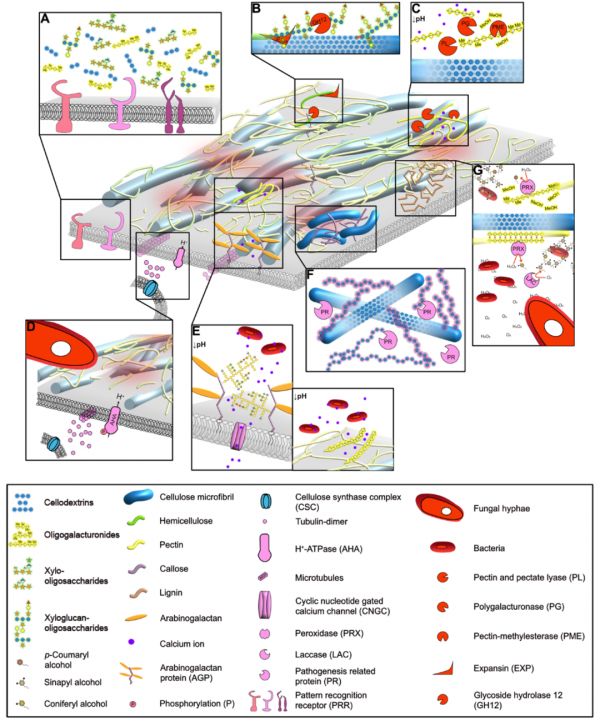
图2 微生物定殖对植物细胞壁环境的影响。
图1所示的初生CW的多糖被微生物CWDE和CW修饰酶松弛和降解(红色),且CW离子环境被修饰(A-E)。植物通过合成新的CW材料(F-G)作出响应。(A)植物CW多糖被微生物的酶所消化。一些由此产生的寡糖片段被质膜定位受体检测为DAMPs,诱导信号级联导致防御反应。显示的是确定的DAMPs(如纤维二糖和OGs)和潜在的DAMPs(如木葡聚糖和木聚糖)。(B)微生物木葡聚糖酶(GH12)和扩张蛋白(EXP)分别切割木葡聚糖并松弛木葡聚糖-纤维素相互作用。这可能会减少微纤维之间的交联,使纤维素微纤维分离/滑动,这对于CW松弛可能很重要。(C)微生物果胶甲基酯酶(PMEs)从HG中去除甲基,而果胶和果胶裂解酶(PLs)以及多聚半乳糖醛酸酶(PGs)将这种聚合物切割成更小的片段。在低pH值或小HG下,HG失去结合Ca2+离子的能力,这可能会减少HG和纤维素之间的相互作用。(D)与F. oxysporum接触后,通过过度激活植物质膜质子ATP酶(AHAs),质外体酸化导致质膜和皮层微管解聚过程中纤维素合酶复合物的消耗。这导致纤维素合成停止,并可能是对病原体感染的一般反应,尽管迄今为止仅在尖孢镰刀菌(F. oxysporum)中观察到。(E)质外体pH的下降导致阿拉伯半乳聚糖蛋白和同型半乳糖醛酸(HG)释放Ca2+离子,这可能对响应微生物而检测到的细胞溶质Ca2+峰有重要贡献。释放的Ca2+可以被细菌胞外多糖隔离,影响对激活植物免疫很重要的Ca2+动态。(F)为了应对一些微生物的攻击,植物细胞会形成由纤维素、胼胝质(紫色链)、病程相关蛋白(PRs)和具有抗菌特性的次级代谢物组成的乳突。乳突多糖以未知的方式相互作用,尽管胼胝质在体外改变了纤维素凝胶的延伸性。(G)植物细胞通过过氧化物酶(PRXs)和漆酶(LACs)的活性经木质化(浅棕色链)来增强其CW。PRXs与去甲基化的HG结合,可能有助于在CW损伤部位形成木质素。一些微生物被困在新形成的木质素网络中。微生物可以通过其胞外聚合物清除活性氧。显示的许多模型都是推测性的,基于相关背景(C、D、F、G)的研究或已充分描述的酶的已知活性(E、F)。
3.2 质外体pH
据报道,质外体碱化是植物对MAMPs/DAMPs的首批反应之一,同时胞质Ca2+升高。质外体pH主要受质膜H+-ATP酶(拟南芥中的AHAs)活性、H+导入协同转运其他分子的通道和阴离子外流的调节。质外体中H+减少的确切分子机制仍不清楚,但这是植物防御微生物所必需的,如在酸性介质中生长的植物所示。因此,为了抵消pH值的增加,各种微生物依赖于质外体的酸化来定殖它们的宿主。其中,病原真菌灰霉菌(Botrytis cinerea)和菌核病菌(Sclerotinia sclerotiorum)在其宿主的质外体中分别分泌柠檬酸和草酸。有益微生物也会降低质外体的pH值以建立它们之间的相互作用,如深绿木霉(Trichoderma atroviride),真菌和植物AHAs参与质外体的酸化。
另一方面,一些微生物受益于碱化的质外体,它们在感染期间触发。这是多种水果感染微生物的情况,如炭疽菌(Colletotrichum spp.)和链格孢菌(Alternaria alternata)。但实际情况更为复杂,同一病原菌在宿主感染过程中可诱导酸化或碱化,且质外体酸化也会影响植物防御。这些水果病原菌似乎会分泌小型pH调节剂,根据碳的可用性来增加或降低环境的pH值,在碳过剩的情况下会发生酸化。类似地,最近有报道称,尖孢镰刀菌可诱导质外体立即酸化,然后随着时间推移发生碱化。
镰刀菌(Fusarium spp.)依靠碱性环境来感染植物,它们通过分泌类似植物快速碱化因子(RALFs)的小肽来达到这一目的。植物RALFs已被证明与CW结合的富含亮氨酸重复伸展蛋白(LRXs)结合,这可能影响CW的特性。对于病原体RALF样,可以设想类似的相互作用,这可能会改变植物的CW特性。尖孢镰刀菌诱导初生质外体酸化的机制、其如何调节根内pH以及酸化和碱化之间的分子转换发生尚不清楚。此外,与尖孢镰刀菌接触后观察到的质外体pH急剧下降会通过从质膜上去除CSCs和分解皮层微管来损害纤维素合成机制,这会影响植物-真菌相互作用(图2D)。质外体pH的变化及其对植物-微生物相互作用结果的影响取决于时间、器官甚至细胞层。在不同的病理系统中,植物-微生物相互作用过程中,质外体pH值变化的复杂性需要用更大的时空分辨率来解开。此外,在相互作用的每个阶段,阐明植物和病原体蛋白质对这些pH变化的贡献将是至关重要的。
质外体pH不仅影响疾病的发展,而且对植物CW也有相关影响,可改变其物理和化学性质。如上节中所述,许多CW蛋白的活性受pH调控,如扩张蛋白、XTH/XETs、PMEs和PMEIs(图2C)。因此,pH的下降可能会增强扩张蛋白对CW的松弛,通过转糖基化改变水解和交联之间的平衡,或增加去甲基化HG残基的生成(图2A和B)。此外,质外体pH值影响纤维素和果胶的非酶促结合(图2C)。因此,微生物对质外体pH的调节可能会改变植物和微生物CWDE与CW修饰蛋白的活性,并可能改变多糖的相互作用,从而使CW重组有利于定殖。
3.3 CW离子:Ca2+和B
CW修饰的检测导致细胞信号的变化,特别是涉及质外体离子。其中,Ca2+离子是PTI中的首批参与者,作为第二信使调节植物防御的协调或适应微生物的存在。Ca2+通过质膜上的环核苷酸门控钙通道从质外体运输到细胞质基质,通过活化PRRs磷酸化打开钙通道。此外,Ca2+可以从细胞器(特别是液泡)进入细胞质。其他通道和泵在Ca2+内流中的参与及其对微生物触发的植物反应的贡献仍有待充分研究。一旦Ca2+进入细胞质,植物特异性Ca2+依赖性蛋白激酶家族(CDPKs)的功能是解码Ca2+信号。CPDKs对Ca2+具有不同的亲和力,因此下游信号可区分不同的Ca2+-刺激,如前文所述。
质外体Ca2+与含有带电糖醛酸(GlcA或GalA)的植物CW成分相互作用;即去甲基化-HG和AGPs,塑造CW的结构和刚度,如植物细胞壁部分所述(图1C和D)。这种对pH敏感的Ca2+池可能是来自质外体的部分Ca2+内流的来源,并可能对微生物诱导的Ca2+信号具有重要的放大作用(图2E)。支持这一点的是,AGP GlcA-残基的丢失会损害植物发育并改变拟南芥在H2O2处理下的Ca2+信号转导,但尚未研究此类突变体在植物-微生物相互作用背景下对Ca2+信号转导的影响。
除了作为Ca2+存储库外,AGP的Ca2+结合可能使其pH可调节多聚化和/或与其他多糖交联。如果Ca2+-AGP相互作用有助于质膜和/或CW的机械稳定性,pH值的变化可能会影响这一性质。质膜是细胞重要的机械传感部分,含有触觉敏感通道,因此pH诱导的钙离子释放可以通过这些通道的打开而被放大。有趣的是,经典AGPs在各种病理系统中趋于上调,包括细菌和真菌半生物营养型维管病原体(如Fusarium spp.和Ralstonia spp.)以及真菌生物营养型Erisyphe necator,但在芸苔属植物的细菌生物营养病原体(Plasmodiophora brassicae)中却没有上调。尚不清楚内流的Ca2+中有多少是可溶的或与CW结合的,以及仅释放与CW结合的Ca2+是否足以触发Ca2+峰值和下游信号转导。
微生物试图减少植物Ca2+的内流,以建立它们与宿主所需的相互作用(图2E)。细菌CW成分黄原胶是一种带负电荷的聚合物,是一种有效的Ca2+螯合剂,可以抑制拟南芥的免疫反应。Ca2+和其他二价阳离子对豌豆根瘤菌(Rhizobium leguminosarum)附着在根毛上起着重要作用。这些细菌的酸性胞外聚合物(EPSs)螯合质外体Ca2+,使EPSs凝胶化,充当胶水将微生物附着在植物表面。虽然尚未完全了解,但Ca2+在根癌农杆菌(Agrobacterium tumefaciens)的根部附着和感染中发挥作用。除了通过微生物多糖与Ca2+结合外,Ca2+结合蛋白也参与了细菌与根的非特异性附着。综上所述,Ca2+信号的抑制似乎在抑制植物PTI的致病性和共生相互作用中起着重要作用。
与Ca2+一样,硼在植物CW中也具有重要的结构功能。硼以硼酸酯的形式与RG-II相互连接,并可能参与将AGPs和伸展蛋白的聚糖相互连接。在体外,AGPs/伸展蛋白之间的硼酸酯的稳定性也受到pH的调节。缺硼会导致植物结构受损并通过导致CW“膨胀”来限制植物生长。近年来,土壤中硼的积累对微生物多样性产生了负面影响,对细菌的影响大于对真菌的影响。目前还没有研究表明植物CW硼是否在植物-微生物相互作用中起直接作用,但硼的缺乏和过量积累对植物和土壤微生物的影响表明该分子可能影响植物-微生物相互作用。
4 植物CW强化防御
4.1 CW多糖
某些多糖的修饰和从头合成是植物对微生物定殖反应的一部分。胼胝质合成在响应生物营养型病原体的乳突形成中尤为重要(图2F),而在某些宿主中,一些被认为是半生物营养型的真菌并不会诱导这种植物防御。乳突含有额外的成分,如纤维素、木聚糖、抗菌肽和代谢分子。目前还不清楚为什么胼胝质可能为CW提供物理加固,因为体外混合物表明胼胝质降低了纤维素的刚度并增加了延展性。这种胼胝质诱导的材料行为改变可能有助于防止由于附着胞高压而引起的细胞壁脆性断裂。由于胼胝质β-1,3骨架的形状,它不太可能与其他CW组分(如纤维素)发生强烈的相互作用。也有人认为胼胝质填充了CW中的孔隙,这可能会限制CWDEs或效应物进入CW。
此外,胼胝质可能具有非结构性作用,它可能对植物CW有掩蔽作用,特别是对真菌病原体。真菌CWs含有β-1,3-葡聚糖,因此,来自菌丝附近胼胝质中的高浓度β-1,3-葡聚糖可使真菌将植物感知为自身,从而下调毒力因子的表达和/或分泌。据报道,在真菌细胞表面受体中发现了与多糖(包括木聚糖和β-1,3-葡聚糖)结合的CW完整性和应激反应组分结构域,这些受体似乎对真菌细胞的发育很重要。此外,真菌CW完整性传感途径调节真菌疾病所需的基因表达,包括次级代谢物合成。因此,从胼胝质中直接感知β-1,3-葡聚糖可能会影响真菌行为,尽管这一推测还有待验证。
随着胼胝质沉积机制的激活,其他几个植物多糖合成基因家族在响应感染时被转录上调。值得注意的是,在某些情况下,受影响的CW组分尚未得到确认。例如,地钱增加了两种酶的表达以响应卵菌,这两种酶可能参与木葡聚糖和木聚糖的合成。在一些受感染的植物中,没有预测功能的酶也会被上调,特别是纤维素合酶样家族(CSLs)。拟南芥根感染F. oxysporum后增加了CSLE基因家族成员的表达。在根瘤病和白粉病感染的葡萄中,相关的CSLEs也上调;而甜橙(Citrus sinensis)则上调CSLB和CSLEs以响应细菌-病毒共感染。另一个CSL基因AtCSLG2的表达在感染R. solanacearum的拟南芥中增加。这些CSLE、CSLB和CSLG家族成员的产物尚不清楚,但其他相关CSL家族成员能够合成具有β-1,3-和β-1,4-糖苷键和甘露聚糖的混合连接葡聚糖。混合连接葡聚糖尚未被报道存在于真双子叶植物中,但这些CSL亚家族可以合成特殊的纤维素、甘露聚糖、胼胝质或一种迄今尚未发现的多糖以响应病原菌感染。这些酶的过表达、再加上NMR、连接和单糖组成分析将有助于我们发现它们的产物及其在植物防御中的作用。
植物CW修饰蛋白在响应病原体感染时也会转录上调,尤其是CWDEs。例如,在尖孢镰刀菌与拟南芥的相互作用中,植物上调了一些果胶酸裂解酶、果胶酶、甲基和乙酰酯酶以及XTH/XETs。棉花在V. dahliae感染期间上调果胶酶;地钱在被卵菌感染时上调XTH/XET和扩张蛋白,而植物XTH/XET在R. solanacearum侵染拟南芥时上调。原则上,这些内源性酶与病原菌CWDEs具有相似的活性,因此可以作为植物易感因子,如番茄(Solanum lycopersicum)多聚半乳糖醛酸酶、扩张蛋白和葡聚糖酶;拟南芥扩张蛋白和橙子XTH。
植物CWDEs还可以强化宿主的CW或提高DAMPs的有效性,增加植物的抗性。例如,三室黄麻(Corchorus trilocularis)在感染菜豆壳球孢(Macrophomina phaseolina)期间XTH上调,可能通过交联加强CW。由于果胶的降解依赖于其甲基化程度,因此PME和PMEIs会影响OGs的生成。此外,据报道,PME可使OGs去甲基化,增强其激活防御反应的能力。同时,植物还可以合成蛋白质抑制剂,降低自身和微生物CWDEs的活性。其中,PMEIs降低了PMEs对果胶的去甲基化作用,增强了抗病性。植物CWDEs及其抑制剂对植物对微生物反应的贡献需要进一步的研究,并将其与特定的生化活性联系起来,这些生化活性本身可能是动态的,受pH值和其他质外体条件的调节。
4.2 ROS和木质素
植物质外体防御微生物的另一个必要途径是通过质膜定位的NADPH氧化酶(称为呼吸爆发氧化酶(RBOHs))和CW过氧化物酶的作用产生活性氧(ROS)。ROS包括超氧化物(O2.-)、过氧化氢(H2O2)、羟基自由基(OH.)和单线态氧(1O2)等高活性分子。ROS作为有毒分子对抗入侵微生物,并作为信号分子激活植物防御。此外,ROS通过诱导胼胝质合成基因和空间限制的木质素沉积,通过CW强化参与物理阻断入侵途径。
木质素是三种主要木质素单体氧化聚合的产物,通过一般的苯丙烷类生物合成途径在细胞质中合成并分泌到质外体。一旦进入CW,这些木质素单体被过氧化酶/H2O2和/或漆酶/O2氧化系统激活,组装成最终的木质素聚合物。木质化是植物对微生物感染的一种常见反应(图2G),从触发苯丙烷合成途径开始。在拟南芥-丁香假单胞菌(Pseudomonas syringae)相互作用中,木质素单体聚合可以发生在病原体细胞周围的高度受限区域,其中细菌周围的局部木质化减少了它们的移动。同样,毒性更强的细菌菌株具有抑制强烈ROS爆发和木质化的效应物。
木质素的高含量形成似乎是特定蛋白质精确定位和作用的结果。这一事件在凯氏带的形成过程中得到了很好的研究,其中CASP蛋白在质膜的小区域与过氧化物酶和RBOHs形成复合物。过氧化物酶和产生过氧化物燃料的RBOHs的共定位使得木质素的薄带得以形成。病原体诱导的木质化可能类似于凯氏带的形成。事实上,木质素在拟南芥病原菌周围的沉积依赖于两个CASP样(CASPL)蛋白,其定位于新形成的木质素周围的植物质膜上。结合CASPLs并不是过氧化物酶和漆酶在CW内特异性定位的唯一机制。一些过氧化物酶已被证明能与去甲基化的HG结合,这可以将它们限制在CW的特定区域(图2G)。在微生物诱导的HG去甲基化过程中可以设想类似的机制,导致木质素形成所需的某些过氧化物酶的定位,以隔离微生物和/或保护更容易被入侵者降解的果胶区域。这一假设和其他假设仍有待检验,例如过氧化物酶与其他多糖表位结合的能力,或漆酶具有相似的多糖结合能力的可能性。
过氧化物酶还通过交联CW中的结构蛋白(如伸展蛋白和AGPs)来促进植物防御,最近对它们在植物-微生物相互作用中的作用进行了综述。此外,其他过氧化物酶从RBOH衍生的H2O2中合成ROS。因此,调节过氧化物酶活性可能是病原体减少CW强化和其他植物防御的机制。这可以通过控制质外体pH来实现,因为pH会影响过氧化物酶和漆酶的活性。此外,pH对RBOHs的影响已被预测,但尚未完全了解,RBOHs为过氧化物酶和漆酶提供所需的ROS。此外,高质子浓度对ROS分子活性的影响仍有待研究。
钙离子可进一步控制过氧化物酶的活性;因为有人提出质外体Ca2+的下降可以作为过氧化物酶活性的关闭开关。因此,当Ca2+在微生物攻击时被植物细胞迅速内化,过氧化物酶活性可能受到限制。一些漆酶包括预测的钙调蛋白结构域,这表明它们也可能受Ca2+的调控,尽管这些结构域的确切作用尚不可知。微生物也可以通过分泌干扰宿主ROS生成系统的蛋白质(如玉米黑粉病的效应蛋白PEP1)来最小化木质素沉积和其他ROS依赖性植物免疫反应。其他微生物已经进化出隔离ROS的机制,例如细菌Azorhizobium caulinodans的EPS,它可以隔离H2O2,从而在Sesbiana rostrata中形成根瘤(图2G)。条件性病原真菌Alternaria tenuissima在体外产生的EPS具有清除羟基自由基和超氧阴离子的能力,但其在植物体内的功能还有待进一步研究。近年来,内生真菌和病原菌利用植物生长激素从其EPS中释放一种保守的寡糖,作为ROS清除剂破坏植物的免疫反应。此外,微生物对质外体或根际的酸化降低了植物产生ROS的潜力。
4.3 软木脂
与木质素一起,软木脂形成另一层非多糖保护层,防止病原体进入单个植物细胞。它构成一种疏水屏障,天然存在于种皮、叶表皮细胞和周皮等特殊组织中,或在创伤和微生物攻击后特异性形成。软木脂单体似乎是通过与质膜融合并释放其货物的囊泡管状膜结构分泌的。一旦离开细胞,软木脂就会聚合并在质膜和CW之间形成一种片层状结构。
栓化作用似乎主要由维管病原体诱导,以有效限制它们在维管束之间的扩散并将它们包含在已感染的组织中。在Vitis vinifera和维管病原菌Phaeomoniella chlamydospora的相互作用中,木质素沉积被证明是病原菌在木质部导管间传播的限制性因素。类似地,最近有报道称,番茄对R. solanacearum的抗性需要木质素-软木脂涂层的沉积和酪胺衍生的羟基肉桂酸酰胺。维管病原体感染后的软木脂沉积受转录因子MYB41的正向调节,MYB41的启动子在胁迫条件下被特异性诱导,其过表达导致各种植物物种和组织类型的异位木栓化。
在植物-微生物相互作用的背景下调节软木脂沉积可能需要额外的转录调节因子。最近描述的与MYB41一起足以促进内胚层软木脂沉积的MYB是在生物胁迫下诱导相同过程的候选者,但这一作用必须得到证实。此外,了解细胞壁中的软木脂组装也很重要,这很可能通过类似于角质合酶的酯交换作用发生。此外,在植物定殖过程中微生物对软木脂的降解尚不清楚,尽管已经鉴定出多种软木脂酶,但仍需要进一步研究。
5 总结与展望
植物CW是植物细胞中动态的、相互作用的部分,其性质随着CW修饰酶的作用、离子组成的改变和新物质的合成而发生变化。这些变化在植物-微生物相互作用的环境中特别活跃,其中生物都会改变植物CW及其环境,并且在不同的时间点,同一生物可能会逆转早期的变化。
目前为止,植物CW在宿主-微生物相互作用中的作用的研究主要集中在单个CWDEs在致病中的功能重要性,CWDEs产物作为DAMPs的作用以及合成新的CW材料作为防御反应。这些仍然是主要的研究领域;例如,已经发现了新的CW衍生的DAMPs,其受体未知,据报道许多质膜受体会影响抗病性,但它们的配体和/或在植物防御中的确切作用尚未确定。蛋白质组学技术在这一领域可能有用,如空间蛋白质组学和磷酸化蛋白质组学,以确定对疾病或特定信号作出反应的受体和信号元件。此外,植物对其自身CW衍生的DAMPs和微生物产生的DAMPs反应的协调是一个有待进一步探索的重要课题。植物CW相关变化(多糖和离子)的动态和亚细胞特性意味着有必要以更高的时间和空间分辨率监测相互作用,例如在不同的细胞层和细胞区域。这应该可以通过适应各种病理系统、高分辨率显微镜和植物生物学领域目前可用或开发中的新探针来实现。我们还需要使用低温电子显微镜、固态核磁共振和原子力显微镜等技术研究植物生长过程中植物CW结构和机械变化以及对微生物定殖的响应。将这些知识与计算模拟相结合,将使我们能够分析植物CW结构和组分与机械性能之间的关系。与此同时,重要的是对大基因家族(如扩张蛋白、XTHs和CSLs)的个体成员进行生物化学表征,以了解它们在特定植物-微生物相互作用中的功能。CW作为植物细胞的重要组成部分,在植物与微生物的相互作用中起着至关重要的作用,因此继续研究CW结构和组成与其性质的关系,以及这些性质如何被修饰以响应环境胁迫并与植物生长发育相协调具有十分重要的意义。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
综述丨中国农大: 植物
植物蛋白有哪些? About plant proteins
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
蛋白质基于调节肠道微生物群的健康作用研究进展
Cell揭秘:药物与饮食交织下,肠道微生物的健康影响力
【Nature综述】朱健康院士等综述植物非生物胁迫信号转导,为培育抗逆作物提供思路(全文翻译,值得收...
植物油中生物活性物质及其营养特性概述
有益菌群内的微生物相互作用促进土壤健康,Science of the Total Environment
药物相互作用
顶刊综述丨NAT MED(IF:82): 心脏代谢健康、饮食和肠道微生物组: 宏组学视角
网址: 综述丨PLANT CELL: 植物与微生物在质外体中的相互作用 https://www.trfsz.com/newsview193768.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






