Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用
编者按:
国内著名英文学术期刊 Protein & Cell 与热心肠研究院于去年再次合作,推出以“微生物组:迈向转化”为主题的人类微生物组专刊,邀请国内外有突出学术贡献的微生物组研究者和团队撰写综述文章,围绕微生物组分析方法、心血管疾病、代谢疾病、炎症性肠病、癌症和中医药等微生物组研究的热点领域展开探讨,共话人类微生物组研究的前沿进展。
今天我们发出来自北京大学姜长涛与团队的综述的翻译稿,以飨读者。
翻译:吴佳玉,姜长涛
校对:白璐
肠道菌群及其代谢物在代谢性疾病中的作用
The role of the gut microbiome and its metabolites in metabolic diseases
第一作者:吴佳玉1,2,3
通讯作者:姜长涛1,2,3
其他作者:汪锴1,2,3,王雪梅1,2,3,庞艳莉1
1 北京大学,基础医学院肥胖与代谢疾病研究中心,第三医院妇产科
2 北京大学第三医院医学创新研究院基础医学研究中心
3 北京大学基础医学院生理学与病理生理学系,分子心血管分子教育部重点实验室
摘要
众所周知,不健康的生活方式是代谢性疾病的主要危险因素,近年来,越来越多的证据表明肠道菌群及其代谢物也在许多代谢性疾病,包括肥胖、二型糖尿病、非酒精性脂肪性肝病和心血管疾病的发生发展中起到至关重要的作用。肠道中存在许多的微生物,它们是宿主能量获取的关键中介,并且能将膳食营养素代谢为许多的生物活性物质,从而作为沟通肠道菌群与宿主相互作用的桥梁。肠道菌群由宿主基因、免疫应答及饮食因素调控,而肠道菌群的代谢和免疫潜能决定了其在宿主健康和疾病中的重要意义。因此,靶向肠道菌群及其相关代谢通路有望成为治疗许多代谢性疾病的有效策略。本综述将总结肠道菌群在机体代谢中的重要作用,以及肠道菌群产生的代谢物与许多代谢性疾病发病的关系。本文也会讨论通过调控肠道菌群来改善代谢性疾病的最新进展。
关键词
肠道菌群,代谢,代谢物,免疫调控,代谢性疾病
介绍
全球代谢性疾病,包括肥胖、非酒精性脂肪肝(NAFLD)、胰岛素抵抗、2 型糖尿病(T2DM)、动脉粥样硬化(AS)和多囊卵巢综合征(PCOS)的发病率急剧上升(Norman et al., 2007; Popkin et al., 2012; Virani et al., 2020; Younossi et al., 2016; Zheng et al., 2018)。在过去的几十年里,人们对高热量食物的消耗越来越多,业余时间的体育活动被久坐不动的生活方式所取代,最终导致了正能量平衡(能量摄入超过能量消耗),而这些已经成为肥胖和肥胖相关疾病的主要危险因素(Heymsfield and Wadden, 2017)。在这种情况下,脂肪组织无法将所有多余的能量储存为甘油三酯,导致脂质溢出到循环系统中。这种非脂肪组织的多余的脂质补充会导致脂肪氧化能力受损,以及非脂肪组织的脂肪酸可用性增加,从而导致脂肪异位储存(Corpeleijn et al., 2009)。脂肪细胞中脂肪的过度积累导致促炎脂肪因子的产生和分泌增多,导致胰岛素抵抗的发生,而胰岛素抵抗与 T2DM 和 NAFLD 的发生有关(Reilly and Saltiel, 2017)。从遗传学角度来说,超过 99%的人类器官所检测到的基因是微生物的基因(Gilbert et al., 2018),微生物细胞数目至少和人体体细胞一样多(Sender et al., 2016)。肠道微生物群是指生活在肠道内的数万亿微生物,包括细菌、病毒、真菌、古菌、噬菌体和原生动物(Whitman et al., 1998),它们能够以多种方式与宿主相互作用。一方面,一些肠道菌群被宿主免疫系统视为病原体,并被识别和清除。然而,大多数肠道菌群是非致病性的,并与肠上皮细胞共生。肠道微生物在饮食摄取的营养代谢、外源毒性物质和药物代谢、维持肠道屏障和胃肠道的结构和功能、预防肠道病原体易位等方面发挥着重要作用(Jandhyala et al., 2015)。对肠道微生物在调节代谢紊乱中的作用的研究在过去几十年里迅速增加。本文将重点介绍肠道微生物及其代谢物在许多代谢性疾病的发生和发展过程中的作用,以及生产一系列靶向治疗药物的潜在机制和新技术。我们的目的是为今后与人类代谢性疾病发展相关的肠道微生物这一新兴领域的研究提供指导。
肠道微生物群与代谢性疾病的相关性
在过去的十年中,肠道微生物在各种人类疾病发展中的潜在作用受到了相当多的关注。特别是,肠道微生物组已经被认为是许多代谢紊乱,如肥胖、2 型糖尿病和非酒精性脂肪肝发展的主要危险因素。本文综述了代谢性疾病中肠道微生物组组成的变化(表 1)。当前全球肥胖流行与以能量摄入过多和体力活动减少为特征的生活方式改变有关。西方饮食引起的肥胖导致肠道微生物组的组成发生变化,如厚壁菌门的柔膜菌纲显著增加(Turnbaugh et al., 2008)。近年来,肠道微生物作为肥胖及其伴发疾病的潜在驱动机制已成为人们关注的焦点。肠道微生物群是能量获取的关键中介,因为它可以将食物转化为宿主的营养,而与肥胖相关的肠道微生物群从饮食中获取能量的能力更强(Turnbaugh et al., 2006)。在肥胖个体中,微生物组组成有明显变化,如 Akkermansia、Faecalibacterium、Oscillibacter、Alistipes 的含量明显下降。肥胖与肠道微生物组成相关的血清代谢产物的改变有关(Thingholm et al., 2019)。此外,肥胖个体中谷氨酸发酵共生体 Bacteroides thetaiotaomicron 的丰度显著降低,且与血清谷氨酸浓度呈负相关。口服 B. taiotaomicron 可以降低小鼠血浆谷氨酸浓度,减少饮食引起的体重增加和肥胖(Liu et al., 2017a)。
表 1,代谢性疾病中肠道微生物群的变化
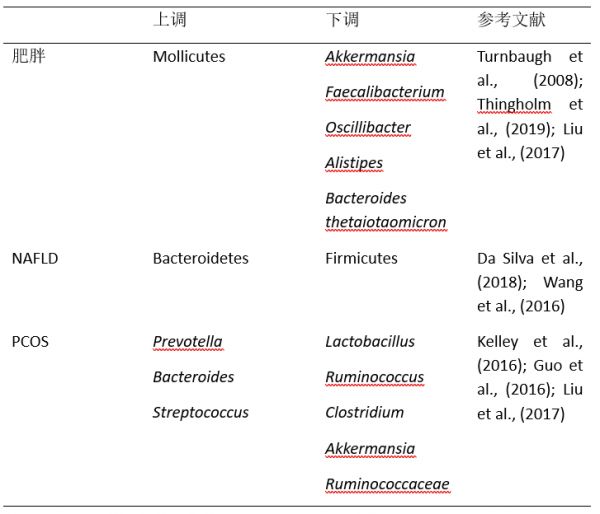
既往研究表明,肠道微生物组对人 NAFLD 的发生有重要影响。NAFLD 患者拟杆菌门(Bacteroidetes)丰度增加,而短链脂肪酸生成和 7 -丙烯酸去羟化厚壁菌门(Firmicutes)丰度显著降低(Da Silva et al., 2018; Wang et al., 2016)。一项使用菌群移植的小鼠模型的研究证实了肠道微生物群在 NAFLD 发展中的作用。高脂饮食(HFD)喂养的小鼠在定植了高血糖小鼠的肠道菌群后出现肝大泡性脂肪变性,而对照组小鼠在定植正常血糖小鼠的肠道菌群后只出现低水平脂肪变性。不同的微生物群组成可以决定小鼠对 HFD 的反应(Le Roy et al., 2013)。一项前瞻性研究表明,NAFLD 和非酒精性脂肪性肝炎(NASH)与肠道生态失调有关,NAFLD 患儿的粪便微生物组的 α 多样性比对照组的更低,其中 NASH 的粪便微生物组的α多样性是最低的。此外,编码炎性细菌产物的基因丰度与 NAFLD 及其严重程度有关。肠道微生物群的改变可能导致 NAFLD 的发病,并作为疾病或严重程度的标志(Schwimmer et al., 2019)。
多囊卵巢综合征是一种异质性内分泌疾病,是育龄妇女最常见的内分泌疾病(Norman et al., 2007)。同样,也有人提出代谢紊乱可以解释 PCOS 的发病机制。Kelley 等人的一项研究发现,肠道菌群失调与多囊卵巢综合征之间可能存在联系(Kelley et al., 2016),在来曲唑诱导的多囊卵巢综合征小鼠模型中,肠道微生物的组成发生了显著变化。来曲唑对青春期雌性小鼠的治疗降低了小鼠肠道细菌多样性,并导致特定拟杆菌门和厚壁菌门相对丰度的物种特异性和时间依赖性转变(Kelley et al., 2016)。其中,来曲唑处理 PCOS 大鼠的乳酸菌、瘤胃球菌和梭状芽胞杆菌含量较低,普氏菌含量较高(Guo et al., 2016)。2017 年,一项研究表明,多囊卵巢综合征患者的粪便微生物组多样性降低且系统发育谱改变,这与临床参数相关(Lindheim et al., 2017)。此外,PCOS 患者中拟杆菌、埃希氏杆菌、志贺氏菌和链球菌的细菌数量增加,Akkermansia 和瘤胃球菌的细菌数量减少(Liu et al., 2017b)。根据上述研究,肠道微生物组对机体系统代谢稳态具有重要影响,健康的肠道微生物组对宿主的整体健康起着重要作用。
肠道微生物组产生的主要代谢产物
人体肠道菌群在大量膳食营养素的刺激下,产生胆汁酸、短链脂肪酸、氨、酚类、内毒素等生物活性化合物。这些微生物衍生的代谢物是微生物与宿主沟通的媒介,这是维持宿主正常生理状态必不可少的(Schroeder and Backhed, 2016)。事实上,与肠道微生物组相关的代谢产物图谱为生活方式和饮食因素对疾病的影响提供了进一步的认知。许多元组学方法被开发来研究微生物衍生代谢物的功能,包括宏基因组学、宏蛋白质组学和代谢组学。这些技术使我们能够定义代谢概况,识别和量化感兴趣的类别和化合物,表征肠道微生物产生的小分子,并定义代谢产物的生化通路(Vernocchi et al., 2016)。在此,我们总结了有关微生物衍生代谢物在代谢性疾病中的重要意义的研究结果(表 2).
表 2. 微生物衍生代谢物在代谢性疾病中的作用。
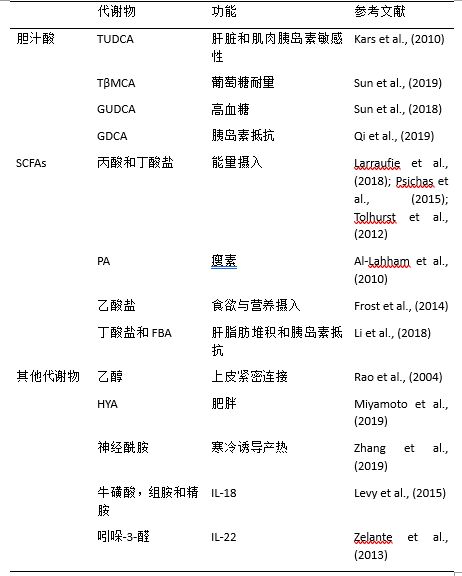
图片TUDCA, tauroursodeoxycholic acid 牛磺熊去氧胆酸; TβMCA, tauro-β-muricholic acid 牛黄-β-鼠胆酸; GUDCA, glycoursodeoxycholic acid 甘氨熊脱氧胆; GDCA, glycodeoxycholic acid甘氨脱氧胆酸; SCFAs, short-chain fatty acids短链脂肪酸; PA, propionic acid丙酸; FBA, N-(1-carbamoyl-2-phenyl-ethyl) butyramide N-(1-氨基甲酰-2笨基-乙烷基)丁酰胺; HYA, 10-hydroxy-cis-12-octadecenoic acid 10-氢氧根-顺式-12-十八碳烯酸。
胆汁酸
初级胆汁酸由肝脏中的胆固醇转化而来,与牛磺酸和甘氨酸结合后分泌到肠道,在肠道由肠道微生物通过胆汁酸盐水解酶(BSH)转化为次级胆汁酸(Matsubara et al., 2013)。胆汁酸通过激活特定的受体改变代谢,包括法尼酯X受体(FXR)、孕烷X受体和G蛋白偶联受体(GPCRs),如 TGR5(Matsubara et al., 2013)。次级胆汁酸脱氧胆酸(DCA)和石胆酸(LCA)是肠道微生物组最丰富的代谢物,其浓度约为 500μM,通过 G 蛋白偶联受体 TGR5 调节宿主能量稳态和代谢(Duboc et al., 2014)。肠道 FXR 的激活可诱导成纤维细胞生长因子 15 (FGF15)的表达,抑制肝脏中胆固醇 7 -羟化酶(CYP7A1)的表达。CYP7A1 是胆汁酸合成的限速步骤,通过肠道-微生物-肝脏反馈回路导致胆汁酸水平下降。
肠道菌群是胆汁酸代谢的重要调节因子,无菌及抗生素处理的大鼠中胆汁酸多样性降低,而牛磺酸结合胆汁酸的丰度显著增加(Swann et al., 2011)。抗糖尿病药物阿卡波糖的治疗改变了参与胆汁酸代谢的肠道微生物群,从而改变胆汁酸组成,影响 2 型糖尿病患者的预后(Gu et al., 2017)。一项队列研究表明,使用一种胆汁酸衍生物——牛磺熊去氧胆酸(TUDCA)治疗可以改善肝脏和肌肉的胰岛素敏感性(Kars et al., 2010)。据报道,在胆汁酸合成途径中重要的酶 CYP7B1 介导的替代通路的激活,通过改变肠道菌群、上调寒冷诱导的产热和能量消耗,从而改善代谢(Worthmann et al., 2017)。抗生素治疗上调了仓鼠体内的CYP7B1,增加了 TβMCA 的含量,抑制了肠道FXR信号传导,从而减轻了高脂饮食引起的葡萄糖耐受不良和肝脂肪变性(Sun et al., 2019)。胆汁酸也被证明会进一步影响肠道菌群的组成(Islam et al., 2011)。宿主-微生物胆道网络在形成宿主免疫反应中也起着关键作用。根据哈佛大学最近的一项研究,肠道胆汁酸池调节结肠 RORγ+T 细胞的一个重要群体,并通过胆汁酸核受体影响宿主对炎症性结肠炎的易感性(Song et al., 2020)。LCA 的两种不同衍生物,3-oxoLCA 和 isoalloLCA,最近在小鼠中被鉴定为 T 细胞调节剂。给予小鼠 3-oxoLCA 和 isoalloLCA 分别能降低肠固有层 TH17 细胞分化和增加 Treg 细胞分化(Hang et al., 2019)。利用质谱信息学和数据可视化方法,加州大学圣地亚哥分校的一个研究小组首次发现了宿主氨基酸结合的胆汁酸,这些胆汁酸用于生成苯酰胆酸、酪氨酸胆酸和亮氨酸。这些胆汁酸偶联物在炎症性肠病或囊性纤维化患者体内富集,是 FXR 在体外的激动剂。这些化合物是否在宿主体内具有生理作用,以及它们是否在与微生物群失调相关的疾病中发挥作用,还需要进一步的研究来证实(Quinn et al., 2020)。
肠道微生物-胆酸- FXR 轴的调节与肥胖诱导的小鼠胰岛素抵抗和肝脂肪变性有关。图 1 总结了我们实验室之前的相关工作。我们发现,通过调节仓鼠体内的替代胆汁酸合成通路的关键酶 CYP7A1,肠道微生物的清除减轻了高脂饮食诱导的葡萄糖耐受不良、肝脂肪变性和炎症,从而为调节饮食诱导的肥胖提供了一个潜在的靶点(Sun et al., 2019)。我们发现 Gly-MCA 是一种选择性的高亲和力肠道 FXR 信号抑制剂,通过减少肠道衍生的神经酰胺的生物合成来逆转高脂饮食诱导的肥胖,它能直接破坏米色脂肪的产热功能(Jiang et al., 2015)。我们进一步发现,Gly-MCA 作为拮抗剂抑制肠道 FXR 信号通路,从而改变宿主肝脏脂质代谢,改善肥胖相关代谢功能障碍(Zhang et al., 2016)。这些数据提示 Gly-MCA 可能是治疗代谢紊乱的候选药物。此外,我们发现,补充细菌 BSH 的抑制剂咖啡因酸苯乙酯(CAPE),可以增加小鼠肠道 TβMCA 的水平,从而选择性地抑制肠道 FXR 信号,降低神经酰胺水平,从而减轻小鼠肝脏糖异生。提示抑制肠道 FXR 信号通路是治疗高血糖的一种策略(Xie et al., 2017)。普洱茶的关键成分茶褐素对肠道 FXR 信号的抑制进一步证实了我们的研究。口服茶褐素可抑制肠道细菌 BSH 活性,导致结合胆汁酸的积累,抑制肠道 FXR-FGF15 信号通路,最终降低胆固醇水平(Huang et al., 2019)。我们课题组报道了二甲双胍治疗降低了脆弱拟杆菌的丰度,增加了肠道内 GUDCA 水平,从而抑制了肠道 FXR 信号。二甲双胍的抗高血糖作用主要通过脆弱拟杆菌-GUDCA-肠 FXR 轴实现(Sun et al., 2018)。
除了干扰神经酰胺的产生,胆汁酸还可以特别作用于 L-细胞的 FXR,并控制胰高血糖素样肽-1 (GLP-1)的产生。胆汁酸鳌合剂考来维仑在 ob/ob 小鼠体内依赖 FXR 信号通路刺激 GLP-1 的分泌,改善血糖,证实 FXR/GLP-1 通路是胆汁酸控制糖代谢的新机制,也是 2 型糖尿病的药理靶点(Trabelsi et al., 2015)。也有研究表明,将胆汁转移至回肠(GB-IL)与通过胆汁酸-肠 FXR-GLP-1 轴的 Roux-en-Y 胃旁路(RYGB)具有相似的代谢益处(Albaugh et al., 2019)。此外,本实验室前期研究发现,多囊卵巢综合征患者肠道菌群中,普通拟杆菌含量明显升高,使 GDCA、TUDCA 等结合胆汁酸解离失去活性。GDCA 通过 TGR5、GATA 结合蛋白 3 和 IL-22 诱导肠内3型先天淋巴细胞(ILC3)分泌 IL-22,进而改善 PCOS 表型。移植女性多囊卵巢综合征患者的肠道菌群或直接定植普通拟杆菌的受体小鼠,出现卵巢功能紊乱、胰岛素抵抗、胆汁酸代谢改变、白细胞介素-22 分泌减少和不育(Qi et al., 2019)。因此,靶向肠道菌群改变肠道胆汁酸组成或直接靶向胆汁酸受体 FXR 和 TGR5 可能是潜在的有前景的代谢性疾病的治疗干预手段。
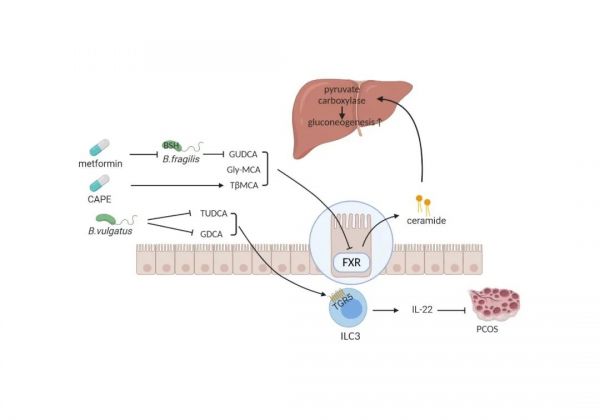
图 1. 肠道微生物-胆汁酸- FXR 轴的调节。
二甲双胍处理降低了脆弱拟杆菌的丰度,增加了 GUDCA 水平,从而抑制了肠道 FXR 信号转导。Gly-MCA 抑制肠道 FXR 信号,改变宿主肝脏脂质代谢。CAPE 的补充可以抑制细菌 BSH,从而增加肠道 TβMCA 的水平,从而选择性地抑制肠道 FXR 信号,降低神经酰胺水平,从而减少小鼠肝糖异生。普通拟杆菌可清除 PCOS 个体合成的 GDCA 和 TUDCA。GDCA 通过 TGR5、GATA 结合蛋白 3 和 IL-22 诱导 ILC3 分泌 IL-22,进而改善 PCOS 表型。CAPE, caffeic acid phenethyl ester 咖啡酸苯乙酯; GUDCA, glycoursodeoxycholic acid甘氨熊脱氧胆酸; Gly-MCA, glycine-β-muricholic acid甘氨酸-β-鼠胆酸; TβMCA, tauro-β-muricholic acid 牛黄-β-鼠胆酸; TUDCA, tauroursodeoxycholic acid牛磺熊去氧胆酸; GDCA, glycodeoxycholic acid甘氨脱氧胆酸; ILC3, intestinal group 3 innate lymphoid cell肠道3型先天淋巴样细胞; PCOS, polycystic ovary syndrome多囊卵巢综合症。
调节胆汁酸
肠道微生物在维持宿主的生理状态和代谢稳态方面起着至关重要的作用。代谢性疾病患者肠道菌群失调,肠道菌群与宿主的相互作用紊乱。因此,调节宿主肠道菌群可能是治疗代谢性疾病的一种有前景的方法。肠道菌群定植被认为主要从出生开始,当婴儿在分娩期间就暴露于母体菌群中(Perez-Munoz et al., 2017)。生命早期的各种因素可以影响肠道微生物组的组成,包括生产方式、宿主基因、免疫反应、抗生素的使用、生活方式、昼夜节律、宿主疾病状态和环境因素(Gilbert et al., 2018)。一项队列研究表明,肠道菌群主要是由环境因素所塑造的,宿主遗传在决定菌群组成方面起次要作用。此外,其他的生活方式特征已经被证明与微生物群的组成有关,包括睡眠不足、压力、职业和异性夫妇的性交(Gilbert et al., 2018)。了解了影响肠道菌群的因素后,我们可以通过相应的方法调控肠道菌群,操纵机体的胆汁酸池,从而改善代谢性疾病。
膳食干预对肠道微生物组和胆汁酸组成的影响
在人的一生中,饮食可能对肠道微生物群及其哺乳动物宿主之间的关系产生最大的影响。各种营养物质的消耗影响着微生物群落的结构,并为微生物的代谢提供了基质(Albenberg and Wu, 2014)。肠道微生物群与饮食中的营养物质相互作用,影响宿主的健康。此外,肠道微生物的结构和活性在很大程度上是由人类的饮食摄入量调节的,而且这个过程是快速且可重复的。因此,饮食干预是改变肠道微生物组组成的有力工具。草食性和肉食性个体的肠道微生物组组成存在显著差异,肉食性饮食增加了胆汁耐受的微生物丰度,降低了代谢植物多糖的厚壁菌门(如氏菌属、直肠真杆菌和bromii瘤胃球菌)的水平(David et al., 2014)。摄取大量脂肪和蛋白质的杂食者体内拟杆菌的水平增加,而摄取大量纤维的素食者体内普氏菌的水平增加。富含非淀粉多糖和抗性淀粉的大麦饮食,改善了普氏菌/拟杆菌比值较高的健康人群的葡萄糖代谢,使 Prevotella copri 发酵复合多糖的潜力增大(Kovatcheva-Datchary et al., 2015)。粪便群落聚集成肠型,主要以拟杆菌和普氏菌的水平来区分。肠型与长期饮食密切相关,蛋白质和动物脂肪的饮食会形成拟杆菌门肠型,而碳水化合物饮食会形成普氏菌肠型。在开始高脂/低纤维或低脂/高纤维饮食后 24 小时内就能检测到微生物组组成的变化,但肠型特征在 10 天的研究期间保持稳定(Wu et al., 2011)。因此,相应的饮食干预不仅要控制饮食中的营养成分,还要注意饮食干预的时间,以保证有足够的时间改变靶向的肠道微生物群。一项平行进行的8周随机对照试验表明,地中海饮食干预可降低超重和肥胖受试者的血浆胆固醇,引起肠道微生物群和粪便胆汁酸的改变,显著降低粪便中总胆汁酸(包括初级和次级胆汁酸)的浓度。特别的是,粪便 DCA 和 LCA 在干预 4 周和 8 周后显著降低(Meslier et al., 2020)。相比之下,高脂饮食显著增加肠腔和血清中的胆汁酸水平,并改变胆汁酸的分布,包括不均衡地增加初级胆汁酸和次级胆汁酸的水平,其中 TβMCA、βMCA、DCA 和 ωMCA 的水平在高脂饮食后显著增加(Fu et al., 2019)。高蛋白饮食可导致真杆菌富集,它能使胆汁酸 7α -去羟基化,同时也导致次级胆汁酸 DCA 和 LCA 水平升高(Pi et al., 2020)。蛋氨酸限制可减轻高脂饮食引发的胰岛素抵抗,恢复高脂饮食中断的脂质分解基因和胆红酸合成基因的周期性波动,从而改善循环脂质谱(Wang et al., 2020)。最近的一项研究表明,新的食品成分-膨化的豆科植物和谷物混合物可以调节脂质谱,增加胆汁酸的粪便排泄(Rubio et al., 2020)。这项研究促使我们关注膨化的豆科植物和谷物混合物的营养和生理效应。此外,普通荞麦对高脂饮食诱发的 NAFLD 及相关的血脂异常有保护作用。添加荞麦对初级胆汁酸的生物合成具有显著的调节作用,改变肠道微生物组的结构,从而改善脂质代谢。本研究表明,普通荞麦可作为一种潜在的预防 NAFLD 和高脂血症的功能性食品(Huang et al., 2020)。最近,间歇性禁食,包括时间限制性饮食(TRF:在 4~12 小时的时间窗内饮食,但没有限制热量摄入)和隔天禁食(EODF),已被证实能优化能量代谢,并被认为是一个有效的饮食和生活方式的干预手段,能改善和推迟代谢疾病的发作(di Francesco et al., 2018)。临床前研究和临床试验表明,TRF 可以防止许多健康问题,如肥胖(Hatori et al., 2012),糖尿病(Eizabeth et al., 2018)和心血管疾病(Brandhorst and Longo, 2019)。然而,TRF 益处的分子机制尚不完全清楚。到目前为止,它被证明与昼夜节律(Longo and Panda, 2016),生酮途径(de Cabo and Mattson, 2019)和肠道菌群相关。EODF 导致肠道菌群组成的变化,显著增加厚壁菌门的丰度,减少拟杆菌门和软壁菌门的丰度。肠道微生物组组成的改变导致作为发酵产物的醋酸和乳酸的增加,选择性地刺激白色脂肪组织内的米色脂肪的发展,显著改善肥胖、胰岛素抵抗和肝脂肪变性(Li et al., 2017)。根据上述实验结果,饮食干预是调节肠道微生物群并进一步影响宿主健康的潜在方法。
针对代谢疾病的肠道靶向药物
除饮食干预外,药物是代谢性疾病的主要干预手段。肠道菌群被广泛认为是宿主健康和药物的主要调节器,药物能驱动微生物组成和功能的改变,对宿主健康产生重要影响。肠道微生物群与多种常见的抗糖尿病药物相互作用,包括二甲双胍、噻唑烷二酮、米格列醇、阿卡波糖和利拉鲁肽(Whang et al, 2019)。例如,治疗 T2DM 的一线药物二甲双胍,最近被确认为改变 T2DM 患者肠道菌群组成的关键因素(Forslund et al., 2015)。机制上,我们发现二甲双胍治疗通过抑制脆弱拟杆菌和 BSH 活性来提高胆汁酸 GUDCA 水平,进而通过肠道 FXR 依赖途径改善胰岛素抵抗,提高了脆弱拟杆菌-GUDCA-肠 FXR 轴的治疗潜力(Sun et al., 2018)。二甲双胍处理增加了小肠上段内乳酸菌丰度,恢复了葡萄糖钠共转运体 1 (SGLT1)的表达,从而提高了葡萄糖敏感性(Bauer et al., 2018)。一项双盲研究表明,二甲双胍治疗导致许多菌株的相对丰度发生显著变化,包括大肠杆菌增多和肠杆菌减少。粪菌定植结果表明,二甲双胍处理的供者肠道菌群可提高葡萄糖耐量。此外,二甲双胍治疗增加了肠道微生物组中 BSH 的表达,导致血浆中未结合胆汁酸的浓度增加(Wu et al., 2017)。黄连素也可以治疗2型糖尿病及其相关并发症,如周围神经病变、肾脏疾病和心肌病(Zhang et al., 2015)。黄连素的干预增加了产生短链脂肪酸的细菌(如丁酸单胞菌、粪球菌和瘤胃球菌)和其他益生菌,包括乳酸菌和 Akkermansia 的丰度。SCFAs 在抑制炎症中发挥重要作用,从而促进肠上皮的完整性(Zhang et al., 2019)。一方面,几种口服药物在被吸收到血液中之前都经过肠道微生物酶的作用,因此肠道微生物的代谢能力会影响这些药物的吸收和功能(Kim, 2015)。反过来,药物可以调控肠道微生物组的组成和功能。因此,了解药物与肠道微生物的双向相互作用及其对代谢性疾病治疗临床疗效的影响,可能为制定改善下一代代谢性疾病的策略提供思路。
补充益生菌
目前,益生菌治疗常用来预防糖尿病(Sun and Buys, 2016)和 NAFLD (Aron-Wisnewsky et al., 2020)等代谢性疾病。为了研究益生菌对宿主的影响,评估益生菌是否在肠道内定植是至关重要的。最近的一项系统综述报告称,七项分析研究中有六项发现益生菌对粪便微生物组组成没有影响(Kristensen et al., 2016),其他部分研究也有相同结论(Eloe-Fadrosh et al., 2015; Laursen et al., 2017)。相反,也有研究观察到了经过益生菌处理的个体的粪便微生物组组成的变化(Ferrario et al., 2014; Wang et al., 2015)。因为益生菌很难在接受者的肠道中定植,所以益生元被定义为“一种被宿主微生物选择性地利用的有益健康的底物(Gibson et al., 2017)”,它对于通过促进益生菌的繁殖来操纵肠道菌群是必要的。此外,迫切需要开发一种有效地将益生菌输送到肠道的方法,因为肠道是微生物群的天然栖息地。最近,维克森林大学的研究人员发表了一篇文章,设计了一种新的系统,有效地定向输送摄入的益生菌。他们将细菌细胞包裹在改进的海藻酸盐的水凝胶中,从而保护细菌免受胃酸的破坏,使其能够有效地口服输送益生菌(Enck et al., 2020)。最近的研究表明,干酪乳杆菌 YRL577 可以通过改变肠胆汁酸途径的基因来缓解 NAFLD(Zhang et al., 2020)。此外,在体内补充植物乳杆菌 TAR4 降低了胆汁酸在肠肝循环中的吸收,增加了胆固醇到胆汁酸的分解代谢,为降低心血管风险因素提供了一种新的非药物替代方案(Lim et al., 2020)。益生菌的使用及其对肠道菌群和胆汁酸的影响是治疗多种代谢性疾病的一个日益增长和有前景的领域。
肠道微生物组的遗传操作
除了上述饮食干预和益生菌外,还有其他方法可以调节肠道微生物组的组成。斯坦福大学研究人员最近开发了一种能干净的敲除构建梭状芽孢杆菌基因的系统,以确定微生物产物的功能。梭状芽胞杆菌是一种厚壁菌门的共生细菌,通常在哺乳动物的肠道中发现。梭状芽孢杆菌产生一系列的代谢物,这些代谢物扩散到宿主的循环系统中,从基因上来说,它们是难以操纵的。为了研究肠道微生物产生的分子的作用,Guo 等人开发了一种基于 CRISPR-Cas9 的遗传系统,用于构建模型共生梭状芽孢杆菌(Clostridium sporogenes)的基因缺失,从而阻止特定分子的产生(Guo et al., 2019)。接种了突变菌株的无菌小鼠的免疫球蛋白A的产生发生了改变,免疫球蛋白 A 参与了粘膜的屏障保护。这一发现提示我们可以通过基因操纵改变肠道微生物产生的代谢物来研究代谢物与宿主之间的相互作用。然而,尽管胆汁酸对宿主生理有明显的影响,但由于对其生物合成基因的了解不全面以及缺乏基因操纵工具,我们对于调节宿主次级胆汁酸水平的能力受到限制。斯坦福大学最近发表的一篇文章建立了一种新的系统,能够操控梭状芽胞杆菌将胆酸转化为 DCA 过程中的关键酶,从而赋予不能产生次级胆酸的共生体以产生 DCA 和 LCA 的能力。该研究证明力微生物来源的途径可以被人工调控(Funabashi et al., 2020)。拟杆菌中胆汁酸代谢途径的遗传敲除,显著降低了结肠 RORγ+ 调节性 T 细胞的数量,从而加重了宿主对炎症性结肠炎的易感性(Song et al., 2020)。
其他代谢物
食物中的物质对肠道微生物群的组成有重要作用。大多数结肠微生物能利用食物中可用的蛋白质和氨基酸,从而组成自身成分以及生成相应的酶,在这种情况下,它们更喜欢食物中难以消化的发酵碳水化合物,包括吸收不良的碳水化合物、抗性淀粉和益生菌,从而产生重要的代谢物,如短链脂肪酸(SCFAs)和琥珀酸盐。在远端结肠的微生物群落中,可发酵的碳水化合物被耗尽,微生物转向蛋白质发酵,主要产生有害的代谢物如氨、苯酚、支链脂肪酸等(Canfora et al., 2019)。
SCFAs,特别是乙酸、丙酸和丁酸盐,是肠道微生物发酵的主要产物(Cummings et al., 1987)。例如,许多肠道细菌,如 B. hydrogenotrophica,可以通过乙酰辅酶 A 或 Wood-Ljungdahl 途径从丙酮酸中产生醋酸盐(Ragsdale and Pierce, 2008)。大多数丙酸盐是由拟杆菌门和一些属于 Negativicutes 的厚壁菌门(如 Phascolarctobacterium succinatutens, Dialister spp.和 Veillonella spp.)的细菌通过琥珀酸途径形成的(Louis et al., 2014)。丙酸盐、丁酸盐等 SCFAs 具有通过产生饱腹激素影响能量摄入和胰岛素分泌的能力。SCFAs 通过 GPCRs GPR43 (FFAR2)和 GPR41 (FFAR3)触发肠内分泌细胞分泌胰高血糖素样肽(GLP)-1 和 PYY(Larraufie et al., 2018; Psichas et al., 2015; Tolhurst et al., 2012)。此外,丙酸(PA)可刺激人脂肪组织中厌食激素瘦素的表达(Al-Lahham et al., 2010)。这些结果表明,SCFAs 及其受体是治疗肥胖和 2 型糖尿病的潜在靶点。除了直接影响激素的产生,SCFAs 还可以通过中枢神经系统抑制食欲。结肠醋酸盐可以穿过血脑屏障到达下丘脑,在那里醋酸盐增加谷氨酸-谷氨酰胺和 GABA 神经胶质循环,增加乳酸的产生,从而抑制食欲和营养摄入(Frost et al., 2014)。一致的是,口服丁酸能通过减少食物摄入量,预防食源性肥胖,肝脂肪变性和胰岛素抵抗,这主要伴随着下丘脑中表达神经肽Y的食欲神经元活性的抑制,以及减少孤束核和脑干背侧迷走神经的复杂神经活动(Li et al., 2018)。一项基于 952 名正常血糖的个体的微生物关联研究发现,在口服糖耐量试验后,丁酸盐肠道产量的增加与改善胰岛素反应有关。然而,另一种短链脂肪酸丙酸盐产生或吸收的异常与 T2D 风险的增加有因果关系(Sanna et al., 2019)。
除上述代谢物外,还有许多其他肠道微生物的代谢物在代谢性疾病中发挥着不可忽视的作用,这里仅作简要介绍。NASH 是一种与肥胖相关的严重肝病,以代谢综合征、肝脏脂肪变性和肝脏炎症为特征,被认为受到肠道微生物群的影响。乙醇是一种微生物的代谢物,由微生物的糖化发酵和杂交产生。NASH 和肥胖患者的粪便中含有大量的产生酒精的细菌,包括变形杆菌和肠杆菌科,并且体循环中乙醇浓度显著增加(Zhu et al., 2013)。肠道细菌来源的乙醇可能通过破坏上皮紧密连接和增加内毒素介导的肝细胞损伤参与酒精性肝病的发病机制(Rao et al., 2004)。除了乙醇,蛋白质发酵代谢物可能参与 NAFLD 的进展。高蛋白和低碳水化合物饮食改变结肠微生物群,增加氨、酚和硫化氢浓度,导致粘膜炎症,损害肠道上皮结构和肠道通透性(Yao et al., 2016)。此外,2019 年的一项研究报道,肠道微生物群通过产生代谢物 10-羟基顺式-12-十八烯酸(HYA),调节膳食中的多不饱和脂肪酸(PUFA)代谢,使宿主对高脂饮食诱导的肥胖产生抗性(Miyamoto et al., 2019)。本实验室研究报道,低温暴露可上调脂肪细胞缺氧诱导因子 2α (HIF-2 α),靶向编码碱性神经酰胺酶 2 的 Acer2 基因,触发神经酰胺分解代谢,介导低温诱导的产热,从而减轻动脉粥样硬化(Zhang et al., 2019)。
免疫在代谢性疾病中也起着重要作用。肠道微生物群与宿主免疫系统具有高度的协同进化关系,其中许多微生物是宿主生理必不可少的。新的证据表明,哺乳动物的免疫系统在维持体内微生物的稳态中起着至关重要的作用(Bain and Cerovic, 2020)。SCFAs 是组蛋白去乙酰化酶(HDACs)的抑制剂和 GPCRs 的配体,从而作为影响免疫系统的信号分子。SCFAs(丙酸,丁酸盐和醋酸)作为 HDAC 抑制剂,影响外周血单核细胞,导致核因子-κB (NF -κB) 的失活和促炎细胞因子 TNF -α 生成的减少(Usami et al., 2008)。另一项研究进一步证明,n-丁酸可以通过抑制组蛋白去乙酰化酶来调节肠巨噬细胞的功能,下调促炎介质的生成,包括一氧化氮、IL-6 和 IL-12(Chang et al., 2014)。炎症小体信号通路参与调控整合的肠道宿主-共生体微环境,微生物代谢物牛磺酸、组胺和精胺通过协同调节 NLRP6 炎症小体信号、上皮 IL-18 分泌和下游抗菌肽(AMP)谱来调节宿主-微生物相互作用(Levy et al., 2015)。脂多糖(LPSs)可引起代谢性内毒素血症,其特征是低水平的炎症、胰岛素抵抗和心血管风险增加。此外,LPSs 可触发促炎分子的释放,干扰糖、胰岛素代谢的调节,促进动脉粥样硬化斑块的发展和破裂,有利于脂肪肝的发展(Manco et al., 2010)。芳香烃受体(AHR)是一种配体诱导的转录因子,在免疫细胞和上皮细胞表达,肠道微生物的代谢物可以结合 AHR 调节粘膜免疫反应。乳酸菌代谢膳食色氨酸,产生 AHR 配体吲哚-3-醛,吲哚-3-醛刺激 ILC3,从而诱导 IL-22 的产生。IL-22 上调 AMP 的表达,提供对病原体(如白色念珠菌)的定植抗性(Zelante et al., 2013)。最近的一项研究表明,在缺乏适应性 CD4+ T 细胞活性的情况下,ILC3s 持续产生 IL-22,通过降低脂质转运体在小肠中的表达,导致宿主脂质代谢受损(Mao et al., 2018)。这些发现为肠道微生物群代谢产物如何影响组织代谢稳态提供了新的见解;因此,操纵饮食和肠道微生物群可能在预防和治疗代谢紊乱方面有潜在的治疗应用。
结论与未来展望
我们的肠道中有大量的微生物,从细菌、病毒、真菌、古菌到噬菌体和原生动物。肠道微生物可通过膳食摄入调节营养代谢,并产生多种代谢产物与宿主以多种方式相互作用,包括调节糖脂代谢途径,影响免疫细胞的分化和功能,影响胰岛素敏感性等。大量的人和动物数据为肠道菌群及其代谢物在许多代谢性疾病的发生和发展中起着至关重要的作用提供了有力的证据。
根据最近的研究和实验结果,我们发现了许多通过调节肠道微生物来改善代谢疾病的方法,包括饮食干预、益生菌的使用、基因编辑技术和药物的使用。除了上述的应用,我们还可以通过检测一个人的微生物组特征来预测其对疾病的易感性或对药物的反应。根据许多来自不同国家的临床随访研究,大多数人(可能达到 70%)(de Vegt et al., 2001; Knowler et al., 2002; Larsson et al., 2000; Santaguida et al., 2005; Shaw et al., 1999; Tuomilehto et al., 2001; Vendrame and Gottlieb, 2004)) 处于糖尿病前期状态,包括空腹血糖受损(IFG)和葡萄糖耐量受损(IGT),最终可能发展为 2 型糖尿病(Nathan et al., 2007)。此外,糖尿病前期与其他表现密切相关,包括肥胖、高血压、非酒精性脂肪肝、高甘油三酯血症和心血管疾病(Grundy, 2012)。2015 年的一项队列研究连续监测了 800 名受试者一周的血糖水平,并收集了他们的微生物群、遗传、饮食习惯、人体测量学和体育活动数据。研究人员证明,人们对相同的餐饮的反应不同,并设计了一种机器学习算法,利用个人和微生物群特征来准确预测葡萄糖反应(Zeevi et al., 2015)。
毫无疑问,我们在分析肠道微生物的组成和关键代谢物方面取得了相当大的进展。然而,我们必须承认,除了找到简单的关联,我们还需要做更多的工作。肠道微生物与宿主相互作用的复杂机制有待进一步研究。此外,需应用新技术来研究和操纵微生物群,以精确干预特定的微生物群。
(翻译全文结束,参考文献请见综述原文,可点击“The role of the gut microbiome and its metabolites in metabolic diseases”跳转至论文页面获取。)
相关知识
肠道菌群及其代谢产物与妊娠期糖尿病相关性的研究进展
:肠道菌群及其代谢产物:膳食营养素与肥胖相关疾病的桥梁
谷物调节肠道菌群,促进代谢健康
Protein & Cell观点
蛋白质基于调节肠道微生物群的健康作用研究进展
肠道菌群利用膳食纤维及其与人体健康关系研究进展
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
个体肠道菌群是精准营养干预代谢健康成功的基础
分解代谢性消瘦
宝宝过敏反复发作?不要忽视肠道菌群
网址: Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用 https://www.trfsz.com/newsview235844.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3794
- 2早上怎么喝水最健康? 3596
- 3习惯造就健康 影响健康的习惯 3266
- 4五大原因危害女性健康 如何保 3154
- 5男女激情后不宜做哪些事 3100
- 6连花清瘟、布洛芬等多款感冒药 2939
- 7男子喝水喉咙里像放了刀子一样 2439
- 810人混检核酸几天出结果?1 2209
- 9第二轮新冠疫情要来了?疾控中 2207
- 10转阴多久没有传染性?满足四个 2147






