营养调控微生物及代谢产物:对免疫和炎症的影响
菌群.营养.炎症.免疫
营养在整个生命周期中对免疫和炎症以及最终的健康有深远影响。最新研究表明,饮食对肠道微生物组成和代谢产物具有显著影响,从而对宿主免疫和炎症产生重要影响。
研究发现,我们日常饮食中的特定食物成分和代谢产物在感染、慢性炎症和癌症过程中可能表现为促炎或抗炎,这突显了饮食与微生物代谢产物对免炎调节的重要影响。这将对精准营养和治疗干预方法产生重要影响。
小鼠研究表明,饮食-微生物轴对免疫介导性疾病(包括炎症性肠病和过敏)产生影响,同时在感染、疫苗接种和癌症免疫治疗等情况下优化免疫功能。例如,人类中,膳食纤维摄入量增加与黑色素瘤免疫检查点阻断治疗反应改善相关,而长期服用抗生素可能会损害微生物群,从而降低流感疫苗的效果。
这重新激发了科学界和公众的兴趣,健康饮食意味着什么,它到底如何通过微生物群影响健康免疫系统?
本文我们就来了解一下,饮食与微生物相互作用对免疫应答调节的影响,以及对感染、慢性炎症、代谢健康和抗肿瘤免疫背景下微生物代谢产物的机制作用的新见解。
膳食成分既有直接作用,又有依赖于微生物的影响,本文侧重于后者。这也为我们提供了一个“精准营养”的新视角,根据遗传、饮食习惯、社会经济地位、微生物群等多种因素为个体或人群提供营养建议,可作为传染性、炎症性、代谢性疾病和癌症整体治疗方法的一部分。
01
膳食与肠道微生物的互动
哺乳动物与驻留在屏障部位(包括肠道)的微生物群共同演化。宿主与微生物之间的相互作用塑造了多种生理过程,包括哺乳动物的免疫应答。屏障组织及其相关微生物群暴露于各种外部因素,包括膳食摄入、药物、感染和环境污染物,统称为“暴露组”。
人类饮食的历史变化
膳食是塑造我们进化、社会和文化的最具影响力的外部因素之一。值得注意的是,在过去一个世纪,人类饮食与历史上逐渐变化的膳食相比发生了急剧而显著的变化。
这些主要变化包括:
1)植物、蔬菜和复杂碳水化合物(包括未加工的全谷物)的减少;
2)精制碳水化合物、植物脂肪、简单糖、盐和加工食品摄入量的增加;
3)广泛使用人工甜味剂、乳化剂、增稠剂、胶凝剂、稳定剂以及色素和防腐剂等化学物质。
这些变化在工业化国家更为明显,并且在与全球化增长相关的较不工业化国家中迅速发展。
饮食与肠道菌群、炎症的关联
一系列比较了世界各地人群的饮食和微生物群的人口研究表明,我们的饮食模式深刻影响肠道微生物群。例如,西方饮食改变了细菌组成并降低了微生物群的多样性或丰富度。相反,微生物群也可以改变饮食对宿主生理的影响。
人类研究表明,膳食纤维干预可以降低血液中炎症标志物;然而,在微生物多样性降低的个体中,它却会增加炎症。值得注意的是,过去100年中,炎症性疾病,包括炎症性肠病、过敏和糖尿病也一直在增加,研究揭示了与饮食和炎症相关的多样免疫调节途径。
动物来源的食物是许多营养素的高效(有时是唯一的)来源,包括铁、钙、锌、牛磺酸、肌酸、肉碱、维生素A、维生素B12、维生素D3和包括 EPA 和 DHA 在内的omega-3 脂肪酸,农业的工业化提高了这些食物的全球可获得性。
不同饮食结构影响肠道微生物组成
然而,基于动物的西方饮食会促进一种与植物为基础的饮食所促进的微生物组成不同的肠道微生物群。在小鼠和人类中,拟杆菌门(Bacteroidota)和厚壁菌门(Firmicutes)是两大微生物门,往往覆盖总微生物组的90%以上。
在猎人-采集者(如坦桑尼亚的Hazda族群、中非雨林地区的Baka族人、西非布基纳法索农民等人)的肠道微生物群中,以降解纤维为主的拟杆菌门占主导地位。
在布基纳法索首都生活的城市儿童或是与猎人-采集者Baka族人为邻但生活方式更类似西方的班图人中,厚壁菌门占主导地位。
在拟杆菌门中,普雷沃氏菌属(Prevotella属)在全球的猎人-采集者和农业人口中占主导地位,而拟杆菌属在工业化西方人口中占主导地位。
传统植物为基础饮食:普雷沃氏菌属主导
西方动物为基础的高脂饮食:拟杆菌属主导
通过饮食干预或由于迁徙至西方风格国家而从植物为基础的饮食转变为动物为基础的饮食,会导致拟杆菌属取代普雷沃氏菌属成为主导。因此,普雷沃氏菌属和拟杆菌属被认为是传统植物为基础饮食高纤维和西方动物为基础饮食高脂肪的生物标志物。高脂肪、高糖饮食及与之相关的肥胖在小鼠和人类中已被证明会降低拟杆菌属的总体相对丰度并增加Bacillota的丰度。
肠道菌群及其代谢产物如何影响宿主免疫反应和生理过程
饮食中的组分可以直接调节小鼠的免疫系统,然而最近的研究表明,饮食引起的微生物群变化也深刻影响宿主的免疫反应。在屏障表面的免疫系统可以检测微生物群及其结构成分,这种直接的相互作用建立了一种免疫反应的耐受状态。
然而,肠道微生物群产生成千上万种代谢产物,这些产物被吸收到我们的体内,并通过血液循环。许多这些代谢产物是由微生物群特异性产生的,而不是宿主产生的。它们属于不同的化学类别,包括短链脂肪酸(SCFAs)、非结合和结合的胆酸、酚类化合物、吲哚、胺类、黄酮类和气态化合物。
迄今为止已经确定的许多代谢产物是通过微生物群对饮食组分的直接转化而生成的,这些微生物群表达了能够消化特定膳食物质的专门酶。例如,短链脂肪酸是由膳食纤维的微生物发酵产生的。因此,微生物群从我们的饮食中提取和产生必需营养素,包括宿主无法产生的维生素。微生物群产生的代谢产物也是通过微生物将宿主代谢产物转化而生成的。
例如,初级结合胆酸被微生物群转化为初级非结合胆酸,进一步转化为次级胆酸或额外的结合胆酸。这些代谢产物可以在宿主的整个身体中循环,作为细胞表面或胞核受体的配体,并调节多种生物过程,包括新陈代谢、认知、组织稳态和免疫反应。
饮食可以迅速改变微生物群的组成
已经证明,饮食变化,例如从植物为基础的饮食转向动物为基础的饮食,可以在暴露于新饮食后的第一天就改变人类微生物群的组成。小鼠研究表明,饮食变化也会影响微生物群的代谢活动,因此可能会改变微生物群产生的代谢产物的浓度。
虽然某些饮食成分,包括特定类型的膳食纤维,可以促进有益菌的扩张,但其他成分可能导致菌群失调,即微生物群组成异常或微生物群产生的代谢产物失调的状态。
对于饮食对一些微生物群依赖的免疫调节效应,微生物群物种、微生物组分和宿主受体尚未完全表征。未来,揭示这些元素对于开发基于饮食和微生物群的精准营养和个性化医学将至关重要。
02
饮食和微生物群在炎症性疾病中的抗炎作用
小鼠研究表明,在稳态条件下,黏膜免疫系统建立了对肠道微生物的耐受状态。参与这种耐受性反应的免疫细胞包括调节性T细胞(Treg细胞)和第3组固有淋巴细胞(ILC3s)等。然而,微生物群失调或异常免疫激活可能会破坏耐受性并引发慢性炎症病症。在这里以炎症性肠病为例来讨论。
饮食和微生物群在膳食纤维和炎症性疾病的背景下的作用是最受关注的。
膳食纤维 & 短链脂肪酸
膳食纤维是一种复杂的碳水化合物,哺乳动物无法消化,而是被肠道微生物群发酵。微生物群利用膳食纤维作为营养源,并将其转化为包括乙酸、丙酸和丁酸在内的短链脂肪酸(SCFAs)。
短链脂肪酸激活几种G蛋白偶联受体,包括GPR41和GPR43,并抑制组蛋白去乙酰化酶(HDACs)。最近的研究表明,在各种炎症性疾病背景下,这些受体配体相互作用通过不同机制有助于抑制炎症。
短链脂肪酸对免疫细胞的影响
2009年一项开创性研究表明,乙酸能够通过GPR43依赖的方式促进小鼠肠道损伤和炎症模型中炎症的缓解。调节性T细胞在抑制炎症中起着关键作用,并且在维持免疫稳态和自身耐受性方面至关重要。Treg细胞对于控制自身免疫疾病和包括炎症性肠病在内的慢性炎症病症至关重要。
饮食对慢性炎症性疾病的影响

Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
2013年,微生物群研究取得了重要里程碑,发现短链脂肪酸通过激活GPR43和抑制HDACs促进小鼠Treg细胞的分化和扩张。此外,无菌小鼠或饲养低纤维饮食的特定无特定病原体(SPF)小鼠显示短链脂肪酸和结肠Treg细胞减少。
最后,研究表明短链脂肪酸对小鼠T细胞转移结肠炎模型具有保护作用。这些研究是早期揭示微生物代谢产物直接调节免疫细胞的一些报告之一。从那时起,已经证明短链脂肪酸在小鼠各种炎症性疾病模型中具有抗炎作用,包括哮喘、关节炎和实验性自身免疫性脑脊髓炎(EAE)。
值得注意的是,短链脂肪酸介导的抑制HDACs的作用不仅限于促进Treg细胞,因为乙酸和丙酸也可以在适当细胞因子的预处理下促进Th1或Th17细胞的产生。
短链脂肪酸调节肠道微生物群
罗伊氏乳杆菌(Lactobacillus reuteri)是一种与人体共生的细菌物种,在系统性红斑狼疮(SLE)小鼠模型中,可以通过促进外周树突状细胞的聚集和在肠道和脾脏中提高Ⅰ型干扰素基因表达,来加重疾病结果。
通过饮食中的抗性淀粉,可以逆转罗伊氏乳杆菌(Lactobacillus reuteri)加重SLE的效应。从机制上讲,抗性淀粉诱导的短链脂肪酸通过直接抑制罗伊氏乳杆菌的生长来改善疾病。
注:抗性淀粉,一种被认为是膳食纤维的淀粉形式,因为它逃避了消化并被微生物群发酵。
膳食纤维还发挥着独立于短链脂肪酸的重要抗炎作用
膳食纤维可以保护肠壁的粘液层。如果小鼠缺乏膳食纤维,肠道微生物群就会利用宿主上皮细胞分泌的粘液糖蛋白,导致粘液层降解。这种保护性结肠粘液屏障的侵蚀,会导致肠道病原体Citrobacter rodentium(啮齿类柠檬酸杆菌)进入上皮的机会增加,从而促进结肠炎。
总的来说,这些研究突出了膳食纤维和短链脂肪酸通过多样化的免疫调节途径发挥抗炎作用。
值得注意的是,除了膳食纤维外,发酵食品(包括泡菜、酸菜、乳酪、开菲尔等)也改变了肠道微生物组成和代谢产物,这与人体中炎症标志物的降低相关。这些食物可以作为益生菌,通过提供特定的微生物种群(例如乳杆菌属)以及作为益生元,促进其他微生物种群(例如梭菌和拟杆菌属),从而改善微生物多样性。然而,发酵食品和涉及的微生物种群和代谢产物的抗炎作用机制尚未完全理解,需要进一步研究。
膳食蛋白质 & 色氨酸代谢产物
膳食蛋白质,特别是富含色氨酸的食物,如鸡肉、牛奶,也可以影响具有抗炎特性的微生物代谢产物。色氨酸是一种必需氨基酸,存在于富含蛋白质的食物中,人体利用它来产生神经递质5-羟色胺,稳定情绪,褪黑素,调节睡眠的激素,以及维生素B3,作为辅酶。
然而,微生物群也将色氨酸代谢为色胺和吲哚衍生物,包括吲哚-3-醛、吲哚乙酸、吲哚-3-丙酸和吲哚磺酸酯。这些代谢产物可以作为芳香烃受体(AhR)的激动剂,AhR是一个转录因子,在许多哺乳动物细胞类型中调节关键基因表达。
微生物来源的色氨酸代谢产物吲哚、吲哚-3-磺酸盐、吲哚-3-丙酸和吲哚-3-醛在小胶质细胞中的AhR信号传导改变了星形胶质细胞的免疫信号,并减轻了实验性自身免疫性脑脊髓炎的疾病严重程度。
值得注意的是,AhR还可以被各种植物来源、外源化合物和内源配体激活。通过芥蓝科蔬菜(例如西兰花和抱子甘蓝的代谢物)产生的一种代谢产物吲哚-3-甲醇(indole-3-carbinol)激活AhR已被证明促进ILC3s的扩增及其产生组织保护性IL-22,有助于增强多种结肠炎实验模型中的组织保护作用。
通过外源配体2,3,7,8-四氯二苯并二恶英(TCDD)激活AhR可以促进T调节细胞的扩增并抑制实验性自身免疫性脑脊髓炎。相反,内源配体6-甲醛吲哚[3,2-b]咔唑(FICZ)抑制T调节细胞的发育并促进T辅助17细胞的分化,导致实验性自身免疫性脑脊髓炎加重。这些研究表明,AhR在免疫细胞中的功能通常是配体特异的。
关于芳香烃受体(AhR)和色氨酸的详细代谢可以关注下谷禾以前发表的文章:
色氨酸代谢与肠内外健康稳态
03
饮食和肠道微生物的促炎效应
膳食脂肪
西方饮食逐渐缺乏膳食纤维,脂肪含量增加,添加盐和糖的浓度也增加,包括蔗糖和高果糖玉米糖浆。尽管西方饮食常常与动物脂肪摄入增加有关,但增加的脂肪含量主要来自全球范围内变得更加普遍的植物油和脂肪。
高脂饮食导致微生物群失调与炎症关联
与高脂饮食或肥胖相关的微生物群组成变化已与小鼠和人类的炎症联系在一起论。高脂饮食会导致小鼠和人类肠道微生物群失调,降低微生物多样性或“丰富度”。在小鼠中,这种微生物群失调已与肠道通透性增加相关联。这导致小鼠在四周内出现低级别肠道炎症。这种初始的炎症反应最终发展成涉及脂肪组织和肝脏炎症的全身性炎症状态,导致胰岛素抵抗。
Ccl2介导的炎症反应在代谢紊乱中的作用
肠道中增加上皮趋化因子Ccl2的表达引发了炎症反应,导致结肠粘膜下层的促炎性巨噬细胞的招募。随后CCL2的全身性升高导致促炎性巨噬细胞渗入脂肪组织,随后是其他炎症免疫细胞类型的积累,包括Th1细胞、CD8+T细胞、自然杀伤细胞(NK细胞)和中性粒细胞。
敲除Ccl2或其受体(Ccr2)可以改善脂肪组织炎症、肝脂肪变性和葡萄糖耐量。在人类肥胖的情况下,胰岛素抵抗主要是由肌肉内炎症驱动的,其特征是肌肉和肌周脂肪组织内免疫细胞的大量浸润。在肥胖的人类中,炎症和胰岛素抵抗与微生物群丰富度降低有关。
此外,减重会降低各种炎症标志物的浓度,包括肿瘤坏死因子α(TNF-α)、IL-6和C-反应蛋白。综上所述,这些数据突出了微生物群在促进炎症和相关代谢紊乱方面在高脂饮食和肥胖背景下的影响。
膳食脂肪促进硫还原致病菌增殖,导致慢性肠道炎症
除了微生物群失调和相关的低级别肠道炎症外,已经显示膳食脂肪可以促进特定微生物物种的积累,这些微生物可以直接导致慢性肠道炎症。例如,高脂饮食会促进牛磺胆酸(TCA)的产生,TCA被释放到肠道中溶解脂肪。研究表明,TCA的高浓度增加了肠道中有机硫的可用性,导致硫还原致病菌(Bilophila wadsworthia)的大量增殖,从而促进Il10−/−小鼠的结肠炎。这些研究需要进一步调查,以更好地表征膳食脂肪相关微生物群与炎症性肠病之间的关联。
添加的糖和盐
除了膳食脂肪外,添加的糖和盐也以微生物群依赖的方式促进肠道和其他器官的炎症。
高浓度简单糖改变肠道菌群,加重炎症
高浓度的简单糖(如葡萄糖、蔗糖和果糖)改变小鼠的微生物群组成,并与粘蛋白降解致病菌的增加、粘液层侵蚀和肠道通透性增加相关。这导致结肠中IL-1β、IL-6和TNF-α的表达增加,中性粒细胞浸润,并在多种实验性结肠炎模型中以微生物群依赖的方式加重疾病严重程度。
高量的食用食盐(氯化钠)也以微生物群依赖的方式加重化学诱导的结肠炎
高量的食用食盐还通过改变微生物群促进致病性Th17细胞的产生,并加重EAE中的炎症和疾病结果。此外,高量的食用食盐会减少人类和小鼠中的几种乳酸菌菌株。值得注意的是,补充乳酸菌菌株可以预防食盐诱导的EAE加重,表明乳酸菌在神经炎症中具有保护作用。
膳食成分对感染免疫力的影响
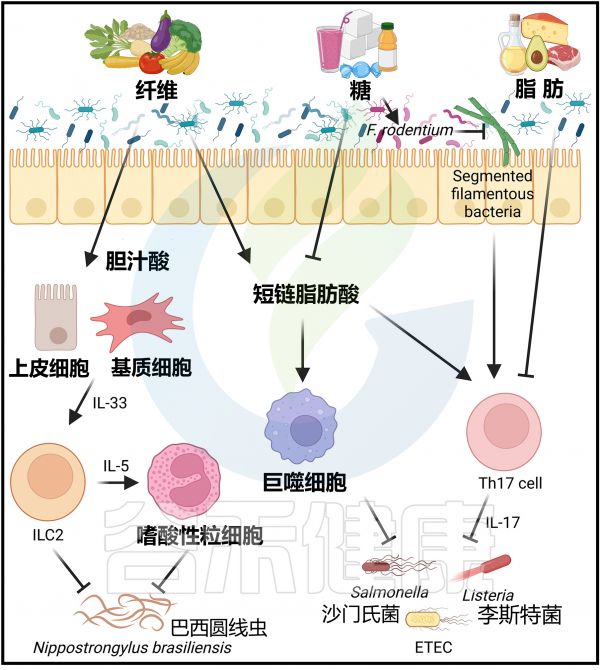
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
膳食纤维在结肠炎中的作用存在争议
尽管膳食纤维来源的短链脂肪酸(SCFAs)在多种结肠炎小鼠模型中减少肠道炎症,如前文所述,但使用各种高纤维饮食进行的类似研究报道了矛盾的结果。
例如,基于阿拉伯木聚糖的车前子、基于半乳糖的果胶和瓜尔胶具有抗炎或组织保护作用,而基于果糖的菊粉则加重炎症。已进行了多项临床试验来调节IBD患者的膳食纤维,尽管效果不一。此外,通常建议IBD患者避免富含纤维的饮食,因为膳食纤维可能加重疾病。然而,膳食纤维介导疾病恶化的机制尚不清楚。因此,在IBD背景下膳食纤维的作用仍存在争议。值得注意的是,最近的一项研究发现,低聚果糖,即菊粉纤维的结构单位,可以激活人类巨噬细胞产生与结肠炎相关的促炎细胞因子,包括IL-1β和IL-23。
此外,一项随机对照试验表明,给溃疡性结肠炎(UC)患者服用菊粉会增加结肠中的炎症细胞因子,包括IL-1β、IL-23和IL-5,并导致部分患者症状复发。在小鼠中,基于菊粉的高纤维饮食上调微生物群来源的胆酸代谢产物,促进IL-33的产生。这导致自然淋巴细胞群2(ILC2s)的激活和IL-5的产生,导致结肠中的嗜酸性粒细胞炎症。
菊粉纤维饮食还会触发肺部嗜酸性粒细胞增多,并加重小鼠过敏性气道炎症模型的疾病结果,而果胶纤维具有保护作用。
这些研究强调了假设膳食纤维的作用与SCFAs相同是误导性的。
首先,不同类型的膳食纤维可能提供不同数量和比例的SCFAs。
此外,不同类型的纤维可能产生不同类别的代谢产物,这些代谢产物可能具有多样的生物效应和慢性炎症性疾病的临床结果,这些我们刚刚开始了解。
但是以上数据表明饮食-微生物群轴对免疫细胞稳态和炎症性疾病具有深远影响。
04
饮食、微生物群和免疫对抗感染
除了影响各种炎症性疾病外,饮食和微生物群也被证明能够塑造对抗各种感染的免疫反应。尽管膳食纤维大多能够保护免受感染,但膳食脂肪和糖分却可能促成病原体发病过程。
正如前面所讨论的,膳食纤维通过维持肠道屏障完整性来保护免受肠道感染的影响,因为膳食纤维不足会促使以粘蛋白为食的微生物群破坏小鼠肠道的保护性黏液层。
丁酸对肠道病原体的多种抗菌机制
来源于纤维的丁酸盐有助于体外维持结肠上皮细胞的紧密连接完整性。丁酸也可以通过HDAC3抑制促进单核细胞向巨噬细胞的分化。因此,丁酸增强了小鼠巨噬细胞对一系列肠道病原体(包括沙门氏菌伤寒沙门氏菌和粘附侵袭性肠毒素产生大肠埃希菌)的抗菌活性,这与增强的抗菌肽产生和吞噬能力有关。丁酸还降低了上皮细胞的氧化程度,从而限制了沙门氏菌的需氧生长。
丙酸,另一种SCFA,可以通过破坏细胞内pH稳态直接抑制伤寒沙门氏菌的生长。最后,对口服感染的小鼠进行丁酸补充可以促进细菌清除,并防止这些病原体的全身传播。
微生物群对抗病毒免疫的重要性
微生物群在天然和适应性抗病毒免疫中也发挥着至关重要的作用。涉及微生物群消耗或改变的小鼠研究表明,微生物群对包括诺如病毒、黄病毒和流感病毒在内的病毒感染的保护性免疫反应至关重要。
已经证明微生物群对于最佳激活不同抗病毒机制是必不可少的,包括干扰素反应、CD4+和CD8+ T细胞反应以及抗体产生。虽然膳食纤维和SCFA通过增强效应细胞CD8+ T细胞功能在抗病毒免疫中发挥着关键作用,但饮食和微生物群来源的代谢产物在许多微生物群调节的抗病毒免疫机制中的作用仍需要进一步研究。
膳食纤维在蠕虫感染免疫中的保护作用
膳食纤维还通过其他代谢产物在小鼠中提供对蠕虫感染的保护性免疫。富含菊粉的高纤维饮食促进了细菌去共轭胆酸,提高了体内各种未共轭胆酸的浓度,包括胆酸。这些微生物群来源的胆酸增加了肺上皮细胞和肠间质基质细胞产生IL-33,导致ILC2s的激活。
当小鼠感染蠕虫寄生虫巴西圆线虫(Nippostrongylus brasiliensis),这种寄生虫会感染肺部,然后迁移到肠道,与对照组饮食喂养的小鼠相比,富含菊粉的饮食会增加肺部的杯状细胞和肠系膜淋巴结中的嗜酸性粒细胞。
这些由菊粉纤维诱导的2型免疫反应导致了肠道中蠕虫的加速排出,表明了膳食纤维在抵御寄生性蠕虫方面的益处。这些研究可能有助于增加全球对食物和补品的了解,特别是在那些细菌性肠道感染和蠕虫感染仍然地方性流行的地区。
肠道微生物群对传染性疾病疫苗效果的调节
肠道微生物群及其相关代谢产物在小鼠对传染性疾病疫苗的有效性中也发挥着重要作用。例如,小鼠巨噬细胞通过检测肠道微生物群菌株产生的鞭毛蛋白,促进巨噬细胞内固有产生浆细胞生长因子,直接促进浆细胞产生抗体。
此外,B淋巴细胞可以利用来源于膳食纤维衍生的SCFA产生的乙酰辅酶A作为细胞代谢的燃料,从而支持抗体的产生。
在人类中,许多研究将微生物群与对各种传染性疾病的疫苗反应联系起来。例如,已经证明抗生素介导的微生物群失调会损害那些预先抗体滴度较低的受试者对季节性流感的抗体反应,并且与抗生素治疗导致次生胆酸系统浓度降低有关。然而,各种饮食在微生物调节疫苗反应中的作用仍未得到充分探讨。
高脂饮食快速影响微生物群组成和免疫反应
正如前面讨论的那样,高脂饮食会增加小鼠肠道微生物群中Bacillota的数量,并以微生物群依赖的方式促进肠道通透性和炎症。尽管高脂饮食诱导的小鼠肥胖需要数月的膳食干预,但微生物群组成的转变和相关的免疫反应变化是迅速的,可以在几天内检测到。相关研究表明,进行为期两周的高脂饮食干预足以加重小鼠对病原细菌感染的情况。例如,口服李斯特菌单胞菌感染的小鼠,高脂饮食组的盲肠、肠系膜淋巴结和脾脏中细菌负荷增加,比饲喂常规饮食组高。
在人类中,饮食引起的微生物群变化也会在饮食发生重大改变后立即开始。一个典型的饮食变化例子是从以植物为基础的饮食转变为以动物为基础的饮食,这在社交活动期间的宴会中经常发生,比如参加宴会。这些宴会饮食通常富含脂肪和糖分,而纤维含量较低。
饮食改变对抗肿瘤免疫和癌症免疫疗法的影响
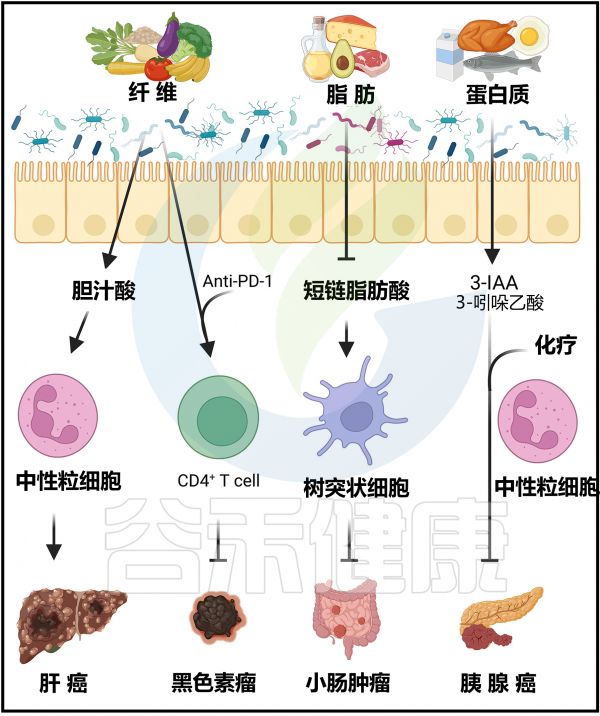
Arifuzzaman M et al., Immunity. 2024 57(1):14-27.
短期宴会饮食通过影响微生物群和Th17细胞抑制小鼠肠道免疫
一项研究使用了一种高脂肪、富含糖分(双糖和寡糖)、富含胆固醇、低纤维的饮食,因此模拟了“宴会饮食”。
研究发现,短暂接触这种宴会饮食会改变小鼠的微生物群组成,并抑制对细菌感染的黏膜免疫。在小鼠的回肠内容物中观察到了微生物群的快速和可逆性变化,宴会饮食3天后微生物群多样性减少,但在停止宴会饮食3天后迅速恢复到基线组成。
值得注意的是,这种为期3天的宴会饮食足以降低小肠Peyer氏板中Th17细胞的数量,降低回肠中Il17a、Il17f和Il22等3型细胞因 子的表达,这些细胞因子在维持肠道上皮屏障和抵御细菌病原体方面起着关键作用。
因此,这种饮食转变可能导致对沙门氏菌和李斯特菌感染的更高敏感性。与接受常规饮食小鼠回肠内容物的无菌小鼠相比,接受宴会饮食小鼠回肠内容物的无菌小鼠Il17a和Il17f的表达也减少,表明这种饮食介导的免疫抑制依赖于并可通过肠道微生物群传播。
高脂饮食(其中≥90%的热量来自脂肪)也会降低小鼠肠道中的Th17细胞,这与酮体介导的双歧杆菌耗竭有关。
值得注意的是,在不添加任何脂肪的低纤维、高糖饮食中,小鼠Th17细胞和细胞因子的减少情况也相似,这表明免疫表型的变化不取决于膳食脂肪,而是取决于饮食的能量密度和缺乏纤维。
宴会饮食降低SCFA,蔗糖促进Faecalibaculum rodentium 扩增,影响Th17细胞水平
宴会饮食会降低盲肠内容物中的乙酸和丁酸浓度,给予这两种短链脂肪酸(SCFA)的补充可以恢复Th17细胞数量并增强对沙门氏菌的保护。此外,另一项研究表明,向以普通饲料为基础的小鼠提供蔗糖饮水足以减少Th17细胞数量,这意味着小肠Th17细胞的减少也可能是由于高量的膳食糖引起的。
蔗糖会促使Faecalibaculum rodentium(该菌属于芽孢杆菌门下的Erysipelotrichaceae家族)的扩张。Faecalibaculum rodentium的扩增导致分段丝状细菌的替代,而后者已知能诱导和维持Th17细胞。
综合这些数据表明,虽然膳食纤维通过微生物群来源的短链脂肪酸和胆酸代谢产物对抗感染具有益处,但缺乏膳食纤维同时高量的脂肪和糖可能会削弱对各种肠道细菌病原体的肠道免疫力。
05
饮食和微生物群对抗肿瘤免疫和癌症免疫疗法的影响
过去的十年里,许多临床前和临床研究报告指出,微生物群的组成在免疫系统对肿瘤的控制中起着重要作用,并可以促进对治疗的反应。
无菌小鼠或接受抗生素治疗的小鼠对化疗和免疫疗法表现出增强的抗药性。相比之下,口服具有益生菌Bacteroides fragilis有助于提高SPF小鼠对黑色素瘤的抗CTLA-4或抗PD-L1反应。
膳食纤维 & 菌群 & 抗肿瘤疗效
另外,缺乏膳食纤维的小鼠对黑色素瘤的抗PD1免疫检查点疗法没有反应,这与Ruminococcaceae的减少有关。这些小鼠中膳食纤维的抗肿瘤效果与CD4+T细胞增加有关。
在黑色素瘤和上皮癌患者中,对抗PD-1疗法的反应者和非反应者之间微生物组成存在显著差异。治疗反应与肿瘤中CD4+和CD8+T细胞的浸润增加有关,这与肠道微生物多样性高的几种菌,包括Akkermansia muciniphila、粪杆菌属(Faecalibacterium)、毛螺菌科(Lachnospiraceae) 等有关。这些菌谷禾专门科普过,详见:
AKK菌——下一代有益菌
肠道核心菌属——普拉梭菌(Faecalibacterium Prausnitzii),预防炎症的下一代益生菌
肠道核心菌属——毛螺菌属(Lachnospira)
膳食纤维增强抗肿瘤效果,瘤胃球菌、粪杆菌属等与癌症免疫治疗反应有关
抗生素治疗可能降低上皮癌患者抗PD-1疗法的临床益处。黑色素瘤患者对免疫检查点抑制剂疗法的反应不佳与膳食纤维摄入不足(<20克/天)有关。
与无反应者相比,反应者的微生物群显示出瘤胃球菌科(Ruminococcaceae)和粪杆菌属(Faecalibacterium)的富集。值得注意的是,发挥抗肿瘤作用的有益微生物群是可传播的。
与无反应患者的粪便微生物群移植 (FMT) 相比,来自有反应患者的无菌或抗生素治疗小鼠,对抗 PD-1 和抗 PD-L1 治疗黑色素瘤和肉瘤的反应更好。
此外,来自应答患者的 FMT 可以促进免疫细胞(包括 CD8 + T 细胞)的数量和激活状态,并提高黑色素瘤患者抗 PD-1 治疗的临床获益。
这些发现表明,膳食纤维通过维持微生物群分类群(包括瘤胃球菌科和粪杆菌属)来促进癌症免疫治疗,从而改善治疗结果。然而,需要进一步的研究来确定微生物菌株和相关代谢物在这些疗法的有效性中的具体作用。
菌群代谢产物 & 抗肿瘤疗效 & 饮食
吲哚-3-乙酸增强胰腺癌化疗效果
微生物群来源的代谢产物已被证明可以调节多种癌症小鼠模型的临床结果。从膳食色氨酸的微生物代谢中产生的吲哚-3-乙酸可以以中性粒细胞依赖的方式增强小鼠对胰腺癌的化疗效果。从理论上讲,中性粒细胞来源的髓过氧化物酶氧化吲哚-3-乙酸,氧化产物可以阻止癌细胞的增殖。
除了上述关于饮食和微生物群在抗肿瘤疗法中的作用的研究外,还有几项研究强调了饮食和微生物群在肿瘤发生中的作用。
高脂饮食降低短链脂肪酸,促癌
高脂饮食会降低小鼠粪便中的短链脂肪酸浓度,并以微生物群依赖的方式促进易感基因小鼠肠道肿瘤的发展。通过丁酸的给药可以减轻高脂饮食介导的肿瘤进展,丁酸可以促进树突状细胞的招募。
菊粉纤维可能促癌
尽管膳食纤维通常被认为对抗肿瘤疗法有益,但特定类型的纤维可能会以依赖环境的方式发挥促肿瘤作用。例如,菊粉纤维通过改变与升高的胆酸代谢物和肝内中性粒细胞炎症相关的微生物群,促进小鼠肝细胞癌的发展。
综合这些研究表明,通过膳食调节微生物群来源的代谢产物影响肿瘤发生和治疗结果,这可以用于精准营养学以预防和治疗癌症。
06
展 望
肠道微生物群与免疫系统之间的相互作用形成了两者的组成和功能,从而在外周组织中维持稳态平衡。
关键是,饮食可以维持或扰乱这种平衡,导致有益或有害的影响。饮食可以调节微生物组成和菌群失调,取决于微生物群的状态和膳食暴露的类型。
挑战
剖析特定菌株与识别微生物来源代谢产物
虽然膳食纤维的抗炎作用以及膳食糖和脂肪的促炎后果已被充分确立,但我们对其他膳食成分如何影响免疫系统的了解仍然有限。此外,剖析调节这些过程的特定微生物菌株和代谢产物是具有挑战性的。基于代谢组学的最新进展已经允许在各种宿主组织部位检测和定量低丰度代谢产物。
最近可用的公共数据库和生物信息学工具有助于在质谱数据中识别微生物来源的代谢产物。此外,基于CRISPR的细菌遗传学正在使得难以培养或操作的微生物菌株的操纵成为可能。
新兴工具和技术
研究免疫介导性疾病中
微生物群和代谢产物
通常,一个蛋白质的合成由一个基因介导,而一种代谢产物的合成涉及多个代谢酶(因此,多个基因),这增加了微生物群介导的宿主代谢产物生产的复杂性。据统计,在非靶向代谢组学分析中,只有不到2%的光谱被注释;即98%的光谱与现有数据库中的化合物不匹配。据推测,这些“暗物质”的相当一部分具有微生物起源。
额外的计算工具,如CSI:FingerID,将有助于通过质谱观察到的这些光谱的注释。
在微生物群的基因操纵中,可以确认微生物菌株及其代谢途径在微生物驱动的表型中的作用。然而,以往,由于许多非模式菌株的遗传可操作性存在限制,这种策略是难以实现的。
基于CRISPR-Cas9的技术的最新发展已经允许针对非模式微生物进行遗传研究。这些遗传工具还可以有助于因果关系或干预研究以及未来基于代谢产物的治疗。外部提供的代谢产物的剂量和数量可能无法准确模拟微生物来源的剂量和数量。因此,一种精确地探究微生物群衍生分子在其产生环境中的方法是通过删除负责基因,从而“切断”各种共生微生物来源的代谢产物的产生。这些额外的遗传和生物信息学工具将有助于推动机制研究,并确定特定微生物菌株和微生物来源的代谢产物在调节各种免疫途径中的不可替代作用。
潜力
微生物群与个性化治疗性饮食
我们目前对营养调节炎症的了解仅限于个别营养素或食物类别。饮食模式和摄食行为也可以影响肠道微生物群和人体健康。我们通过神经元和化学感受味觉受体感知饮食方式,可以影响与饮食相关疾病的病理生理学。
然而,对微生物群在这些过程中的作用的理解仍然不完整。通过个性化治疗性饮食和营养干预的精准营养的当前愿景需要更深入的机制理解饮食-微生物群相互作用和摄食行为,并将其与年龄、性别和疾病相关参数相结合。
对饮食-微生物群-代谢物三者之间关系的更好理解为在三个层面开发有针对性的治疗提供了潜力:
1)益生元,促进特定微生物群的饮食
2)益生菌,特定野生型或基因工程微生物群
3)后生元,特定微生物群衍生代谢产物或具有更好疗效的合成类似物。
结合我们对微生物代谢产物在基因、细胞、分子和化学生物学水平的了解,可以更好地理解它们在调节宿主炎症和免疫中的作用,并通过操纵饮食-微生物群轴促进健康。
主要参考文献:
Arifuzzaman M, Collins N, Guo CJ, Artis D. Nutritional regulation of microbiota-derived metabolites: Implications for immunity and inflammation. Immunity. 2024 Jan 9;57(1):14-27.
Akagbosu B, Tayyebi Z, Shibu G, et al. Novel antigen-presenting cell imparts Treg-dependent tolerance to gut microbiota[J]. Nature, 2022, 610(7933): 752-760.
Montrose D C, Nishiguchi R, Basu S, et al. Dietary fructose alters the composition, localization, and metabolism of gut microbiota in association with worsening colitis[J]. Cellular and molecular gastroenterology and hepatology, 2021, 11(2): 525-550.
Bisanz J E, Upadhyay V, Turnbaugh J A, et al. Meta-analysis reveals reproducible gut microbiome alterations in response to a high-fat diet[J]. Cell host & microbe, 2019, 26(2): 265-272. e4.
Alexander M, Turnbaugh P J. Deconstructing mechanisms of diet-microbiome-immune interactions[J]. Immunity, 2020, 53(2): 264-276.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
生命早期营养不良和微生物群影响大脑发育和行为
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
环境污染对肠道菌群和免疫系统的影响
抗炎=抗癌!最佳抗发炎食物,吃对好油调节免疫
Nature子刊:顺产还是剖腹产,或影响婴儿微生物组和疫苗反应
环境如何通过微生物组影响人的健康?
Cell Research:防御与营养并重:揭示母乳如何塑造婴儿的微生物群和免疫力
Cell Research:防御与营养并重:揭示母乳如何塑造婴儿的微生物群和免疫力@MedSci
健康肠道微生物群对减肥的益处
肠道微生物群、营养与长期疾病风险:母婴视角
网址: 营养调控微生物及代谢产物:对免疫和炎症的影响 https://www.trfsz.com/newsview235845.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3889
- 2早上怎么喝水最健康? 3671
- 3习惯造就健康 影响健康的习惯 3317
- 4五大原因危害女性健康 如何保 3226
- 5连花清瘟、布洛芬等多款感冒药 2978
- 6男子喝水喉咙里像放了刀子一样 2472
- 710人混检核酸几天出结果?1 2237
- 8第二轮新冠疫情要来了?疾控中 2232
- 9补肾吃什么 补肾最佳食物推荐 2204
- 10转阴多久没有传染性?满足四个 2171






