Nature Metabolism综述:T细胞耗竭的代谢和表观遗传学调控
免疫治疗能增强宿主清除肿瘤细胞和病毒的能力,并已产生了令人瞩目的临床成果。但在长时间暴露于相关抗原后,CD8+T细胞会进入一种特异性的分化状态,即为耗竭型T细胞,这成为免疫治疗在慢性病毒感染和肿瘤发展中发挥有效抗病毒或抗肿瘤作用的主要障碍之一。越来越多的相关研究证实,耗竭型T细胞形成中经历了代谢不足并伴随着信号分子通路和表观遗传学的整体改变,这导致了有效免疫反应的抑制和免疫检查点治疗的无效。2020年10月瑞士洛桑大学的研究人员于《Nature Metabolism》杂志发表了一篇名为“Metabolic and epigenetic regulation of T-cell exhaustion”的综述,对T细胞耗竭转化过程的代谢与表观遗传学调控进行了系统性概述。

T细胞激活后,原始CD8+T细胞(naïve CD8+T cell)会分化为效应T细胞或记忆T细胞,这一过程需要代谢重组产能支持。原始T细胞主要通过氧化磷酸化产能,但在激活后,则通过PI3K-Akt-mTOR通路的调控而发生代谢改变以支持其分化为效应性T细胞,从而转变为依赖于有氧糖酵解供能以支持其快速的分化和发挥效应。与之相对应的,抗原清除后持续存在的记忆性T细胞代谢特征表现为高水平的氧化磷酸化和自噬。另外,线粒体的动态也与T细胞代谢相联系,以支持细胞分化或在应激条件下的能量需求和免疫反应。在效应T细胞中,T细胞受体(TCR)信号促进线粒体分裂并导致较低的呼吸活动。相比之下,记忆T细胞含有相对较大的线粒体质量,线粒体具有融合的超微结构和相对较高的备用呼吸能力(SRC);这些特性被认为是在没有抗原刺激的情况下支持这些细胞的生存。但是,在肿瘤或慢性病毒感染情况下,由于受到持续的抗原刺激,T细胞出现耗竭型表型。
耗竭型T细胞的特征包括:抑制性受体表达升高,TCR受刺激后效应降低,增殖能力降低。研究也证实耗竭型T细胞也表现出明显特有的表观遗传学特征,这也导致了免疫治疗效果欠佳。与效应性T细胞和记忆性T细胞相反,耗竭型T细胞表现为代谢不足与线粒体呼吸功能和糖酵解抑制;另外,T细胞耗竭的进程也与内质网压力信号反应升高有关。这些发现证实了T细胞代谢重编程对T细胞分化和效应的重要性,并提示代谢不足可能会加剧耗竭型T细胞的生成。
在这篇综述中,作者总结了肿瘤和病毒感染时相应的T细胞分化及代谢改变,讨论了T细胞耗竭与代谢、表观遗传调控的联系。此外,还讨论了如何利用代谢调控来调控耗竭型T细胞,从而发挥更好的抗肿瘤和抗病毒免疫。
耗竭型T细胞如休息或者垂死的战士
在慢性疾病中机体免疫系统持续暴露于抗原和激活信号后,例如在慢性病毒感染或癌症发展期间,CD8+ T细胞分化为一种终末分化状态,称为耗竭型T细胞。在T细胞耗竭的发展过程中,CD8+ T细胞逐渐失去效应细胞因子的产生和增殖潜能,抑制受体PD-1、Tim-3和Lag-3的表达逐渐增加。耗竭型T细胞的生理意义主要是防止在慢性感染中的过度病理学免疫。
有研究表明,耗竭型T细胞并非是从终末期的效应性T细胞转变而来,而是从记忆性T细胞前体而来,这意味着持续的或被扰乱的T细胞激活信号可以阻碍记忆性T细胞分化并促进耗竭型T细胞分化表型。值得注意的是,耗竭型T细胞是一类具有异质性的细胞群,具有不同分化阶段和对应的特征。如早期耗竭型T细胞可以被PD-1抗体等免疫检查点抑制剂(immune checkpoint blockade, ICB)逆转后而恢复一定的增殖和免疫效应力;而终末期阶段的耗竭型T细胞即使抗原刺激消失也会特征性的持续表达抑制性受体,增殖能力和效应力也极低,也不能被PD-1抑制剂治疗而恢复其抗肿瘤或抗病毒效能。
研究表明,一类特异性表达TCF-1(T-cell factor 1)的CD8+T细胞,表现出干细胞性质:包括自我修复,增殖,分化为耗竭型T细胞,在LCMV clone13感染和肿瘤的小鼠中,通过PD-1抗体治疗,这类细胞的这些能力可以被进一步增强。这一特异类型的T细胞,即是前体耗竭型T细胞,表达高水平的CXCR5,SLAMF6和TCF-1。研究证实TCF-1表达水平对这类细胞形成和干细胞表型维持具有重要意义。近期一项研究发现,在慢性病毒感染的早期,TCF-1可拮抗终末期效应性T细胞的形成并促进前体耗竭型T细胞的形成;并且,在抗PD-1治疗后,这一前体耗竭型T细胞是逐渐分化为终末期耗竭型T细胞的主要亚型。有研究表明,TCF-1协同一些其他转录因子调控了从前体耗竭型T细胞到终末期耗竭型T细胞这一多层级性的分化过程(图1)。这些观察结果表明,T细胞衰竭的分化程序最终将T细胞锁定在一个永久性的功能失调状态,从而阻碍了T细胞的病毒特异性和肿瘤免疫反应。然而,但在TCF-1特异性细胞中,决定其向耗竭型T细胞分化和维持其干细胞样表型的潜在机制和激活过程大部分仍是未知的。
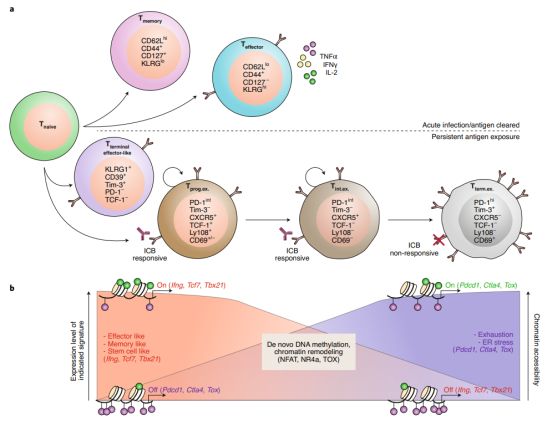
图1.耗竭型T细胞的特征和表观遗传学重组
环境调节使T细胞分化和耗竭发生偏斜
1.免疫调节细胞
除了慢性的TCR刺激,在肿瘤微环境(TME)中多种免疫抑制因素可以影响T细胞分化并驱动T细胞衰竭,包括细胞因子环境、营养剥夺和暴露于免疫抑制分子 (图2)。Treg细胞经常在TME中异常积聚并表达免疫抑制分子,包括细胞因子IL-10、IL-35和TGF-β,进而抑制T细胞的抗肿瘤反应。肿瘤浸润性淋巴细胞(TILs)中Treg细胞与CD8+ T细胞的比值升高通常与许多癌症类型抗PD-1治疗后的预后不良有关。此外,最近的研究表明,在B16黑色素瘤肿瘤模型中,肿瘤内Treg细胞通过IL-10和IL-35的合作促进TILs中的CD8+T细胞衰竭。肿瘤相关巨噬细胞(TAMs)的大量积累也被证明会削弱T细胞介导的抗肿瘤反应,并通过IL-10的产生和PD-L1的表达而促进T细胞衰竭。此外,浆细胞样树突状细胞(dendritic cells, DCs)、未成熟树突状细胞(mature dendritic cells, MDSCs)和骨髓源性抑制细胞(myelid -derived suppressor cells, MDSCs)在TME中表达高水平的PD-L1而低水平的共刺激配体,它们的聚集也可能导致T细胞衰竭。这些免疫调节细胞还通过产生免疫抑制代谢物和消耗免疫支持营养素来抑制T细胞的免疫反应。
2. 营养剥夺
TME中的葡萄糖缺乏主要是由癌细胞消耗葡萄糖增加引起的,在小鼠黑素瘤和肉瘤模型中,研究证实葡萄糖缺乏可以抑制TILs的杀瘤活性。此外,由于DCs、MDSCs和TAMs中精氨酸酶和吲哚胺-吡咯2,3-双加氧酶(IDO)的高表达,氨基酸(如精氨酸和色氨酸)的缺失可能进一步损害代谢适应性,并改TILs的激活和分化程序。从机制上讲,IDO高活性能从TME中消耗色氨酸,从而损害T细胞功能,可能是通过激酶GCN2的激活损害mTOR活性引起的。此外,由色氨酸降解产生的犬尿氨酸通过激活芳香羟基受体而对T细胞免疫具有抑制作用;精氨酸消耗会导致T细胞增殖、细胞因子产生和TCR表达的下降。T细胞的激活被证明也需要大量的蛋氨酸,蛋氨酸作为细胞甲基化过程中甲基群的供体,使T细胞分化所需的表观遗传重编程成为可能。此外,最近的一项研究证明了丝氨酸从头生物合成对T细胞扩增应答细菌感染的重要性。尽管葡萄糖、色氨酸、精氨酸、蛋氨酸和丝氨酸在T细胞激活和效应功能中的重要作用已被证明,但它们在T细胞耗竭中的作用仍未确定。有趣的是,在慢性LCMV感染过程中,PD-1信号被证明可以阻断有氧糖酵解,并诱导病毒抗原特异性的CD8+T细胞代谢损伤表型。此外,来自乙型肝炎病毒(HBV)、丙型肝炎病毒或艾滋病毒感染患者的病毒抗原特异性耗竭型CD8+ T细胞表现出代谢适应度下降。总之,这些发现表明营养剥夺可能导致肿瘤和慢性病毒感染中的T细胞出现耗竭。
除了营养外,在慢性感染和肿瘤中,缺氧或假性缺氧引起的低氧是另一个抑制T细胞功能的关键因素。缺氧诱导因子(HIF)是缺氧反应的关键因子,在缺氧和脯氨酸羟化酶失活的情况下被激活。有趣的是,在慢性LCMV感染和黑色素瘤肿瘤中,HIF信号是诱导糖酵解所必需的,这被认为是一种效应特征。例如,在慢性感染期间激活HIF会导致T细胞过度激活,而在肺癌和黑色素瘤中从T细胞中删除HIF则会损害肿瘤诱导T细胞的活性,并导致T细胞激活表型的减少。有趣的是,在肿瘤模型中,如黑色素瘤和结肠癌,通过操纵肿瘤细胞的氧化代谢来降低缺氧可以改善T细胞的功能。有报道称肿瘤耗氧量升高与T细胞衰竭和受抑的免疫反应有关。然而也有报道称,缺氧会增加共抑制受体的表达并抑制T细胞效应功能。这种差异可能是由缺氧持续时间、所使用的遗传小鼠模型和培养条件中的营养物质造成的,这些因素在很大程度上影响了T细胞代谢适应的结果。因此,未来的研究需阐明缺氧反应在CD8+ T细胞耗竭和分化程序中的作用。
3. 有害的代谢物
癌症细胞的高有氧糖酵解伴随着乳酸分泌的增多,导致TME内乳酸富集,而细胞外高乳酸水平已经被证明通过未知的机制阻碍T细胞的增殖和功能。鉴于乳酸可以通过乳酸脱氢酶B生成丙酮酸和NADH,乳酸转化为丙酮酸引起的丙酮酸生成失衡和NADH/NAD+比值升高可能会阻碍有氧糖酵解,从而破坏T细胞的增殖和效应功能。然而,乳酸诱导的代谢转变是否会导致T细胞耗竭仍未知。此外,TME是一种富含脂质的微环境,这是由于癌细胞中旺盛的新生脂肪酸合成活性以及脂肪细胞和脂肪细胞样成纤维细胞的积累。据报道,这些肿瘤相关脂质可调节各种细胞类型的免疫抑制特征,包括TAMs、MDSCs和DCs。此外,近期有研究报道,非小细胞肺癌患者TILs中PD-1highCD8+T细胞的脂质含量高于PD-1lowCD8+T细胞,提示脂质代谢可能导致T细胞耗竭。支持这种假说的是,在B16黑素瘤模型中T细胞衰竭被证实是ER(内质网)应激反应激活导致CD8+T细胞中胆固醇摄取异常增加所驱动的。但也有报道称,CD8+T细胞的浆膜胆固醇水平升高,使TCR聚集增加,从而促进免疫突触形成。抑制胆固醇酯化增强了T细胞效应功能和抗肿瘤反应,从而突出了胆固醇在T细胞免疫中的有利作用。此外,促进脂质分解代谢可显著提高CD8+ TILs在小鼠黑色素瘤模型中的效应功能和肿瘤的杀伤活性;因此,脂质积累和分解代谢可能调节不同的T细胞抗肿瘤反应。有趣的是,在坏死细胞引起的TME中,高水平的细胞外钾已被证明会阻碍效应功能和CD8+TILs中的PI3K-Akt-mTOR信号。出乎意料的是,肿瘤间质液中升高的钾水平可能会促进TILs获得干细胞特性,进而通过促进自噬、独特的代谢程序和调控衰竭和效应功能的基因组位点组蛋白乙酰化的降低来保护CD8+TILs的抗肿瘤能力。除了钾,在B16F10黑色素瘤模型中,金属硫蛋白(调节细胞内锌代谢和某些锌指转录因子,如GATA-3和IKZF2)的表达被发现在单核细胞洗脱时功能失调的CD8+ TILs中上调。此外,基因靶向GATA-3可能通过增加细胞因子的产生来提高抗肿瘤活性,这表明锌在T细胞中的代谢可能也协调了分化程序和消耗程序。这些发现表明,特异性微环境应激可能引导T细胞的分化,并刺激T细胞的充分激活,从而通过迫使肿瘤特异性T细胞向干细胞样T细胞分化,从而保持其抗肿瘤能力。
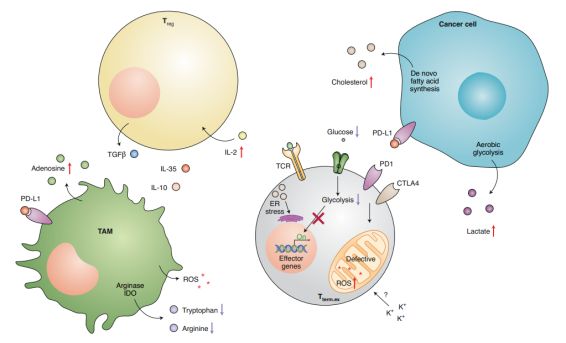
图2. 微环境的挑战偏转T细胞分化和耗竭
耗竭型T细胞中的表观遗传学重组
虽然终末期耗竭型T细胞表达大量的PD-1,但由于固定的表观遗传学特征,PD-1阻断治疗只部分增加TCR信号,并不能引起持久的效应功能;因此,PD-1阻断治疗可能无法完全重新激活终末耗竭型T细胞,或通过将耗竭型T细胞转化为记忆T细胞提供持久的抗肿瘤反应。有趣的是,CD8+ TILs的染色质结构在T细胞耗竭的发展过程中逐渐改变。同样,对慢性LCMV感染后耗竭的T细胞染色质的易及性检测表明,耗竭的T细胞显示出与效应T细胞和记忆T细胞不同的染色质表型;这些发现表明:耗竭是一种特定的T细胞的命运,且与染色质表型的明显变化有关。
最近的研究表明,DNA结合蛋白TOX对T细胞耗竭的发展至关重要,并参与慢性病毒感染和肿瘤中的T细胞耗竭过程中发生的表观遗传重塑。研究表明,在急性LCMV感染期间,对病毒特异性CD8+ T细胞的TOX删除并不能阻止效应T细胞和记忆T细胞的形成;然而,在慢性LCMV感染和肿瘤的情况下,TOX缺陷确实与CD8+ T细胞更好的抗病毒和抗肿瘤活性,以及抑制受体的表达减少相关。但是,在慢性病毒感染和肿瘤发展过程中,TOX缺陷的CD8+ T细胞不能存活,这表明,在长期暴露于抗原的情况下,TOX介导的信号和表观遗传程序对于维持耗竭型T细胞的生存是必要的。除TOX外,核受体转录因子NR4a已被证明通过协调CD8+ TILs和嵌合抗原受体(CAR) T细胞中耗竭相关的表观遗传和转录组学变化来驱动T细胞耗竭。在肿瘤特异性CD8+ T细胞和CAR - T细胞的过继细胞转输中,NR4a的缺失提高了T细胞抗肿瘤活性。有趣的是,在CD8+ TILs中,TOX和NR4a之间的相互调节可能进一步加强耗竭型T细胞的表型和表观遗传学。此外,由DNMT3A酶引起的DNA甲基化在染色质易及性中起着关键作用,也被证明对T细胞耗竭有作用。总的来说,这些发现证明了表观遗传改变在协调T细胞衰竭中的重要性;然而是否其他细胞性的改变,特别是代谢不足和应激反应,是导致T细胞耗竭的表观遗传重编程所必需的,尚需进一步研究。
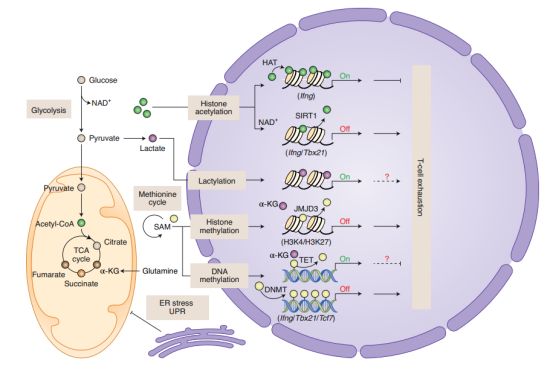
图3. 耗竭型T细胞中的代谢改变与表观遗传学的交互作用
线粒体适应性与耗竭型T细胞
TCR激活能引起线粒体动力学改变以适应效应T细胞的生物能需求,还导致ER中蛋白质合成和钙穿梭的显著升高。为什么耗竭型T细胞会导致线粒体适应性下降和内质网持续压力,以及这些缺陷是否会协调T细胞衰竭的表型和表观遗传程序,在很大程度上仍不清楚。
线粒体是调节细胞代谢和活动的关键细胞器,已被证明在T细胞激活过程中被动态调节。来自慢性病毒感染和肿瘤的耗竭型T细胞表现出代谢不足,包括葡萄糖摄取和OXPHOS降低。此外,CD8+ TILs已被证明由于支持线粒体生物发生和抗氧化反应中起关键作用的转录共激活体PGC1α的表达减少而失去线粒体活性和生物发生(biogenesis)的能力。在B16小鼠肿瘤模型中,肿瘤特异性CD8+ T细胞中过表达PGC1α可增加线粒体的生物发生(biogenesis)并维持效应功能。同样,来自慢性肾性LCMV感染小鼠的早期激活的LCMV特异性CD8+ T细胞含有去极化线粒体,阻碍T细胞的代谢适应。在病毒感染背景下,在LCMV特异性CD8+ T细胞中过表达PGC1α可导致耗竭表型的降低,以及早期激活的LCMV特异性CD8+ T细胞中线粒体功能障碍的缓解和代谢适应改善。除了PGC1α,最近一项使用CRISPR-Cas9突变筛选的体内研究表明,通过靶向核糖核酸酶REGNASE-1, CD8+ T细胞增殖为长效效应细胞,并改善了线粒体适应度和抗肿瘤反应。为了支持这些发现,人类研究表明,HBV感染患者的CD8+ T细胞衰竭后,编码线粒体蛋白和线粒体生物发生调节因子的基因表达也大幅下降,并含有更多的去极化线粒体。去极化线粒体的积累导致线粒体活性氧(mtROS)的大量产生,从而对T细胞效应功能产生正反两方面的影响。在同一项研究中,发现mtROS清除可有效恢复HBV特异性衰竭T细胞的效应和抗病毒反应。mtROS的衰减也使人肾细胞癌患者的CD8+ TILs恢复效应功能,类似于HBV20患者T细胞耗竭的观察结果。此外,我们最近发现,去极化线粒体在CD8+ TILs中逐渐积累,TILs中大量去极化线粒体积累显示出终末期耗竭型T细胞特征,包括效应功能下降,表观遗传学改变和TCF-1表达下调。
肿瘤细胞线粒体是肿瘤代谢物2-羟戊二酸(2HG)的来源,主要通过变异的异柠檬酸脱氢酶IDH1和IDH2产生(R)-2HG。有趣的是,激活后T细胞可以在生理条件下产生对映体(S)-2HG,包括TCR触发或缺氧。(S)-2HG具有通过调节组蛋白和DNA去甲基化而改变T细胞分化的潜力,它的产生已被证明是由乳酸脱氢酶A (LDHA)转化谷氨酰胺衍生的α-酮戊二酸(α-KG)的结果。此外,T细胞摄取(R)-2HG扰乱了多胺的生物合成和转录因子NFAT97的转录活性。尽管来自肿瘤或慢性感染的耗竭型T细胞的发育过程不同,耗竭型T细胞不仅共享一个核心分子程序,而且表现出类似的代谢表型,如糖酵解活性和OXPHOS降低,以及线粒体适应性减弱。这些代谢表型可能是由肿瘤和慢性感染之间的不同环境信号触发的。例如,在肿瘤中发现糖酵解活性下降,因为TME中葡萄糖(糖酵解的必要营养物质)被剥夺,从而限制了TILs的能量生产和效应功能;在慢性感染中,强大的PD-1信号强烈抑制糖酵解,在病毒特异性衰竭T细胞中产生一种葡萄糖剥夺样状态。结合来自肿瘤和慢性病毒感染的T细胞中HIF信号的激活, T细胞可能经历不适当的代谢重编程,引发线粒体功能障碍,从而在两种模型中提供了T细胞耗竭和代谢不良之间的科学联系。这些发现表明了线粒体的质量以及潜在的线粒体活动,在协调T细胞的功能和命运的过程中的重要性。在此背景下,线粒体代谢的调节可能会在上促进TILs应对TME代谢应激的能力,进一步提高耗竭型T细胞的抗肿瘤活性。
内质网压力与T细胞耗竭
内质网拥有复杂的机制,可以感知由错误折叠和折叠蛋白以及生理和病理刺激(如葡萄糖剥夺)引起的压力。由于未折叠和错误折叠蛋白的积累,内质网应激诱导后,伴侣蛋白BiP与激酶PERK1、应激传感器IRE1α和转录因子ATF6分离,并结合内质网未折叠蛋白。这种解离导致PERK1, IRE1α和ATF6的激活,包括PERK1和IRE1α的二聚和自磷酸化,以及ATF6的切割,从而触发下游转录事件的生成调节转录因子XBP1和CHOP。虽然已知这一系列的蛋白反应可以调节T细胞的发育、稳态、激活和功能,但内质网应激是否也会影响T细胞在慢性病毒感染或TME中遇到应激时衰竭的形成,目前尚不清楚。研究表明,在急性LCMV感染期间,病毒特异性CD8+ T细胞中XBP1的丢失导致KLRG1hiCD127lo短寿命效应细胞亚群的减少。出乎意料的是,最近的一项研究表明,TILs中葡萄糖摄取和蛋白糖基化的降低诱导IRE1α-XBP1信号轴,从而抑制小鼠和人类卵巢癌中T细胞线粒体活性和抗肿瘤免疫。除了糖酵解和蛋白糖基化损伤外,胆固醇超载在CD8+ TILs中是触发内质网应激和XBP1表达的另一机制,这反过来进一步刺激B16肿瘤模型中抑制性受体的表达,包括PD-1和自然杀伤细胞受体2B4。此外,在TILs中,PERK-CHOP信号轴升高;CHOP通过阻碍细胞因子INF-γ的生成直接抑制转录因子Tbx21的表达,这是T细胞效应功能的关键调节因子。总的来说,异常的代谢程序和代谢不足诱导内质网应激,从而触发T细胞耗竭的发生。然而,内质网应激诱导的T细胞衰竭是否会导致表观遗传重组,从而促进T细胞永久性功能障碍,以及内质网应激反应是否会在慢性病毒感染期间驱动T细胞衰竭,目前尚不清楚。
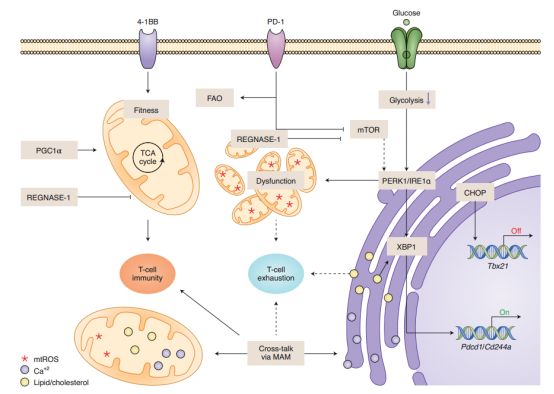
图4 线粒体和内质网相关信号在耗竭型T细胞中的作用
免疫检查点对线粒体动力学和内质网应激反应的影响
如前所述,ER相关和线粒体相关的细胞反应与T细胞免疫和T细胞耗竭的发展密切相关。新的证据也表明,免疫检查点参与触发代谢程序、线粒体动力学和内质网应激反应的变化。例如,PD-1信号抑制糖酵解,但促进脂肪酸在CD8+ T细胞中的利用;然而,PD-1信号通路也通过抑制线粒体适应度来抑制CD8+ T细胞中的OXPHOS。此外,在慢性LCMV感染期间CD8+ T细胞中PD-1的丢失增加了LCMV特异性CD8+ T细胞的葡萄糖摄取并改善了线粒体功能障碍。此外,PD -1刺激的T细胞已经被证明可以减少线粒体嵴的数量和长度,从而导致线粒体功能障碍。PD -1诱导的线粒体功能障碍可能是转录调节因子Bhlhe40下调的结果,而Bhlhe40对于维持B16黑色素瘤模型中TILs的线粒体适应度和活跃的染色质结构至关重要。与PD-1信号通路在增加脂肪酸氧化中的作用相一致,PD-1阻断剂与过氧化物酶体增殖剂激活受体的拮抗剂联合使用,能够改善MC38结肠癌模型的CD8+ TILs线粒体健康和氧化代谢,促进肿瘤控制。与PD-1相对应的,受体4-1BB(也在耗竭型T细胞上高表达)增强了线粒体能力,改善了代谢充分性。在PD-1和4-1BB信号通路控制的代谢调节的基础上,联合PD-1阻断和4-1BB靶向治疗已被证明能在B16黑色素瘤模型中诱发强大的抗肿瘤T细胞免疫。然而,肿瘤环境中的有效营养和TILs的代谢重组编程是否是产生有效免疫检查阻断治疗所必需的仍有探索。
“论肿道麻”述评
本文阐述了T细胞代谢在肿瘤和慢性感染中的变化,总结了目前关于T细胞耗竭发生机制的研究,探讨了T细胞衰竭、代谢适应性和表观遗传调控之间的关系,并强调了如何通过代谢调节使耗竭的T细胞恢复活力来获得更好的抗肿瘤和抗病毒免疫能力。在免疫检查点阻断治疗(ICB)中,PD-1的作用对一部分肿瘤患者来说确实表现出良好持久的肿瘤抑制作用,然而,仍有相当一部分患者对治疗没有反应或是最终复发,这里面部分原因就在于终末期耗竭型T细胞的形成。因此,开发新的治疗方法,提高疗效,恢复耗竭型T细胞的抗肿瘤活性,增加耗竭型T细胞祖细胞的形成,是目前免疫治疗的一个重要方向。综上所述,直接重塑T细胞代谢程序,以及提高T细胞线粒体适应性,均可以促进耗竭型T细胞重获效应功能,增加细胞对PD-1阻断治疗的反应性。此外,以影响T细胞表观基因组的代谢程序为治疗靶点等方法调节T细胞的表观遗传背景以降低抑制性受体的表达,同时增加效应分子产生的治疗也将是无价之宝。
在慢性病毒感染和肿瘤发展过程中,失调的代谢程序和应激反应导致了T细胞免疫功能受损,成为了这些疾病免疫治疗失效的重要原因。了解在T细胞衰竭的发展过程中,失调的代谢程序和应激反应协调信号和表观遗传改变的机制,将为了解T细胞分化中的免疫代谢调节开辟新的视野。了解这些未被探索的联系有潜力揭示新的治疗策略,以重新激活耗竭型T细胞和改善当前ICB治疗的临床结果有着重要的意义。另外,控制T细胞耗竭的代谢调节通路可能与慢性病毒感染、营养过剩以及微生物产生的代谢物引起的全身代谢改变相互交织。因此,在未来几年,随着代谢调节和干预对T细胞免疫的影响,这方面的知识有望得到有力的扩展,这必将为未来的免疫治疗提供关键性的指导和方向。
编译:周文昌;述评:翁梅琳 审校:张军,缪长虹
参考文献: Franco Fabien,Jaccard Alison,Romero Pedro,Yu Yi Ru,Ho Ping Chih. Metabolic and epigenetic regulation of T-cell exhaustion[J]. Nature Metabolism,2020,2(10):
声明:古麻今醉为舒医汇旗下,古麻今醉所发表内容之知识产权为舒医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
Nature:燃脂减肥新方向,首次发现糖原代谢调控脂肪细胞产热和能量消耗
燃脂减肥新方向,首次发现糖原代谢调控脂肪细胞产热和能量消耗
Nature Metabolism
Nature综述:饮食调整助力癌症治疗
代谢健康肥胖:从流行病学、机制到临床意义
《Cell》新综述:年轻的NK免疫细胞有望延缓衰老过程,治疗年龄相关疾病
《Nature》深度综述:最具前景的抗衰老物质盘点
第九章 物质代谢调节(Regulation in Metabolism)
靶向代谢治疗,推动免疫治疗革命
遗传、表观遗传和环境因素与孤独症的关系
网址: Nature Metabolism综述:T细胞耗竭的代谢和表观遗传学调控 https://www.trfsz.com/newsview236570.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3820
- 2男女激情后不宜做哪些事 3682
- 3早上怎么喝水最健康? 3618
- 4习惯造就健康 影响健康的习惯 3277
- 5五大原因危害女性健康 如何保 3172
- 6连花清瘟、布洛芬等多款感冒药 2948
- 7男子喝水喉咙里像放了刀子一样 2451
- 810人混检核酸几天出结果?1 2216
- 9第二轮新冠疫情要来了?疾控中 2211
- 10转阴多久没有传染性?满足四个 2153






