肠道核心菌属——普拉梭菌,预防炎症的下一代益生菌

Faecalibacterium prausnitzii(F. prausnitzii),普氏栖粪杆菌,又名:普拉梭菌,是人类肠道菌群中最重要的细菌之一,占健康人粪便样本中检测到的细菌总数的 5-15%,是丁酸的重要生产者之一,具有抗炎作用,维持细菌酶的活性,保护消化系统免受肠道病原体的侵害。
已经证实,患有慢性便秘、乳糜泻、肠易激综合征和炎症性肠病(包括克罗恩病和溃疡性结肠炎)的个体中这种微生物的数量减少。此外,在 2 型糖尿病、结直肠癌和银屑病患者中观察到较低水平的F. prausnitzii。
F. prausnitzii 数量的变化可能是人类肠道菌群失调的迹象,科学家们将其视为下一代益生菌的候选者。
01
简 介
Faecalibacterium prausnitzii,革兰氏阴性,对氧极度敏感,是柔嫩梭菌类群的优势菌,属于梭菌科,厚壁菌门。该物种属于Clostridium cluster IV分组的Clostridium leptum group柔嫩梭菌类群,是该类群的最优势菌种,占64%左右。一般中文翻译柔嫩梭菌指的就是这个类群,其代表物种就是普氏栖粪杆菌,又名普拉梭菌。
普拉梭菌的扫描电子显微镜图像
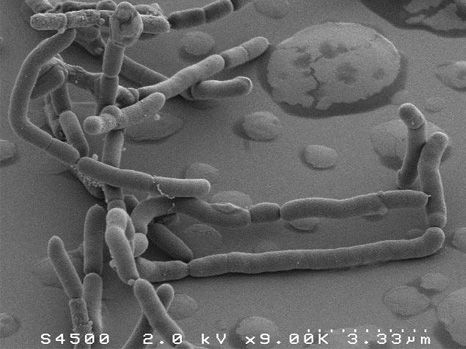
Plateforme MIMA 2, T. Meylheuc
直到 2000 年代中期,16S rRNA 文库的高通量测序和粪便 DNA 的宏基因组分析显示F. prausnitzii是人类肠道中最丰富的细菌之一,人们才完全意识到该物种对人类健康的重要性细菌总数的 5–15%。
在婴儿早期,Faecalibacterium prausnitzii 的数量非常低,并在原定殖细菌建立后增加。同时,在克罗恩病 (CD)和溃疡性结肠炎 (UC) 等各种炎症性肠病 (IBD) 以及结直肠癌 (CRC) 和 2 型糖尿病中观察到 F. prausnitzii 水平降低。
F. prausnitzii 生长繁殖肠道理化调节
pH值
F. prausnitzii 生长的最佳 pH 值范围在 5.7 和 6.7 之间,这是在结肠中发现的 pH 值范围。尽管在 5-5.7 的 pH 值范围内菌株之间的耐受性存在差异,但在 3.5 和 4.5 的 pH 值之间没有观察到生长。这表明 pH 值影响F. prausnitzii 沿肠道的分布。
该菌在健康受试者和肠道疾病患者的十二指肠(pH 范围 5.7-6.4)和回肠末端中也被检测到。据报道,溃疡性结肠炎和克罗恩病患者经常出现酸性大便,因此仍有待证明肠道局部 pH 值是否会调节F.prausnitzii 在肠道疾病(如 IBD)患者中的丰度和组成。
胆汁浓度
F. prausnitzii 对胆汁盐生理浓度的轻微增加也高度敏感,这为克罗恩病患者表现出的F. prausnitzii丰度减少提供了一个合理的解释,因为这些患者的胆红素浓度增加,尤其是那些有回肠疾病受累和接受过肠切除术的患者。
此外,据报道,分离株之间的耐受性存在差异,尤其是胆盐浓度为 0.1% (wt/vol) 时,表明胆汁盐浓度的变化可能决定F. prausnitzii亚型组成的变化。由于克罗恩病患者的胆盐成分也发生改变,需要进一步研究以确定F. prausnitzii是否对某些类型的胆盐成分具有更高的敏感性,并确定不同的胆汁盐谱是否会改变 F. prausnitzii 亚型组成。
氧气
F. prausnitzii对氧极为敏感,但它能够通过在黄素和半胱氨酸或谷胱甘肽存在的情况下使用细胞外电子转移来承受肠粘膜中发现的低水平氧气 。最近,已经证明,当与这些抗氧化剂和菊粉作为冷冻保护剂一起配制时,菌株 A2-165 可以在环境空气中保持活力 24 小时。因为氧气梯度在定义结肠中微生物的空间组织方面具有重要作用,确定F. prausnitzii亚型之间的氧耐受性是否存在差异,以及它是否与粘膜的发炎状态相关,将会很有趣。
营养素
F. prausnitzii的必需营养素的可用性和有效性可能会影响其在肠道中的分布。
F. prausnitzii的全局营养需求已经通过人工策划的代谢重建进行了调查,该重建确定了几种氨基酸和维生素作为生长因子。体外实验表明,F. prausnitzii可以通过代谢交叉喂养直接或间接地代谢纤维。乙酸盐消耗是F. prausnitzii生产丁酸盐的主要驱动力。当这两个物种在低聚果糖上一起生长时,青春双歧杆菌释放的醋酸盐的消耗已被证明会刺激F. prausnitzii。F. prausnitzii可以代谢来自宿主和饮食来源的底物,菌株之间存在一些差异。
F. prausnitzii分离株可以使用简单碳水化合物生长良好,但菌株之间在发酵更复杂碳水化合物的能力方面存在一些差异,例如那些来自宿主或饮食的碳水化合物,尽管大多数F. prausnitzii菌株都能够发酵菊粉,但研究结果表明,其中只有两种菌株可以在该基质上生长良好。这支持观察到该益生元在营养干预中对该物种的刺激,并表明只有F. prausnitzii种群的一些成员受到菊粉的选择性刺激。
该物种的菌株利用肠腔中发现的其他多糖的能力有限,例如阿拉伯半乳聚糖、木聚糖和可溶性淀粉。大多数分离株可以在苹果果胶上生长,并且能够使用一些果胶衍生物。体外研究表明,在生理条件下,F. prausnitzii可以在某些类型的果胶发酵中发挥关键作用,并且可以与其他肠道细菌成功竞争这种底物。
最近一项基于普拉梭菌 A2-165菌株功能代谢图的研究预测其无法合成氨基酸丙氨酸、半胱氨酸、蛋氨酸、丝氨酸和色氨酸。通过对其他F. prausnitzii菌株基因组的进一步分析,已经观察到维生素和辅助因子(例如:生物素、叶酸、烟酸、泛酸、吡哆醇和硫胺素)的营养缺陷型,并且菌株之间似乎存在与核黄素生产有关的一些差异,这可能是由于菌株间差异。
相比之下,该物种已被预测为钴胺素生产者。有证据表明,一些 IBD 患者易患钴胺素缺乏症,但尚未确定这种情况的原因。由于缺乏一致的临床数据表明 IBD 患者易患这种缺陷,因此确定它是否与肠道中钴胺素生产者的消耗有关会很有价值。
F. prausnitzii与肠道微生物群其他成员的关系
F. prausnitzii在肠道中与C. coccoides组和 Bacteroidetes 的几个成员共同发生。有人提出F. prausnitzii可能依赖其他物种(如拟杆菌)进行交叉饲养。在共培养实验中,观察到F. prausnitzii 的发酵活动过程中,多形拟杆菌(B. thetaiotaomicron)正在发酵果胶。表明后者产生的乙酸盐促进了F. prausnitzii 的生长。此外,B. thetaiotaomicron对果胶的初始发酵可以释放果胶衍生物,然后可以被F. prausnitzii使用。
最近对大鼠模型的研究表明,F.prausnitzii 需要预先存在后,B.thetaiotaomicron才能在肠道定植。已经反复观察到无法维持F. prausnitzii单相关动物模型 并且还描述了一种小鼠模型,其中F. prausnitzii植入胃肠道需要用大肠杆菌预先制备,表明F. prausnitzii和其他菌群存在密切关系。在 IBD 患者中发现了这两种物种之间的相关性,根据疾病位置观察到正相关或负相关。这表明一个种群对另一个种群的影响,尽管还不能排除宿主因素的影响。
F. prausnitzii 的分类学和系统发育
已经确定Faecalibacterium属与厚壁菌门、梭菌类和瘤胃球菌科中的梭菌群 IV的成员有关。目前,F. prausnitzii是唯一成功分离的粪杆菌属物种。
F. prausnitzii种内多样性
最近对分离株的系统发育表征确定该物种包括两个系统发育群,它们具有 97% 的 16S rRNA 基因序列相似性。其中分类群 I 的减少是肠道炎症的更敏感标志物。迄今为止,大部分可用的基因组和生理数据是使用分类群 II 菌株收集的。
F. prausnitzii基因组之间的平均核苷酸同一性水平非常低,而基因组的可塑性却很高。两个基因组可以根据功能基因互补的差异进行分离,尽管这种划分与基于保守基因系统发育的分离不完全一致,突出了水平基因转移在塑造F. prausnitzii 中的重要性基因组。两个基因组之间的差异主要在于与碳水化合物分解代谢相关的基因(例如分类群 I中预测的唾液酸酶基因)和氨基酸的互补,以及防御机制。
值得注意的是,最近对健康和患病肠道样本中物种多样性和丰度的研究表明,存在其他F. prausnitzii系统发育型,并且不能排除Faecalibacterium属内其他物种的存在。这些已经通过分析粪便样本中总体细菌群落的分子方法估计,代表大约 2% 的粪杆菌序列,并使用物种特异性引物。有趣的是,罕见的系统发育型主要是从患有肠道疾病的受试者身上发现的。
02
F. prausnitzii 的健康益处
产生丁酸,维持肠道稳态
Faecalibacterium prausnitzii 一直被报道为肠道中发现的主要丁酸盐生产者之一。丁酸盐在肠道生理学和宿主健康中起着至关重要的作用。丁酸盐结肠细胞的主要能量来源之一,能够保持肠道内壁的完整性,防止病原体通过肠道进入人体。它刺激绒毛的生长 (肠道屏障上的微观挤压)并促进粘蛋白的产生,粘蛋白是一种覆盖肠道内壁的保护性凝胶。此外,丁酸盐通过增加紧密连接蛋白的合成和抗菌肽的产生来参与结肠屏障的增强。
肠道屏障依赖于 T 连接蛋白来防止肠道内容物泄漏到血液中。丁酸盐通过激活 AMP 活化蛋白激酶 (AMPK) 来促进紧密结合的 T 连接蛋白。
丁酸盐可以通过调节肠腔 pH 值来调节肠道微生物群,这对产生短链脂肪酸的细菌有益,丁酸盐可以保持上皮缺氧并限制硝酸盐呼吸依赖性细菌的过度生长以维持肠道稳态。
丁酸盐是由某些细菌在乳酸发酵过程中产生的。然而,乳酸也是硫酸盐还原菌的首选能源,硫酸盐还原菌会产生硫化物并抑制结肠细胞对丁酸的氧化。IBD 中产生丁酸盐的菌的消耗可能会削弱已经脆弱的肠上皮细胞,导致共生或低致病性细菌的入侵,随后激活免疫活性细胞。
产生丁酸,抗炎抗肿瘤
丁酸盐可以通过抑制 NF-κB 转录因子激活、上调 PPARγ和抑制干扰素γ来减轻肠黏膜炎症。
此外,F. prausnitzii已被证明可以产生许多具有抗炎特性的物质,包括一种 15 kDa 的蛋白质“微生物抗炎分子”(MAM),它能够抑制肠上皮中的 NF-κB 通路细胞和预防小鼠 IBD 模型中的结肠炎 。而且,丁酸盐可能通过抑制组蛋白脱乙酰酶活性来抑制炎症反应,导致组蛋白过度乙酰化和抑制 NF-κB 活性。
Faecalibacterium prausnitzii 上清液已被证明可以抑制促炎性 IL-8 免疫蛋白的产生。
F. prausnitzii 还通过激活产生 IL-10(一种抗炎蛋白)的 T 细胞来帮助对抗炎症。
F. prausnitzii的抗炎机制
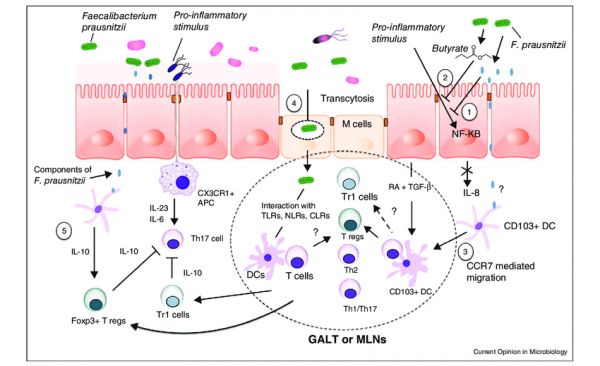
额外的抗炎特性归因于该菌还通过其诱导耐受性细胞因子谱的能力(促炎细胞因子如 IL-12 和 IFN-γ 的分泌非常低,而抗炎细胞因子 IL-10 的分泌增加)。这些抗炎作用部分与能够阻断 NF-κB 激活、IL-8 产生和调节性 T 细胞产生上调的分泌代谢物有关。
这些微生物可以产生莽草酸,一种常见于植物中的酸,能够防止脂多糖 (LPS) 引起的炎症。LPS 是一些细菌外膜上的毒素,可以激活免疫系统并引起炎症。F. prausnitzii 还可以制造水杨酸,这有助于防止细菌形成生物膜,这是一些引起感染的微生物的常见特征。
体外研究表明,丁酸盐还具有抗肿瘤作用,包括减少肠上皮细胞中肿瘤坏死因子 (TNF) 的分泌,并诱导肿瘤细胞的分化和凋亡,从而抑制肿瘤生长。
F. prausnitzii 及其代谢物对小鼠结肠炎发挥保护作用,改善了肠道菌群失调,增加了细菌多样性和产生短链脂肪酸菌的丰度,降低了血清 TNF-α 和Proteinbacteria,酸杆菌门和拟杆菌。这些发现将为F. prausnitzii 的抗炎抗肿瘤作用提供进一步的证据,其具有治疗 IBD 的潜力。

下一代益生菌特性
大多数商业益生菌不包括有益健康的优势肠道微生物菌株,这就是为什么这些益生菌菌株不会在人类肠道中定殖并且它们的作用仅在很短的时间内持续存在的原因。如今,人们对使用共生细菌作为潜在的益生菌剂越来越感兴趣。
使用厌氧细菌和 EOS(氧敏感) 细菌是成功分离可能影响肠道稳态的代表性菌株的先决条件。Faecalibacterium prausnitzii从健康志愿者分离株:F. prausnitzii作为新一代益生菌在使用中向前迈进了一步。
但是下一代共生益生菌必须满足与传统益生菌相同的标准。它们应该:
(i) 被隔离和充分表征
(ii) 达到安全要求,例如可接受的抗生素抗性或缺乏裂解和粘附能力
(iii) 作为益生菌考虑,在被隔离之前对宿主表现出有益的影响
关于F. prausnitzii,虽然对其安全性知之甚少,但该物种作为下一代益生菌具有明显的潜力。到目前为止,所有F. prausnitzii分离株具有一些特征,例如:
(i) 缺乏上皮细胞粘附、质粒、抗微生物和溶血活性
(ii) 存在 DNAse 活性。部分的F. prausnitzii菌株产生的 D-乳酸微弱,不会对宿主产生代谢有害影响,无法降解黏蛋白。
仅使用参考菌株F. prausnitzii A2-165在体外和体内分析了其有益的抗炎作用和生物膜形成菌株 HTF-F。由于益生菌特性通常是菌株特异性的,需要单独研究来评估其他F. prausnitzii分离菌株的抗炎特性。
03
与人体疾病有关
人体微生物组中 F. prausnitzii 的丰度受其健康状况和结肠环境的影响。这一点尤其重要,因为在患有消化系统疾病的患者中发现了低于平均水平的F. prausnitzii。
克罗恩病和溃疡性结肠炎
肠道微生物群可能通过两种机制驱动致病性,即“促炎”菌群的扩张或微生物群保护性化合物的限制。
健康肠道和IBD患者中 F. prausnitzii
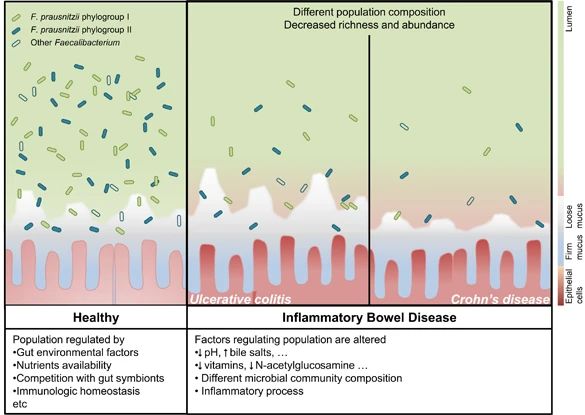
在IBD患者中,肠道环境的改变可能会影响F. prausnitzii 的种群组成和负荷。这些差异可以通过监测来鉴别IBD亚型。
在过去的十年的研究已发现,相当数量的降低的F. prausnitzii水平与某些形式的IBD相关。虽然F. prausnitzii水平与溃疡性结肠炎活动和隐窝炎之间的联系是有争议的,在克罗恩病中F. prausnitzii枯竭,尤其是在疾病发作和克罗恩病的回肠部位。
◥ 治疗后F. prausnitzii恢复
在粪便和活检样本中使用的各种证明方法表明,对克罗恩病患者有效的各种抗炎和抗菌治疗,包括大剂量皮质醇、英夫利昔单抗、干扰素-α2b 和利福昔明,都能够恢复正常水平的F. prausnitzii。
因此,有人提出F. prausnitzii的消耗不是克罗恩病的致病事件,而是产生过量活性氧 (ROS) 的粘膜炎症的结果。这导致粘膜相关和管腔 EOS 培养物显着减少,包括F. prausnitzii。
如何解释Faecalibacterium prausnitzii在溃疡性结肠炎和克罗恩病患者中减少?
◥ pH值
健康的肠道 pH 值 (5.7–6.7) 为 F. prausnitzii 的生长提供了最佳条件,而高酸性环境会抑制 Faecalibacterium prausnitzii 的生长。尤其是,溃疡性结肠炎和克罗恩病患者的大便呈酸性,这可能有助于解释为什么他们的微生物群中缺乏 F. prausnitzii .
◥ 胆汁
胆汁及其成分水平略微升高也会影响 F. prausnitzii 丰度。胆汁是肝脏分泌的一种物质,可在消化过程中分解脂肪。胆汁盐已被证明可以抑制 Faecalibacterium prausnitzii。
研究人员假设这种对胆汁的敏感性可以解释为什么这些微生物在克罗恩病患者中较少。患有这种炎症性疾病的人往往有较高水平的胆红素,胆红素是一种赋予胆汁颜色的色素,特别是如果他们已经切除了部分肠道。
溃疡性结肠炎中, F. prausnitzii有缺陷的肠道定植,这在缓解期短、既往有频繁复发史和结肠炎大范围扩展的患者中更为严重。此外,复发后,F. prausnitzii在维持缓解时逐渐恢复,1年后达到接近参考种群的值。
基于F. prausnitzii菌株特性的治疗探索
科学研究人员提出假设,即F. prausnitzii 的高定植可能会阻止溃疡性结肠炎中粘膜炎症过程的重新激活。这一假设应在未来的研究和增加肠道F. prausnitzii 的策略中得到证实需要在患有广泛疾病的患者中对人群进行验证。
F. prausnitzii菌株还可以利用N-乙酰氨基葡萄糖,一种在肠粘膜中发现的糖蛋白的成分。有趣的是,用这种化合物进行治疗可能会改善克罗恩病,因为它可以作为炎症、受损肠道软组织的愈合因子。因此,鉴于F. prausnitzii能够发酵这种碳水化合物,探索在接受这种治疗的克罗恩病患者中恢复这种有益肠道细菌的效果将是有意义的。
镇痛特性
慢性腹痛是肠易激综合征或炎症性肠病等肠道疾病患者的常见症状之一。研究人员表明,在炎症性肠病的患者中,肠道中的Faecalibacterium prausnitzii细菌的丰度降低。
这些研究人员已经证明,由于压力动物模型(产生绞痛起源的内脏超敏反应),F. prausnitzii丰度的减少与内脏超敏反应的出现有关。对于人类,这种超敏反应会导致肠道不适或腹痛。
科学家已经证明,通过给这些动物服用F. prausnitzii,它们恢复了正常的绞痛敏感性。
结直肠癌
丁酸盐的抗炎功能包括抗癌特性。这种短链脂肪酸是一种组蛋白脱乙酰酶 (HDAC) 抑制剂:它抑制癌细胞的活性和生命周期。这促使研究人员调查 Faecalibacterium prausnitzii 在结直肠癌中的作用。
结直肠癌患者产丁酸盐的细菌较少,包括Faecalibacterium prausnitzii。有人提出,由于丁酸盐产量较低,肠道内壁细胞可能更容易受到损伤,这可能会增加患癌症的风险。
扩展阅读:结直肠癌防治新策略——微生物群
乳腺癌
F.prausnitzii 通过抑制IL-6/STAT3通路抑制乳腺癌细胞的生长。菌群代谢物与菌群结合(如Faecalibacterium与磷胆碱结合)可能是乳腺癌的一种新的检测方法。
糖尿病
糖尿病是一种代谢性疾病,其中由于胰岛素功能受损,身体失去控制血糖的能力。升高的循环葡萄糖会损害血管并增加患心脏病的风险。
许多针对人类的研究已经确定了肠道微生物组的失衡(生态失调),这会削弱肠道内壁,并使不良分子进入体内,从而破坏其他器官。科学家们认为,生态失调先于并促进了糖尿病的发展。
糖尿病患者的厚壁菌门水平较低,包括 Faecalibacterium prausnitzii 和其他可强化肠道内壁的产丁酸盐细菌。
研究表明,脂多糖是在某些革兰氏阴性细菌上发现的促炎分子,当肠道屏障薄弱时,它会进入血液并损害胰腺中的B 细胞功能,产生胰岛素的细胞。
过敏反应
Faecalibacterium prausnitzii通过调节肠道微生物群和短链脂肪酸的产生来缓解屋尘螨引起的过敏性哮喘。
补充F. prausnitzii可阻断嗜酸性粒细胞、中性粒细胞、淋巴细胞和巨噬细胞的流入,减轻病理变化。此外,活的和死的F. prausnitzii给药都降低了白细胞介素 IL-4、IL-5、IL-13 和免疫球蛋白 G1 的水平,提高了调节性 T 细胞 (Treg) 的比例,改善了微生物生态失调并增强了短链脂肪酸生产。
Faecalibacterium prausnitzii部分通过肠道微生物群调节和短链脂肪酸产生发挥抗哮喘作用,表明其作为预防过敏性哮喘的益生菌剂的潜力。
肝病
研究人员研究了口服F. prausnitzii治疗对高脂肪喂养小鼠的影响。与高脂肪对照小鼠相比,F. prausnitzii处理的小鼠肝脏脂肪含量、天冬氨酸氨基转移酶和丙氨酸氨基转移酶较低,肝脏中脂肪酸氧化和脂联素信号传导增加。肝脏脂质组学分析显示,几种甘油三酯、磷脂和胆固醇酯的含量减少。内脏脂肪组织中的脂联素表达增加,皮下和内脏脂肪组织对胰岛素更敏感。
且F. prausnitzii治疗增加了肌肉质量,这可能与增强线粒体呼吸、改变肠道微生物群组成和改善肠道完整性有关。总的来说,F. prausnitzii治疗可改善肝脏健康,减少小鼠脂肪组织炎症,需要进一步研究以发现其治疗潜力。
其它
肠道菌群中F. prausnitzii的消耗与微生物失调有关,同时伴随着广泛的代谢和/或免疫介导的慢性疾病,包括银屑病、高血压、心脏和肾脏疾病。
在以下患者中已显示低水平的F. prausnitzii:

04
如何补充增加
综上所述,F. prausnitzii 对人体肠道和健康非常重要,以至于它被称为肠道中的“关键物种”。现在问题来了:如何增加肠道中这种细菌的数量?
能否添加到酸奶中补充?
不能。
添加到酸奶中或作为补充剂的典型细菌在暴露于空气(氧气)时能够存活。然而,F. prausnitzii是“氧敏感的”,它们在暴露于空气后几分钟内就会死亡。研究人员将这种有益细菌视为“未来的益生菌”,目前正在进行研究以找出它可以轻松储存并暴露在空气中几个小时而不会死亡的方法。所以目前没有办法服用益生菌F. prausnitzii补充剂。
除此之外还能做什么呢?
饮食。
高动物肉、高动物脂肪、高糖、高度加工食品和低纤维饮食(典型的西化饮食)会降低F. prausnitzii 的数量,而高纤维、低肉的饮食会增加 F. prausnitzii 的数量。
——高纤维
我们可以做的第一个提高 F. prausnitzii 的数量的办法, 就是增加饮食中的纤维。增加膳食纤维会增加丁酸盐,丁酸盐与结肠健康有关,具有抗炎和抗癌作用。
高纤维是包括:全谷物、蔬菜、水果、坚果、种子和豆类。此外,还要主要吃多样化的植物性饮食,也就是说大量的植物性食物。多样性似乎很重要——不同类型的纤维喂养不同的细菌。
——益生元
菊粉型果聚糖和阿拉伯木聚糖等益生元可增加F. prausnitzii的数量。

一项研究表明,猕猴桃胶囊的摄入增加了功能性便秘患者的Faecalibacterium prausnitzii 丰度。
虽然F. prausnitzii可能是肠道中一种重要的有益细菌,但是它与其他有益细菌的关系,它们是交叉喂养的。研究表明青春双歧杆菌是利用菊粉主要物种并刺激Faecalibacterium prausnitzii的增加。
主要参考文献:
Heinken, A., Khan, M. T., Paglia, G., Rodionov, D. A., Harmsen, H. J. M., & Thiele, I. (2014). Functional Metabolic Map of Faecalibacterium prausnitzii, a Beneficial Human Gut Microbe. Journal of Bacteriology, 196(18), 3289–3302. doi:10.1128/jb.01780-14
Rivière, A., Selak, M., Lantin, D., Leroy, F., & De Vuyst, L. (2016). Bifidobacteria and Butyrate-Producing Colon Bacteria: Importance and Strategies for Their Stimulation in the Human Gut. Frontiers in Microbiology, 7. doi:10.3389/fmicb.2016.00979
Lopez-Siles, M., Duncan, S. H., Garcia-Gil, L. J., & Martinez-Medina, M. (2017). Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. The ISME Journal, 11(4), 841–852. doi:10.1038/ismej.2016.176
Moreno-Indias, I., Sánchez-Alcoholado, L., Pérez-Martínez, P., Andrés-Lacueva, C., Cardona, F., Tinahones, F., & Queipo-Ortuño, M. I. (2016). Red wine polyphenols modulate fecal microbiota and reduce markers of the metabolic syndrome in obese patients. Food & Function, 7(4), 1775–1787. doi:10.1039/c5fo00886g
Richardson, D. P., Ansell, J., & Drummond, L. N. (2018). The nutritional and health attributes of kiwifruit: a review. European Journal of Nutrition. doi:10.1007/s00394-018-1627-z
Blatchford, P., Stoklosinski, H., Eady, S., Wallace, A., Butts, C., Gearry, R., … Ansell, J. (2017). Consumption of kiwifruit capsules increases Faecalibacterium prausnitzii abundance in functionally constipated individuals: a randomized controlled human trial. Journal of Nutritional Science, 6. doi:10.1017/jns.2017.52
Lopez-Siles M, Duncan SH, Garcia-Gil LJ, Martinez-Medina M. Faecalibacterium prausnitzii: from microbiology to diagnostics and prognostics. ISME J. 2017 Apr;11(4):841-852. doi: 10.1038/ismej.2016.176. Epub 2017 Jan 3. PMID: 28045459; PMCID: PMC5364359.
Ramirez Farias C, Slezak K, Fuller Z, Duncan A, Holtrop G, Louis P. Effect of inulin on the human gut microbiota: stimulation of Bifidobacterium adolescentis and Faecalibacterium prausnitzii. Br J Nutr. 2009 Feb;101(4):541-50. doi: 10.1017/S0007114508019880. Epub 2008 Jul 1. PMID: 18590586.
Varela E, Manichanh C, Gallart M, Torrejón A, Borruel N, Casellas F, Guarner F, Antolin M. Colonisation by Faecalibacterium prausnitzii and maintenance of clinical remission in patients with ulcerative colitis. Aliment Pharmacol Ther. 2013 Jul;38(2):151-61. doi: 10.1111/apt.12365. Epub 2013 Jun 3. PMID: 23725320.
Munukka, E., Rintala, A., Toivonen, R. et al. Faecalibacterium prausnitzii treatment improves hepatic health and reduces adipose tissue inflammation in high-fat fed mice. ISME J 11, 1667–1679 (2017). doi.org/10.1038/ismej.2017.24
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
肠道菌群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
肠道菌群失调症
谷物调节肠道菌群,促进代谢健康
猫狗肠道菌群—“主子们”的健康新领域
肠道菌群失衡的症状、原因和自然改善
Nature首次证实:节食会改变肠道菌群组成,增加致病菌
辐射威胁:揭示辐射对人体健康和肠道菌群的影响及防护
@所有人:十种科学调节肠道菌群的方式一定要知道
热量控制会改变肠道菌相 助减重关键菌种指向它
Nature:还敢节食减肥吗?节食会打破肠道菌群平衡,增加致病菌
网址: 肠道核心菌属——普拉梭菌,预防炎症的下一代益生菌 https://www.trfsz.com/newsview252088.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3880
- 2早上怎么喝水最健康? 3664
- 3习惯造就健康 影响健康的习惯 3311
- 4五大原因危害女性健康 如何保 3219
- 5连花清瘟、布洛芬等多款感冒药 2975
- 6男子喝水喉咙里像放了刀子一样 2469
- 710人混检核酸几天出结果?1 2233
- 8第二轮新冠疫情要来了?疾控中 2232
- 9转阴多久没有传染性?满足四个 2167
- 10补肾吃什么 补肾最佳食物推荐 2166