全球首款HER2双抗获FDA批准上市,已在国内申报上市

11月20日,Jazz Pharmaceuticals宣布Zanidatamab(商品名:Ziihera)获FDA加速批准上市,用于治疗既往接受过治疗的不可切除或转移性HER2阳性(HER2+,标准为IHC 3+)胆道癌(BTC)成人患者。该药物是第一款获批上市的HER2双抗。此外,。
Zanidatamab是Zymeworks开发的一款HER2双抗。与曲妥珠单抗相比,Zanidatamab在不同HER2过表达的肿瘤细胞类型和不同HER2表达水平下具有更强的体外和体内抗肿瘤活性。来自人类细胞系和动物模型的结果表明,Zanidatamab也可能对HER2低表达的肿瘤具有临床活性。
2018年11月,百济神州与Zymeworks达成协议,获得Zanidatamab和Zanidatamab zovodotin(,)在亚太地区(除了日本)的开发和商业化权益以及Azymetric和EFECT两个技术平台的使用权。2022年10月,Jazz Pharmaceuticals与Zymeworks牵手,。
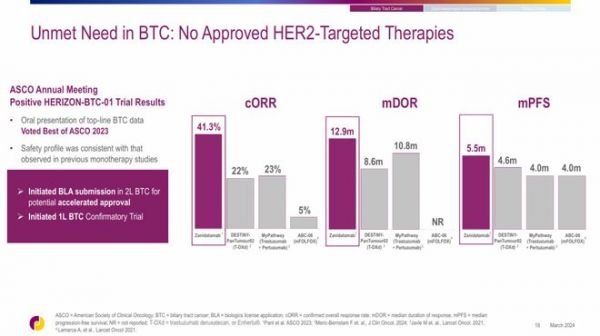
FDA此次批准Zanidatamab上市主要是基于HERIZON-BTC-01研究的积极数据。该研究是一项全球性、开放标签、单臂临床试验,共纳入了87例既往接受过含吉西他滨方案治疗的局部晚期不可切除或转移性HER2扩增BTC患者。研究的主要终点是HER2+队列患者通过独立中心审查(ICR)确认的客观缓解率(cORR)。
Jazz Pharmaceuticals在《Lancet Oncology》上发表的数据显示,80例HER2+(IHC 2+/3+)BTC患者接受了Zanidatamab(20mg/kg,静脉注射,每2周1次)治疗,其中实现cORR的患者比例为41.3%(33/80),中位缓解持续时间(DOR)为12.9个月,中位无进展生存期(PFS)为5.5个月。在今年的ASCO大会上,Jazz Pharmaceuticals还公布了这些患者的总生存期(OS)数据——15.5个月。
来源:Jazz Zanidatamab 2024研发日PPT
安全性数据显示,在该研究中,最常见(发生率≥20%)的不良反应是腹泻、输液相关反应、腹痛和疲劳。53%的患者发生严重不良反应,1例患者发生肝功能衰竭的致命性不良反应,2.5%的患者因不良反应而永久停药。
Jazz Pharmaceuticals已在今年2月启动验证性III期研究(HERIZON-BTC-302),以评估Zanidatamab联合标准治疗对比标准治疗作为BTC患者的一线治疗的有效性和安全性。
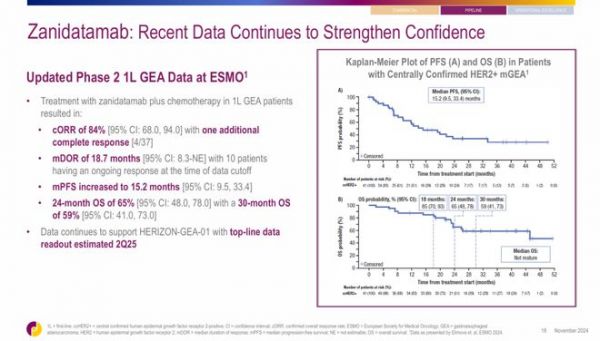
除了BTC,Zanidatamab在其他类型肿瘤中也取得了积极结果。针对HER2+胃食管腺癌(GEA)的II期研究结果显示,41例患者接受Zanidatamab联合化疗作为一线治疗方案治疗后,cORR达到84%,中位DOR达到18.7个月,中位PFS达到15.2个月,OS达到24个月和30个月的患者比例分别为65%和59%。
来源:Jazz公司近况简介PPT
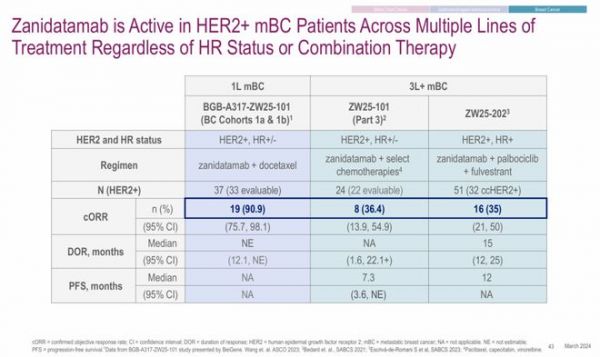
针对HER2+乳腺癌的研究结果显示,在33例可评估疗效的HER2+/HR(+/-)乳腺癌患者中,接受Zanidatamab联合多西他赛作为一线治疗方案治疗后,cORR达到90.9%;在22例可评估疗效的HER2+/HR(+/-)乳腺癌患者中,接受Zanidatamab联合化疗作为三线治疗方案治疗后,cORR达到36.4%;在32例可评估疗效的HER2+/HR+乳腺癌患者中,接受Zanidatamab联合化疗作为三线治疗方案治疗后,cORR达到35%。
来源: Jazz Zanidatamab 2024研发日PPT
针对GEA和乳腺癌,Jazz Pharmaceuticals也启动了验证性III期研究:
HERIZON-GEA-01研究:评估Zanidatamab+化疗±替雷利珠单抗对比曲妥珠单抗+化疗一线治疗晚期或转移性HER2阳性GEA患者的潜力。Jazz Pharmaceuticals预计在2025年第二季度可以获得研究数据。
EmpowHER-303研究:评估Zanidatamab+化疗对比曲妥珠单抗+化疗三线治疗接受德曲妥珠单抗治疗后疾病进展或对德曲妥珠单抗不耐受的转移性HER2阳性乳腺癌的有效性和安全性。
目前,全球在研HER2单靶点双抗共7款,在研HER2多靶点双抗共31款。其中,处于III期阶段的药物仅Anbenitamab( 石药集团/ 康宁杰瑞) 。Merus开发的HER2/HER3双抗Zenocutuzumab已在今年5月递交上市申请,但因CMC问题被FDA将PDUFA日期延长至2025年2月4日。
Copyright © 2024 PHARMCUBE. All Rights Reserved.
欢迎转发分享及合理引用,引用时请在显要位置标明文章来源;如需转载,请给微信公众号后台留言或发送消息,并注明公众号名称及ID。
免责申明:本微信文章中的信息仅供一般参考之用,不可直接作为决策内容,医药魔方不对任何主体因使用本文内容而导致的任何损失承担责任。
特别声明:以上内容(如有图片或视频亦包括在内)为自媒体平台“网易号”用户上传并发布,本平台仅提供信息存储服务。
Notice: The content above (including the pictures and videos if any) is uploaded and posted by a user of NetEase Hao, which is a social media platform and only provides information storage services.
相关知识
全球首款HER2双抗获FDA批准上市,已在国内申报上市
全球首创:中国抗体CD22抗体上市申请获受理
罗氏宣布:第二款CD20/CD3双抗加速获批上市
全身型重症肌无力获得新疗法,优时比FcRn单抗获FDA批准上市
FDA批准全球首款A型血友病基因治疗上市,治疗价格290万美元
25年首款银屑病外用乳膏问世 已获美国FDA批准上市
国家药监局:首款国产抗肿瘤药物PD-1上市申请被拒绝
辉瑞这款新药获批上市 英日欧美中已批准使用希必可
国产首款PCSK9单抗抑制剂申报上市 有望打破进口药垄断
阿斯利康注射新药RSV抗体在中国申报上市,一针能保护一季
网址: 全球首款HER2双抗获FDA批准上市,已在国内申报上市 https://www.trfsz.com/newsview25738.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3864
- 2早上怎么喝水最健康? 3651
- 3习惯造就健康 影响健康的习惯 3299
- 4五大原因危害女性健康 如何保 3205
- 5连花清瘟、布洛芬等多款感冒药 2965
- 6男子喝水喉咙里像放了刀子一样 2462
- 710人混检核酸几天出结果?1 2229
- 8第二轮新冠疫情要来了?疾控中 2223
- 9转阴多久没有传染性?满足四个 2163
- 10补肾吃什么 补肾最佳食物推荐 2078






