概要
覆盆子酮,又名悬钩子酮,树莓酮(raspberry ketone),化学名为 4-对羟基苯基-2-丁酮。1918年被日本人Nomura和Nozawa发现。1957年被确认为是覆盆子中的主要香味物质,但在天然覆盆子果实中含量仅为1-4 mg/kg。

覆盆子酮是一种经过美国食用香料制造者协会(FEMA)和欧洲理事会(COE)共同认可使用的安全食用香料,其 FEMA 编号为 2588。GB 2760-1996 中规定覆盆子酮作为食用香料用量为 40~320 mg /kg,可用于覆盆子、葡萄、菠萝、桃子、李子、草莓、红莓子、茉莉、栀子、晚香玉等香型香精的配制,亦可作为修饰剂或定香剂大量用于日用香料、食品香料、日化香精和烟用香精中。已成为仅次于香兰素的一种具有极高经济价值的香料。
同时,也是重要的精细化学品中间体。在化妆品行业中,因覆盆子酮具有美白作用因此可添加到美白化妆品中,且因为覆盆子酮是天然香料,固还可起到定香的作用。在农业中,覆盆子酮及其乙酰化合物是果蝇的性引诱剂亦称性信息素,合成作为农药,其需求量越来越大,远远超过食品和化妆品中用量的几至几十倍。在医药行业中,因覆盆子酮具有消炎的功效,因此可将其添加到药物中;其与没食子酸表儿茶素的组合物可用于预防、治疗肥胖或如非胰岛素依赖型糖尿病型和综合症等与肥胖相关的症状;覆盆子酮和伯胺生成的希夫碱是用于治疗心肌收缩力衰弱的β-肾上腺素受体激动药多巴酚丁胺的中间体。在其他方面的应用:覆盆子酮也被用于制造捕鱼的诱饵。

减肥功效
覆盆子酮通过提高去甲基肾上腺素诱导脂肪细胞分解, 预防高脂饮食诱导的小鼠体重和内脏重量增加, 减少肝脏甘油三酯含量; 通过调解糖脂代谢紊乱、改善瘦素抵抗和胰岛素抵抗等综合作用来降低肥胖大鼠体重。日本学者还进行了人体试验, 发现覆盆子酮减少内脏脂肪的效果比其促使皮下脂肪减少的效果更加明显。
不同剂量覆盆子酮组大鼠体重、Lee’s指数和肾周脂肪湿重较模型组显著下降,说明覆盆子酮具有减肥作用。肥胖是能量摄入和消耗不平衡的结果,必然会引起糖脂代谢紊乱,与对照组比,高脂饮食在诱导大鼠肥胖的同时,可引起血糖、血TG、TC、LDL-C水平明显增高,HDL-C水平明显降低。覆盆子酮组大鼠血糖、血TG、TC、LDL-C水平均较模型组显著降低,而HDL-C水平明显增高。说明覆盆子酮具有降血脂糖和血脂的作用。
目前研究认为,瘦素的内源性抵抗是肥胖形成的基础。试验中肥胖模型组大鼠血清瘦素水平显著高于对照组,说明存在瘦素抵抗。瘦素抵抗和TNFα可产生和加重胰岛素抵抗,而肥胖者,内脏脂肪易于分解,产生过多的FFA,FFA增多抑制葡萄糖氧化,刺激肝糖原合成,可进一步加重胰岛素抵抗。试验中,肥胖模型组大鼠胰岛素、TNFα水平明显增高,而FFA水平和胰岛素指数显著降低,表明存在胰岛素抵抗。与模型组比较,覆盆子酮组大鼠血清瘦素、FFA水平和胰岛素指数均显著降低,而胰岛素、TNFα水平明显增高。表明覆盆子酮可通过改善高脂饮食诱导的肥胖大鼠的瘦素抵抗、胰岛素抵抗,对防治肥胖的发生具有重要意义。
覆盆子酮的化学合成方法
主要有以下四种:1)苯酚-丁醇酮法;2)苯酚-甲基乙烯酮法;3)对羟基苯甲醛-丙酮缩合-加氢还原法;4)甲氧基苄氯-乙酰乙酸乙酯法。但这些合成方法存在使用大量酸碱和强毒性物质,腐蚀设备,污染环境,后处理困难,收率低等问题。
天然覆盆子酮的制备主要依靠天然提取法,由于受到覆盆子树资源有限,果实中含量极低等限制,无法实现工业化生产。这也同样导致天然来源的覆盆子价格(约US$3000/kg)远远高于化学来源(约US$58/kg)。
覆盆子酮的生物合成方法
路线一:桦木苷或杜鹃醇路线
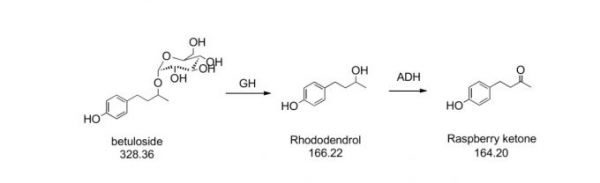
1996年,法国研究人员DUMONT Benoit 等在专利EP0707072A1公开了天然覆盆子酮的生物制备方法:首先,从白桦树的树皮提取桦木糖苷(betuloside),如上图。然后用β-葡萄糖苷酶(源自SIGMA)水解桦木糖苷制得杜鹃醇,然后再通过醇脱氢微生物Candida boidinii DSM 70033 将杜鹃醇氧化脱氢制备覆盆子酮。
1999年,法国研究人员FALCONNIEK Brigitte等在专利WO9949069A1公开了一种生物转化制备覆盆子酮的方法:直接利用发酵的酵母菌株中所具有的β-葡萄糖苷酶和仲醇脱氢酶活性一步催化外援添加在发酵液中的杜鹃醇葡萄糖苷生产覆盆子酮。
2003年,Kurt Faber和Wolfgang Kroutil团队(Tetrahedron 2003, 59, 9517-9521)以杜鹃醇为底物,对不同的红球菌属冻干细胞进行筛选,得到马红球菌Rhodococcus equi IFO3730 和赤红球菌Rhodococcus ruber DSM 44541能够使用丙酮作为氢的受体,非常高效的催化氧化得到覆盆子酮,并且底物浓度高达 500 g/L。
路线二:对羟基苯甲醛/丙酮路线
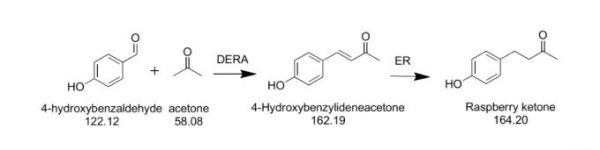
1996年,Claudio Fuganti等分别以baker’s yeast(Tetrahedron, 1996, 52. 4041-4052)和Beauveria bassiana(Tetrahedron: Asymmetry, 1996, 7, 3129-3134)对4-羟基亚苄基丙酮(如上图)中的烯键进行还原制备覆盆子酮。并且于1998年发表文章(Journal of Molecular Catalysis B: Enzymatic 1998, 4, 289-293)再次对能够催化还原烯键的问生物进行筛选,并对还原产物进行详尽的考察,发现某些微生物能选择性地还原烯键,而大多数微生物则同时还原烯键和羰基生成杜鹃醇。
1998年,Whitehead, I.M. 等(Food Technol 1998, 52, 40-46)提出了上述完整路线,从发酵或植物提取来源的对羟基苯甲醛和发酵来源的丙酮通过醛缩酶催化缩合,而后经β-消去反应得到4-羟基亚苄基丙酮,最后通过微生物催化烯键还原得到覆盆子酮。
2007年,G. Feron等(Letters in Applied Microbiology 2007, 45, 29-35)等利用基因工程宿主菌大肠杆菌表达源于细菌的醛缩酶(DERA)实现了对羟基苯甲醛和病痛的缩合,并通过过程优化,最终覆盆子酮合成关键中间体4-羟基亚苄基丙酮的产量达到160 mg/L。
2013年,谷运璀等(香料香精化妆品,2013(增刊1) : 39-41)以天然大茴香醛为原料,与发酵法生产的天然丙酮缩合,制得茴香叉丙酮,再经氢化得到茴香丙酮,最后将茴香丙酮进行脱甲基反应,制得天然覆盆子酮,并采用测量同位素14C 方法,确定其天然度为 98% 以上。
2014年,徐冬青等(化学研究与应用,2014,26, 301-305)以同样的方法制得天然级覆盆子酮,总收率为 75.75% ( 以大茴香醛计),含量为 98.65%,香气纯正。此外,此种方法也有不少专利报道(CN 103724173A,CN 104193607A,CN 101717328A, CN 105218340A等)。
2011年,Xiang Chen等在文章(Journal of Molecular Catalysis B: Enzymatic 2011, 68, 71-76)中利用氨基酰化酶在有N-杂环化合物(如咪唑)存在的情况下可以催化可以催化醛和酮的缩合反应,且发现必须二者同时存在的条件下才有催化活性。但催化对羟基苯甲醛和丙酮缩合生成4-羟基亚苄基丙酮得率仅为8.5%。
路线三:苯丙氨酸/香豆酸路线
2000年,Seshu Pedapudi等(Biotechnol. Prog. 2000, 16, 346−349)详尽地考察了树莓细胞悬浮培养过程中覆盆子酮以及其合成的关键中间体p-香豆酸,亚苄基丙酮在不同培养条件下生成量的变化。并且证实植物细胞代谢过程中,覆盆子酮并不是最终代谢产物,还会进一步被代谢。2007年,Kei Shimoda等(Phytochemistry 2007, 68, 487–492)利用美洲商陆细胞培养证实了上述观点。2011年,Takao Koeduka等(Biochemical and Biophysical Research Communications 2011, 412, 104–108)则对提取自覆盆子的覆盆子酮/姜油酮合成酶(RZS)进行了底物谱分析,证明了该酶为植物细胞合成覆盆子酮最后一步催化还原α,β-不饱和双键的酶,且其表达量在成熟的果实中最高。
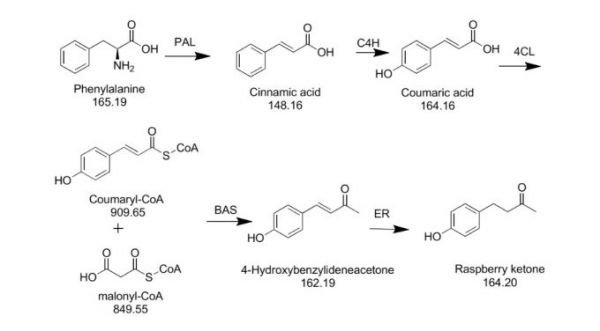
2006年BEEKWILDER Martinus Julius等在专利GB2416769A和GB2416770A中公开了一种利用大肠杆菌表达覆盆子来源的亚苄基丙酮合成酶(BAS)或查尔酮合成酶( CHS)和烟草来源的4-香豆酸辅酶A连接酶( 4CL)催化人工添加前体物质苄叉丙酮或香豆酸来合成覆盆子酮的方法。其中查尔酮合成酶CHS cDNA来源可由如葡萄、拟南芥、金鱼草、苜蓿、玉米和香菜等代替。并且于2007年再次发表文章详细研究了各酶基因对覆盆子酮合成的影响,在最有优件下覆盆子酮浓度达到5 mg/L。
2016年,Danna Lee等(Lee et al. Microb Cell Fact 2016, 15, 49)进一步地在酿酒酵母中人工构建表达源于微生物来源的苯丙氨酸/酪氨酸裂氨酶(PAL/TAL)和植物来源的肉桂酸-4-羟化酶(C4H)、4-香豆酸辅酶A连接酶( 4CL)、亚苄基丙酮合成酶(BAS)实现了覆盆子酮由苯丙氨酸的体内全合成。最终覆盆子酮浓度为2.8 mg/L,在外源添加3 mM的香豆酸的情况下更是达到7.5 mg/L。并且同时发现在有氧发酵的霞多丽果汁酿造过程中覆盆子酮浓度为3.5 mg/L,而在厌氧发酵的葡萄酒酿造过程中只有0.68 mg/L。
参考文献EP0707072A1; WO9949069A1; Tetrahedron 2003, 59, 9517-9521.
Tetrahedron, 1996, 52, 4041-4052, Tetrahedron: Asymmetry, 1996, 7, 3129-3134; Journal of Molecular Catalysis B: Enzymatic 1998, 4, 289-293; Food Technol 1998, 52, 40-46; Letters in Applied Microbiology 2007, 45, 29-35; 香料香精化妆品,2013(增刊1) : 39-41; 化学研究与应用,2014,26( 2) : 301-305; CN 103724173A,CN 104193607A,CN 101717328A, CN 105218340A; Journal of Molecular Catalysis B: Enzymatic 2011, 68, 71-76.
Prog. 2000, 16, 346−349; Phytochemistry 2007, 68, 487–492; iochemical and Biophysical Research Communications 2011, 412, 104–108; GB2416769A; GB2416770A; Lee et al. Microb Cell Fact, 2016, 15, 49.






