临床问题|2020瘦型
CK注:病区诊治疑似PCOS的患者出院,并未找到月经紊乱的其他原因,诊断PCOS,但患者未相对消瘦的体型;实际上肥胖、月经紊乱的的PCOS可能在临床上最为常见,但相对消瘦的PCOS也不少见;此类患者到底有什么特殊性?实际到目前为止并没有很好的研究。另外,这一类型是否作为独立的疾病实体并没有定义和共识,因此本文中所提到的瘦型或瘦组患者仅限于本文的理解,至少在这一类PCOS的生活方式干预上肯定与肥胖PCOS不同。关于PCOS的基本知识:
NEJM综述2016 l 多囊卵巢综合征(PCOS)**
内分泌医学史 l 多囊卵巢综合征的历史**
临床问题|2020
瘦型-多囊卵巢综合征
编译/陈康
要点:
与健康女性相比,瘦型PCOS女性的激素、代谢和血液学特征发生改变。
然而,与该综合征肥胖女性相比,这些紊乱可能相当,也可能不太明显。在PCOS中,胰岛素抵抗似乎与肥胖无关,是PCOS固有的。
治疗方案包括体重维持、使用二甲双胍等胰岛素增敏剂恢复排卵、缓解多毛症、痤疮和月经功能障碍等症状,以及在难治病例中采用辅助生殖技术,所有这些都显示出有希望的结果。
瘦型PCOS研究并不透彻,是否明确代表一类重要的疾病实体缺乏研究。需要进行精心设计的随机对照试验,以确认之前在瘦型PCOS研究中的发现,并整合本文中提出的诊断和管理流程。
介绍
多囊卵巢综合征(PCOS)是一种异质性内分泌疾病,影响4-8%的育龄妇女[JCEM. 2004;89: 2745–9]。它是无排卵性不孕的最常见原因,在不孕不育诊所就诊的无排卵性不孕妇女中,约90-95%受到该综合征的影响[Clin Epidemiol. 2014;6:1–13]。特征性表现包括多囊卵巢、月经紊乱和高雄激素血症。高达70%的高雄激素血症女性表现为多毛症或体毛过多。痤疮也是高雄激素血症的标志,尽管罕见且特异性较低[Hum Reprod. 2012;27:14–24;JCEM. 2004;89:453–62]。
尽管PCOS的大多数病例为肥胖/超重,但仍有一小部分患者的体重指数正常(BMI;≤25 kg/M2),这使得诊断工作和治疗方法更加困难。这些病例可被称为瘦型PCOS(Lean PCOS)。在此类病例中,需要先排除具有相似临床表现的其他内分泌和遗传疾病,然后临床医生才能制定适当的管理计划。本文对此类型的诊断和治疗路径进行讨论,试图规范。
PCOS的病理生理学
PCOS生理学虽然经过多年研究,但仍未明晰(JCEM.2004;89: 453–62),被认为是遗传、表观遗传学、卵巢功能障碍、内分泌、神经内分泌和代谢改变以及其他变化之间相互作用的结果[Horm Res Paediatr. 2017;88:371–95]。
卵巢病理学是PCOS的主要因素之一[Horm Res Paediatr. 2017;88:371–95]。正常可育女性中,单个卵泡成熟,并从出生后卵巢中存在的原始卵泡池中排卵。严格控制选择原始卵泡生长的速率,以维持卵巢储备并确保生育力完整[ER. 2015;36:1–24]。在PCOS,雄激素、抗苗勒管激素(AMH)和卵泡刺激素(FSH)之间的失衡会导致卵泡生长停止。AMH由卵巢颗粒细胞产生,在阻止始基卵泡向初级卵泡转化中起重要作用。PCOS卵巢的特征性多囊性外观是由于大量原始卵泡生长并经历随后的生长停滞[Horm Res Paediatr. 2017;88:371–95]。卵巢卵泡膜细胞合成雄激素需要高水平的黄体生成素(LH)。高LH结合低FSH水平以及通过雄激素转化降低的雌二醇合成导致无排卵,因为缺乏优势卵泡。
胰岛素抵抗(IR)是PCOS的另一重要组成部分[Horm Res Paediatr. 2017;88:371–95]。IR是由于组织未充分利用胰岛素进行葡萄糖代谢所致。虽然确切的机制尚未阐明,但遗传、子宫内和子宫外因素以及对高能量食物消耗的适应被认为是PCOS IR的致病因素[ReprodBioMed Online. 2005;10:100–4]。青春期也被认为是高胰岛素血症和IR的主要影响因素。在青春期,胰岛素水平和IR可能暂时升高。胰岛素样生长因子-1 (IGF-1)和生长激素水平的后续升高意味着有更多的氨基酸可用于生长[NEJM. 1986;315:215–9]。在青春期,IR仅影响葡萄糖代谢,而不影响蛋白质代谢[Horm Res. 2000;53(Suppl. 1):60–9]。在PCOS,IR会影响肝脏、脂肪组织和骨骼肌。然而,负责类固醇生成的卵巢和肾上腺对胰岛素的作用仍然敏感[DC. 1988;11:500–5]。胰岛素的另一个作用是降低肝脏中性激素结合球蛋白(SHBG)的合成,导致游离雄激素水平升高[JCEM. 1997;82:4075–9]。患有PCOS的女性通常血清胰岛素和IR升高,无论雄激素浓度及其“肥胖”水平如何[Diabetes. 1992;41:1257–66]。
诊断标准
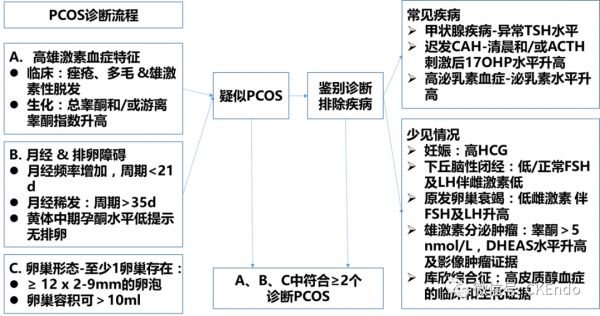
国际上三个重要的团体提出了PCOS的诊断标准(表1),即鹿特丹欧洲人类生殖与胚胎学协会/美国生殖医学协会(ESHRE/ASRM) [Fertil Steril. 2004;81:19–25]、美国国立卫生研究院/美国儿童健康与人类疾病研究所(NIH/NICHD) [Clin Epidemiol. 2014;6:1–13]和雄激素过量与PCOS学会[JCEM.2006;91:4237–45]。一致认为,PCOS是排他性诊断。需要排除库欣综合征、甲状腺疾病、特发性多毛症和高泌乳素血症,甚至是先天性肾上腺皮质增生。这些学术团体均不认为单纯多囊性卵巢而不伴其他临床特征时能诊断PCOS。根据雄激素过量协会和NIH/NICHD,高雄激素血症(包括高雄激素血症)的临床表现是PCOS诊断的前提[JCEM. 2006;91:4237–45]。高雄激素血症是指游离睾酮升高、性激素结合球蛋白(SHBG)减少和游离睾酮指数、硫酸脱氢表雄烯升高,临床上通常表现为多毛症[Clin Epidemiol. 2014;6:1–13,JCEM. 2006;91:4237–45]。鹿特丹标准不要求诊断时必须出现高雄激素血症,但当这些症状与多囊性卵巢同时存在时,即使不存在排卵或月经功能障碍,也可确认诊断[Hum Reprod. 2013;28:1361–8]。在没有月经或排卵功能障碍的情况下,无法根据NIH/NICHD标准诊断PCOS[Clin Epidemiol. 2014;6:1–13]。鹿特丹标准定义的多囊卵巢,需要至少12个卵泡,每个卵泡的直径在2-9 mm之间,伴或不伴卵巢体积增加至超过10 mm3。由于超声技术的改进,自鹿特丹标准首次提出以来,已有呼声修订描述“多囊卵巢形态”的标准,从而能够识别较小的卵泡[Hum Reprod. 2013;28:1361–8]。
表1三组多囊卵巢综合征诊断标准总结
鹿特丹
NIH/NICHD
雄激素过量协会
PCOS被认为是排他的诊断。
PCOS被认为是排他的诊断。
PCOS被认为是被排斥的诊断。
诊断需要以下两项:
诊断需要满足以下所有条件:
诊断需要满足以下所有条件:
高雄激素血症
高雄激素血症
高雄激素血症
多囊性卵巢
月经紊乱
多囊性卵巢和/或“卵巢功能障碍”
无排卵/少排卵
《多囊卵巢综合征的流行病学、诊断和治疗》(2014) [Clin Epidemiol. 2014;6:1–13]NIH/NICHD国家卫生研究院/国家儿童健康与人类疾病研究所,PCOS多囊卵巢综合征
抗苗勒管激素在PCOS诊断中的新作用
抗苗勒管激素(AMH)由胎儿第25周左右至绝经期间的卵巢颗粒细胞合成[JCEM. 1999;84:3836–44]。产生始于月经周期期间,始于原始卵泡的募集发育为小腔卵泡[Reprod Biol Endocrinol. 2015;13:137]。一旦被选择为优势卵泡,产量就会下降[Dev Biol. 2004;266:201–8;Reproduction.2002;124(5):601–9],并可避免早期卵泡募集和卵母细胞或卵泡的过早衰竭[Endocrinology.1999;140(12):5789–96]。
血浆AMH可用于评估卵巢内生长卵泡的数量[JCEM. 2004;89:318–23;JCEM. 2003;88:5957–62]。血清AMH主要由直径为2-9 mm的小窦卵泡合成。卵泡进行计数是通过超声检查确定卵巢中的窦卵泡计数(antral follicular count,AFC)。检测血清AMH水平比获得AFC更敏感、更特异,因为与使用超声检查不同,可检测到直径小于2 mm的前窦和小窦卵泡[HumReprod Update. 2014;20: 370–85.]。血清AMH可在月经周期的任何时间点检测到,且水平在月经周期之间或在单个周期内变化不大,因为该激素不是由黄体或优势卵泡产生的[Hum Reprod. 2005;20:923–7;Hum Reprod.2009;25:221–7]。
血清AMH水平可用于PCOS的诊断,因为与对照组相比,该疾病的妇女中AMH水平高2–4倍[JCEM. 2007;92:240–5;Hum Reprod. 2011;26:2861–8]。这适用于PCOS患者的所有人群,并反映了前卵泡和小窦卵泡的存在[JCEM.2004;89:318–23;JCEM. 2003;88:5957–62]。目前还无法确定诊断PCOS血清AMH阈值,但已提出使用酶免疫分析法(AMH-EIA)得出的值为35 pmol/L或4.9 ng/ml。有人建议,在诊断PCOS时,必须排除其他疾病,并首先确定为少排卵或无排卵和高雄激素血症。如果上述标准之一缺失,则可使用AMH或AFC值辅助诊断。在就AMH阈值达成一致意见之前,建议每个医疗保健中心使用其自身的测定特异性参考区间进行诊断[Reprod Biol Endocrinol. 2015;13:137]。
瘦型多囊卵巢综合征
约80%的PCOS患者BMI值高于正常值或偏高,并表现出典型特征,如高雄激素血症、多囊性卵巢和IR。这些个体通常直到成年后遇到生育问题时才得到诊断。较小但明显比例的PCOS女性BMI正常或偏低,可能有也可能没有月经周期不规则和痤疮等症状[Mol Cell Endocrinol. 2013;373: 61–7;JCEM.1997;82:4075–9]。
瘦型和超重表型PCOS之间的临床体征相似
有一些共识认为,瘦型和超重妇女PCOS的临床表现具有可比性[Indian J Endocrinol Metab. 2012;16:996–9;ER. 2012;33:981–1030;Int J Endocrinol. 2016;2016:9201701]。在出现不孕症的瘦型和超重综合征妇女中,黑棘皮病(皮肤皱褶变暗)、月经功能障碍、多毛症和子宫内膜增生(子宫内膜厚度大于4 mm)的患病率相似。两种PCOS表型的激素概况也相似,包括LH:FSH比值、血清LH和孕酮以及睾酮水平。两组均有胰岛素抵抗(在之前的一份报告中,瘦组和超重组的患病率分别为83.3%和93.1%),并得出结论:IR是PCOS女性固有,因此会发生高胰岛素血症[Indian J Endocrinol Metab. 2012;16:996–9]。由于所用方法限制,已证明很难量化PCOS的胰岛素抵抗。已报告的胰岛素抵抗患病率在44-70%之间[ER. 2012;33:981–1030]。Doh等人在一项针对喀麦隆的PCOS妇女的研究中推测,PCOS和肥胖协同且独立地导致IR[Int J Endocrinol. 2016;2016:9201701]。与对照组相比,PCOS女性的两种表型均具有胰岛素抵抗,这表明在PCOS观察到的IR与其他因素有关,但肥胖可能对IR有一定影响。然而,在一项类似试验中,T2DM阳性或阴性家族史患者之间的IR并无显著差异[Turk J Endocrinol Metab. 2015;19(2):55–9]。瘦组和超重组之间的PCOS临床表现也没有差异,例如多毛症、高雄激素血症和盆腔超声检查结果。因此,最近的研究表明,在PCOS的两种表型中,激素特征和导致高胰岛素血症的胰岛素抵抗相似。
肥胖PCOS患者比瘦组患者存在更严重的紊乱
与瘦组相比,PCOS肥胖个体存在更严重的激素和代谢紊乱[J Hum Reprod Sci. 2009;2:12–7;Gynecol Endocrinol. 2007;23:325–31]。印度报道PCOS女性在瘦亚型和超重亚型中没有显著不同的高血压水平。高雄激素血症(超重74.2% vs. 瘦50.6%,P = 0.000,95%置信区间CI:0.14–0.32)和月经功能障碍(超重79.2% vs. 瘦44%,P = 0.000 95% CI:0.26–0.44)在超重女性组中显著升高。超重组中T2DM患病率较高,糖耐量异常也较高。超重受试者中子宫内膜增生的相对风险较高(RR = 2.8),但无未达统计学意义(p = 0.055)。肥胖队列中T2DM病、糖耐量异常和子宫内膜增生的患病率较高,这意味着他们比瘦组PCOS患者更年轻时发病的风险更大,需要采用“更严格”的方法进行治疗[J Hum Reprod Sci. 2009;2:12–7]。
也有研究针对瘦组合超重组PCOS女性的代谢变化,以及这种变化与肽类激素脂联素(adiponectin)和饥饿素(ghrelin)水平之间的关联[Gynecol Endocrinol. 2007;23:325–31]。脂联素由脂肪细胞分泌,参与脂质和葡萄糖稳态[Clin Chem. 2004;50:1511–25]、胰岛素敏化,并具有抗糖尿病特性[Nat Med. 2001;7:941–6.;Nat Med. 2002;8: 1288–95]。饥饿素主要由胃肠道神经内分泌细胞产生。这种促食欲激素被认为参与能量稳态、葡萄糖代谢和“胰岛素信号传导”的调节[Clin Chem.2004;50:1511–25;JCEM.2001;86:5083–6;Nature. 2001;409(6817):194–8;Endocrinology. 2000;141:4325–8]。它会增加脂肪组织和生长激素的释放,从而导致食物消耗和体重增加[J Pharmacol Sci. 2006;100: 398–410]。高水平的脂联素和饥饿素似乎对葡萄糖代谢至关重要。在无PCOS综合征的肥胖女性中,与无该综合征的瘦组女性相比,脂联素水平显著降低。与瘦组女性相比,无论PCOS状态,肥胖女性的血浆饥饿素水平也显著较低。无论是否患有PCOS,瘦女性的脂联素水平相当[Gynecol Endocrinol. 2007;23:325–31]。研究结果表明,肥胖与脂联素和饥饿素水平较低有关,但未能证明PCOS对这两种肽的水平有有害影响。与BMI匹配的非PCOS女性相比,PCOS瘦组女性的胰岛素抵抗显著更强。然而,在该综合征肥胖女性中,IR的程度更大[GynecolEndocrinol. 2007;23:325–31]。最近的研究表明,尽管PCOS瘦组女性中存在激素和代谢紊乱,但这些变化在内分泌紊乱肥胖个体中更为严重。
伴代谢和血液学紊乱PCOS的瘦组患者
与BMI匹配的健康对照组相比,PCOS瘦组女性有各种病理生理异常[Ann Pediatr Endocrinol Metab. 2015; 20:136–42;PLoSOne. 2017;12: e0178120]。对PCOS患者代谢异常的研究显示,与瘦组对照相比,瘦组PCOS妇女接受葡萄糖给药两小时后血浆胰岛素水平显著升高。与对照组相比,PCOS瘦肉妇女的低密度脂蛋白(LDL)和总胆固醇也显著升高。血浆γ谷氨酰转移酶(GGT)水平是心血管疾病的良好预测因子,在瘦组和超重PCOS表型中均显著高于对照组,血红蛋白水平也是如此。高GGT水平与心血管疾病和死亡发生率增加相关,其确切机制尚不清楚。由于GGT在氧化应激中的作用、对含LDL斑块的定位及其促炎性质,认为其参与动脉粥样硬化形成[Ann Transl Med. 2016;4(24):481]。睾酮被认为以剂量依赖性方式刺激红细胞生成[Clin Pharmacol Ther. 2006;80:105–14;JCEM.2008;93: 914–9],这可能解释了为什么PCOS组的血红蛋白水平较高[Ann Pediatr Endocrinol Metab. 2015;20:136–42]。与对照组[Horm ResPaediatr. 2017;88:371–95.]相比,所有PCOS女性中参与胰岛素合成和分泌的胰腺β细胞功能更强。然而,当仅将瘦组PCOS妇女与瘦对照组进行比较时,差异减小。与对照组(包括瘦组PCOS妇女及其对照组)相比,PCOS妇女的胰岛素抵抗增加。研究人员提出,在PCOS需要在早期阶段确定IR,即使是在BMI低且糖耐量正常的女性中[PLoS One. 2017;12:e0178120]。
在这一女性队列中,发现患有PCOS的瘦组青年女性的血液流变学特征(或血液成分和流量研究)紊乱。与对照组相比,在较低剪切速率下,瘦组PCOS的血液粘度显著增加[PLoS One. 2016;11:e0167290]。这被认为增加了内皮功能障碍[Clin Endocrinol. 2013;78:438–46]、冠状动脉钙化[JCEM. 2003;88:2562–8]、静脉血栓栓塞[Am J Obstet Gynecol. 2012;207:377-e1-8]等健康风险。结果显示,PCOS组的红细胞聚集率也显著升高,这可能导致血流阻力增加。这可能导致血管调节机制失调的患者发生组织缺血,如心血管疾病和T2DM病患者。发现相对于体重匹配的对照组[Am J Obstet Gynecol. 2012;207:377-e1-8]而言,瘦且年轻组的PCOS女性的抗氧化防御系统减弱,PCOS和对照组[PLoS One. 2016;11:e0167290]的红细胞变形性不对等。相对于BMI匹配正常对照,PCOS瘦组个体的生理在许多方面似乎紊乱,如脂质、激素和血液流变学特征。
鉴别诊断和排除诊断的检查
瘦型PCOS只是一个推测的PCOS分组,其特征还未有共识。而其诊断应符合当前PCOS诊断。同样,多种临床疾病可以在临床上类似瘦型PCOS,需要在规划疾病管理之前通过适当的实验室检查排除。这些疾病包括先天性肾上腺增生(CAH)、分泌雄激素的肾上腺或卵巢肿瘤、库欣综合征、肢端肥大症、高泌乳素血症、甲状腺疾病以及可导致多毛症的药物(如睾酮制剂、合成代谢类固醇和皮质类固醇)。详细的病史加上全面临床检查和生化检查有助于排除这些疾病。
非经典/晚发型CAH表现为多毛症和闭经,可能类似PCOS。空腹血清皮质醇、17-羟孕酮和促肾上腺皮质激素(ACTH),随后可用250μg ACTH刺激,并在30和60 min后测量皮质醇和17-羟孕酮,构成CAH的初步筛查 [EJE.2018;179(2):R57–R67]。基础和ACTH刺激后17-羟基孕酮水平升高(> 43 nmol/L)提示CAH。CAH的诊断确认是通过对编码肾上腺类固醇生成相关酶的基因突变进行基因检测[EJE. 2018;179(2):R57–R67]。
基线睾酮水平> 5.0 nmol/L通常表明存在分泌雄激素的肾上腺或卵巢肿瘤,需要进一步进行激素和影像学检查[EJE. 2018;178:R141–54]。可通过以下四项检查中的至少两项检查筛查糖皮质激素过量,排除库欣综合征:24小时尿游离皮质醇、过夜地塞米松抑制试验、深夜唾液皮质醇测定或低剂量地塞米松抑制试验[J Clin Pathol. 2017;70:350–9]。肢端肥大症筛查包括检测血清胰岛素样生长因子1 (IGF-1)水平升高和口服葡萄糖耐量试验[JCEM. 2014;99:3933–51]。血清泌乳素水平升高表明高泌乳素血症,需要进一步评估原因。血清促甲状腺素(TSH)的变化通常表明甲状腺功能障碍。详细的药物摄入史(包括外用面霜)将有助于排除模拟PCOS的药物诱发病因。
图1 用于处理PCOS疑似病例的诊断流程。
瘦型PCOS的管理方案
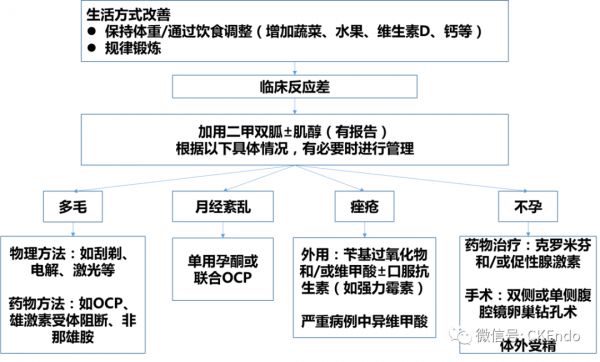
瘦型PCOS有多种管理方案,如图2所示。药物措施可改善IR,降低血液中升高的雄激素水平,并下调卵巢的雄激素合成[JCEM. 1997;82:4075–9]。
图2 瘦型多囊卵巢综合征(PCOS)患者的管理流程
饮食和生活方式改变
对于PCOS肥胖表型的女性,减重被视为一线治疗,但对于该综合征瘦组女性,则未考虑此治疗[J Hum Reprod Sci. 2017;10:154–61]。热量限制是不必要的,因为瘦女性可能不一定需要减重。相反,此组PCOS女性应该以保持体重为目标。通过饮食干预和定期体育活动改变生活方式,已显示出改善的胰岛素抵抗和改善的高雄激素血症,以及对PCOS症状的其他有益影响[J HumReprod Sci. 2017;10:154–61;BMC Complement Altern Med. 2014;14:511]。应鼓励PCOS瘦组女性食用蔬菜和水果,以确保有充足的各种矿物质、维生素和营养素供应。
恢复排卵
无排卵更可能发生在肥胖而非瘦组PCOS个体中。一些作者认为,超重女性对诱导排卵的药物措施反应不佳的几率更高[Reprod BioMed Online. 2005;10:100–4]。然而,没有足够的数据证明这一点。
二甲双胍治疗
二甲双胍是一种胰岛素增敏剂,可通过改善外周葡萄糖摄取和使用以及降低肝葡萄糖输出来降低血清葡萄糖水平。与肥胖女性相比,在PCOS瘦组女性中使用二甲双胍更能成功地恢复月经(55%)和排卵(45%)。瘦表型表现出更显著的空腹血糖、睾酮和胰岛素抵抗的降低[Endocr Abstr 2011;26(P90).]。即使在体重不足的PCOS患者中,二甲双胍治疗也与月经周期紊乱的改善相关[Arch Gynecol Obstet. 2017;296:363–71]。另外,接受二甲双胍治疗的瘦组无排卵妇女低血糖风险并不高[Obstet Gynaecol. 2004;6:145–51]。
3g/天肌醇
似乎对瘦组PCOS有积极的影响。有报告该治疗可导致黄体生成素和雄激素、以及在炎症中起作用的“高敏感性C反应蛋白” 水平降低,并改善胰岛素耐量[J Obstet Gynaecol Res. 2014;40:1353–60]。该药物被认为通过作为胰岛素信号的信使,随后增加外周葡萄糖的摄取,从而改善胰岛素抵抗。在PCOS妇女中可恢复激素水平和排卵[JHum Reprod Sci. 2017;10:154–61;J Obstet Gynaecol Res. 2014;40:1353–60]。在不存在胰岛素抵抗的瘦组PCOS中,它可能不适用。研究还显示,高剂量对卵母细胞的质量有有害影响[J Hum Reprod Sci. 2017;10:154–61]。
辅助生殖技术
与超重女性(BMI≥25 kg/M2)相比,PCOS瘦组女性的受精率显著更高[J Hum Reprod Sci. 2013;6:194–200]。BMI似乎对体外受精(IVF)结果有显著影响。与该疾病的超重女性相比,PCOS瘦组女性使用促性腺激素释放激素(GnRH)激动剂和拮抗剂进行卵巢刺激后的受精率显著升高(分别为p < 0.02和p< 0.01)。在接受中黄体长效GnRH激动剂抑制方案卵巢刺激的妇女中观察到较高的妊娠率。这可能是因为可以降低高LH水平,从而降低对单个卵母细胞质量和“植入潜力”的损害效应[Reprod BioMedOnline. 2009;18:333–6]。在最近的一项荟萃分析中,发现单侧或双侧腹腔镜卵巢打孔等手术技术与妊娠成功率相当[Arch Gynecol Obstet. 2018;297:859–70]。
多毛症的治疗
多毛症在一些瘦组PCOS患者中顾虑较大,可能需要美容治疗(通过电解或激光治疗脱毛)以及药物干预来减缓毛发生长。使用口服避孕制剂抑制卵巢雄激素的产生是有用的[CMAJ. 2016;188:118–26]。雄激素受体阻滞剂(醋酸环丙孕酮、氟他胺、螺内酯和5α-还原酶抑制剂[非那雄胺])可用于减少毛发生长[Int J Womens Dermatol. 2017;3(1 Suppl):S6–S10]。
痤疮的治疗
PCOS某些病例的痤疮可能严重,管理也比较困难。轻度和中度痤疮可能对局部制剂如过氧化苄(benzylperoxide)和/或克林霉素(clindamycin)或类视黄醇乳膏(retinoids creams)有反应[CMAJ. 2016;188:118–26]。但是,重度病例可能需要额外口服四环素类抗生素治疗,在某些情况下需要口服异维甲酸(isotretinoin)治疗。由于类视黄醇制剂的潜在毒性或全身性毒性,建议在此类情况下由皮肤科医生密切监督治疗[CMAJ. 2016;188:118–26]。
现有证据的局限性和不确定领域
在这一领域,当前的文献在研究设计方面存在明显的各种限制。方法学限制因素中,常因样本量通常太小而无法报告显著结果。标准不一致,虽然多数应用鹿特丹标准。种族本身可能在PCOS间有差异,因此部分族群的研究结果不能推至所有PCOS女性,这使研究结果更加复杂。此外,PCOS特征与青春期出现的特征重叠,如痤疮、月经不调和多囊卵巢形态[JCEM. 2013;98:4565–92],使青少年的PCOS诊断更加困难[Ann Pediatr Endocrinol Metab.2015;20:136–42]。未来应对时,应进行大规模随机对照试验,以确定这些差异的显著性。应调查患有该综合征的特定年龄和族裔群体,并使用相同的诊断标准来确保得出可靠的结论。
小结
从最近的研究中可以明显看出,在瘦组PCOS中存在代谢、激素和血液学紊乱,但这些与影响肥胖表型PCOS相当或较小。胰岛素抵抗在PCOS(无论是BMI如何)都是固有的,应尽早进行管理。在管理瘦表型方面,目前研究的结果是有希望的。改变生活方式,通过使用药物干预恢复排卵,甚至在难治病例中进行IVF,可缓解症状并增加成功妊娠的机会。
全文约8000
陈康2021-09
CK注:原发于@CK医学
临床问题|2020瘦型-多囊卵巢综合征(PCOS)**
相关知识
临床问题|2020瘦型
点名 6 大科室!国家医保局公开 67 个典型问题,严查全国医院
代谢健康肥胖:从流行病学、机制到临床意义
2020健康瘦身报告:饮食瘦身专业化程度待提升,口碑建设成企业角逐头部关键
2020年【健康瘦身】行业调研分析报告(54页)
昆明做过人流后将面临的问题有哪些呢?
扑朔迷离!临床医生亲述:不明原因「暴瘦」,排除多重风险,最终原因你一定猜不到!
中医药治疗新冠最高级别循证研究成果公布!散寒化湿颗粒临床优势获力证
我国首款猴痘疫苗获批临床
消瘦问题如何解决
网址: 临床问题|2020瘦型 https://www.trfsz.com/newsview29112.html
推荐资讯
- 1男女激情后不宜做哪些事 4556
- 2从出汗看健康 出汗透露你的健 3857
- 3早上怎么喝水最健康? 3647
- 4习惯造就健康 影响健康的习惯 3292
- 5五大原因危害女性健康 如何保 3198
- 6连花清瘟、布洛芬等多款感冒药 2960
- 7男子喝水喉咙里像放了刀子一样 2459
- 810人混检核酸几天出结果?1 2225
- 9第二轮新冠疫情要来了?疾控中 2223
- 10转阴多久没有传染性?满足四个 2163