火龙果来源甜菜红素的研究及应用进展
摘 要 火龙果尤其是红皮红肉火龙果是甜菜红素的重要来源之一。作为一种水溶性可食用色素,甜菜红素具有较好的抗氧化活性与自由基清除能力,在食品、药品及化妆品等多个领域具有广泛应用;但其稳定性较差,因此应用潜能受到限制。该文首先概述火龙果源甜菜红素的含量、结构、提取方法,然后阐述温度、光照、pH和金属离子等因素对其稳定性的影响以及提高稳定性的方法,最后综述了甜菜红素作为天然抗氧化剂、抑菌剂和酸碱指示剂等方面的应用进展,为深入研究甜菜红素及其应用提供参考。
颜色是影响消费者对食品接受度的直观且重要因素之一。随着人们对健康饮食观的愈发重视,采用天然色素来加工食物越来越受到消费者的青睐。与合成色素相比,天然色素不仅安全且具备多种生物活性。据统计,日本天然色素年用量为合成色素的10倍以上,在美国,其销售额年增长率高于10%[1];在国内食品加工中使用天然色素占比不足20%,但更多的消费者越来越关注食品配料表中是否添加合成色素。目前,国内已被批准用于食品加工的色素有65种,其中天然色素48种(占比70%以上);生产和使用的主要品种是焦糖色素,约占可食用天然色素总量的70%,其余产量较大的品种有红曲红色素、辣椒红色素、姜黄色素和玫瑰茄色素等[2]。
天然色素主要来源于动植物组织和微生物,其中植物是天然色素最广泛的来源。植物源天然色素主要包括姜黄素、花青素、甜菜红素、叶绿素、类胡萝卜素和胡萝卜素等。甜菜红素是水溶性液泡色素,属于吡啶类衍生物,其基本发色基团是1,7-二偶氮庚甲碱,因最早在黎科的红甜菜块根中被发现而得名。它主要存在于石竹目植物(包括藜科、仙人掌科、紫茉莉科、苋科和商陆科等)的花、果实及根茎组织,或一些高等真菌(如毒蝇鹅膏菌)中[3]。甜菜红素具有较高的亲水性和着色强度,因而可作为食品、药品及化妆品的重要且有效天然着色剂。甜菜红素已被欧美批准作为食用色素,并可商业化应用。国内已于1998年将其正式列入国家批准允许使用的食用天然色素名录[4],天然来源甜菜红色素可在各类食品中按生产需要适量添加。此外,甜菜红素结构中的芳香环及大量羟基使其具有较好的抗氧化活性与自由基清除能力。故除用作着色剂外,因其具有抗氧化、预防癌症、保护心脏、抗炎、抗菌及减轻肥胖等生物功能而具有较大的应用潜力[1],亦将成为功能性活性成分研究的热门对象。
红甜菜根、红火龙果和红苋菜是甜菜红素的三大主要来源,据统计其中甜菜红素的含量为44~51 mg/g冻干提取物[5]。目前市售甜菜红素(欧盟将其命名为E162)主要来源于红甜菜根,但该来源的甜菜红素提取物因其中土臭素、吡嗪类及其衍生物的存在而有泥土气味,另外还存在硝酸盐易被累积的问题,因此其应用受到限制[6]。从苋菜中提取的甜菜红素因含有三萜皂苷,具有苦味和辛辣味而降低了消费者食用接受度。火龙果口味清新淡雅、不含土臭味等异味,就品质来讲,在食品中应用火龙果源甜菜红素是更佳选择[3]。本文主要从火龙果来源甜菜红素的含量、提取方法、稳定性影响因素、提高稳定性方法及其应用几个方面进行综述,希望能够为后续基础及应用研究提供一定的理论参考。
1 火龙果源甜菜红素的来源、含量及结构
1.1 甜菜红素的来源及含量
按照外观色泽,火龙果有红皮白肉、红皮红肉和黄皮白肉等3种常见类型。其中在红皮火龙果果皮以及红皮红肉的果肉中均含有甜菜红素。在鲜果中,果皮和果肉中甜菜红素含量分别为6~22 mg/100 g和10~29 mg/100 g [7]。值得注意的是,果皮占整果18%~24%,但果皮常被丢弃,故与此同时丢弃了大量甜菜红素资源。若将果皮中的甜菜红素进行提取纯化,可作为食品配料加以应用。此外,甜菜红素含量受火龙果品种、产地、季节等因素的影响。例如,通过对越南、海南省及台湾3个火龙果主产国家或地区的红肉火龙果进行比较,在海南蜜宝、金都一号、台农一号、越南H14四个红皮红肉品种中海南蜜宝火龙果果肉中甜菜红素含量最高,可达28.9 mg/100 g;“台农一号”中含量最小,为15.8 mg/100 g [8]。
1.2 甜菜红素单体结构
甜菜红素的基本结构是1,7-二偶氮庚甲碱,属于吡啶类衍生物。自然界已知甜菜红素有75种,火龙果来源的甜菜红素有8种[6,9],其结构详见表1。其中甜菜苷占比最大。研究发现,在甜菜苷、丙二酰甜菜苷和异3″-羟基-3″-甲基戊二酰甜菜苷中,甜菜苷的热稳定性最高[9]。但目前没有单一结构的甜菜红素标品,这在某种程度上制约了相关研究。
表1 火龙果来源甜菜红素的结构
Table 1 The structure of betacyanins from pitaya fruit
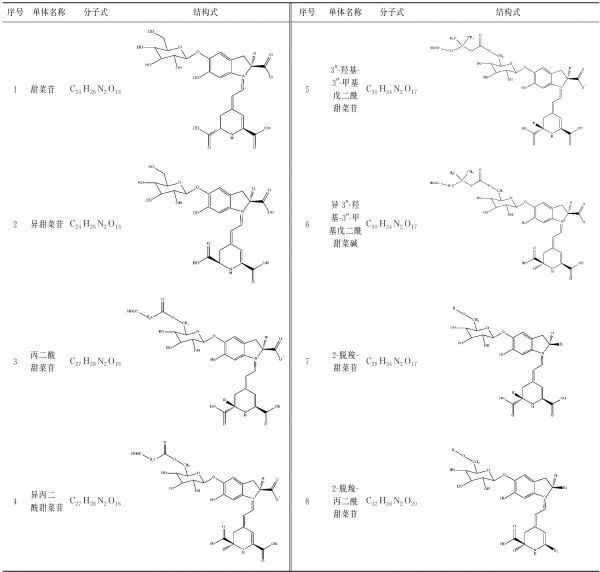
序号单体名称分子式结构式序号单体名称分子式结构式1甜菜苷C24H26N2O1353″-羟基-3″-甲基戊二酰甜菜苷C30H34N2O172异甜菜苷C24H26N2O136异3″-羟基-3″-甲基戊二酰甜菜碱C30H34N2O173丙二酰甜菜苷C27H28N2O1672-脱羧-甜菜苷C29H34N2O174异丙二酰甜菜苷C27H28N2O1682-脱羧-丙二酰甜菜苷C32H36N2O20
2 甜菜红素的提取技术
将天然色素提取出来是后续应用的基础,但常常由于提取率偏低、其稳定性易受到提取过程以及贮运条件的影响而受到限制。甜菜红素也不例外,因此许多研究致力于开发提高提取率的方法。据报道,用于火龙果源甜菜红素提取的方法有浸提法、微波辅助提取、超声波辅助提取、超临界萃取及双水相萃取,如表2所示。由于火龙果的品种及成熟度的差异,以及样品前处理差异,不同提取方式所得甜菜红素含量有差异。其中,采用乙醇浸提法的提取量最高,对果皮和果肉中甜菜红素的提取量分别达到22.23 mg/g和24.30 mg/mL(以干基重)[7];但浸提法耗时长,溶剂用量大,总体成本较高。其次为超临界萃取,其在果皮和果肉中的提取量分别为24.58 mg/100 mL和91.27 mg/100 mL [6];该技术反应条件温和,产品安全性高。大多数情况下从果肉中提取的甜菜红素高于果皮中,这主要是因为在果肉中含量高于果皮;其次由于果皮中含有较多果胶(约17%),这严重阻隔对色素的提取。此外,一些新兴低温提取技术也用于甜菜红素的提取。例如,NUNES等[13]采用高压二氧化碳辅助提取仙人掌梨果中的甜菜红素,经高压二氧化碳预处理(37.5 MPa、55 ℃、60 min)后,在10 MPa、40 ℃及物料/ CO2体积比为20%条件下,提取量可达(89±0.7) mg/100 g干物质(提取率为83%),提取率为传统水提法(约40%)的2倍。由于仙人掌梨果与火龙果属于同一种属,因此可预测该技术也可在火龙果源甜菜红素提取中取得较好的效果。
表2 火龙果源甜菜红素的提取
Table 2 Extraction methods of betacyanins from flesh and peel of pitaya
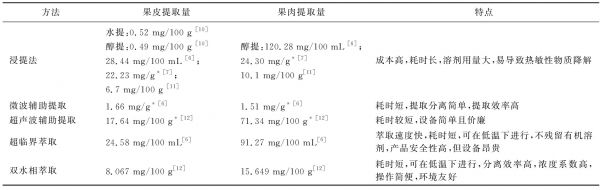
方法果皮提取量果肉提取量特点浸提法水提:0.52 mg/100 g [10]醇提:0.49 mg/100 g [10]28.44 mg/100 mL [6];22.23 mg/g* [7];6.7 mg/100 g [11]醇提:120.28 mg/100 mL [6];24.30 mg/g* [7]10.1 mg/100 g[11]成本高,耗时长,溶剂用量大,易导致热敏性物质降解微波辅助提取1.66 mg/g* [6]1.51 mg/g* [6]耗时短,提取分离简单,提取效率高超声波辅助提取17.64 mg/100 g* [12]71.34 mg/100 g* [12]耗时较短,设备简单且价廉超临界萃取24.58 mg/100 mL[6]91.27 mg/100 mL[6]萃取速度快,耗时短,可在低温下进行,不残留有机溶剂,产品安全性高,但设备昂贵双水相萃取8.067 mg/100 g[12]15.649 mg/100 g[12]耗时短,可在低温下进行,分离效率高,浓度系数高,操作简便,环境友好
注:*以干基计。
3 甜菜红素的稳定性研究进展
3.1 影响甜菜红素稳定性的因素
作为一种天然着色剂,甜菜红素易受加工或贮藏过程中一些外界因素(如pH、高温、光照、金属离子、水分活度、酶、抗氧化剂及食品添加剂等)的影响,发生脱糖作用、脱羧作用、脱氢作用及亲核攻击,导致颜色改变,在一定程度上限制了其在食品加工中的应用。
3.1.1 温度
在低于50 ℃时甜菜红素的稳定性较好,其保留率在25~50 ℃下随温度升高缓慢降低,当温度>50 ℃时快速下降,在75 ℃下保留率约86%[12]。高温会破坏甜菜红素的稳定性,在加热条件下会发生异构化、亲核攻击或脱羧而相应生成异甜菜苷、环多巴-5-O-葡萄糖苷或脱羧甜菜苷[14]。当温度超过50 ℃后甜菜红素将由紫红色变为橙红色[7]。火龙果汁中的甜菜红素在85 ℃加热1 h,会形成梨果仙人掌黄质和异梨果仙人掌黄质[9],这解释了甜菜红素在高温下变成黄色的原因。在生产含甜菜红素的产品时,建议避免高温加工以及低温贮运,以保持合理货架期。火龙果汁在4 ℃贮藏8周后,甜菜红素含量无显著性变化,而在25 ℃下贮藏则会导致其含量显著降低[15]。
3.1.2 pH
甜菜红素在pH 3~7稳定性较好。如图1所示,甜菜红素在不同pH值下具有不同的颜色响应,在pH 1~2时溶液呈现粉红色,pH 3~7时紫红色逐渐加深,pH 8~10时色泽转变为紫色,而pH 11~13时呈现黄色[16]。甜菜苷在碱性条件下发生亲核攻击生成环多巴-5-O-葡萄糖苷,该物质进一步氧化会形成类黑精;在酸的作用下,甜菜苷发生异构化、脱糖或脱氢反应,生成异甜菜苷、甜菜苷配基或新甜菜苷[14],这3种物质均呈现红色,这也很好地解释了甜菜红素“耐酸不耐碱”的现象。经过贮藏6 d,在pH 1~4时甜菜红素颜色由浅红变成淡黄色,pH 5~8时维持紫红色,pH 9~14也维持淡黄色[16],表明甜菜红素在强酸或碱性条件下稳定性较差。

图1 火龙果中甜菜红素在pH 1~13下的颜色变化[16]
Fig.1 Color changes of betacyanins extracted from red pitaya flesh within pH 1-13 [16]
3.1.3 光照
太阳光、室内光及紫外光等各种光的照射均会影响甜菜红素的稳定性,其中紫外光较蓝、红和绿光对其破坏性更大。经40 W紫外光(λ=275 nm)照射5 h后,甜菜红素发生光降解和氧化反应,甜菜红素溶液由紫红色变为橙红色,在日光照射8 h后也会出现相同的颜色反应[17]。通过对比发现,置于太阳光下6 d后,甜菜红素溶液红色褪去,而置于室内光下溶液的颜色较稳定,推测主要由于太阳光中含较强的紫外线[16],但短时(1~5 min)紫外照射对甜菜红素无影响[11]。此外,光照会缩短甜菜红素的半衰期,将喷雾干燥后的火龙果粉在25 ℃条件下贮藏,光照和避光条件下其半衰期分别为63周和154周[17]。
3.1.4 金属离子
金属离子如Fe2+、Fe2+、Cu2+、Al3+及Sn2+等的存在不利于甜菜红素的稳定性,Mg2+、Ca2+、Na+和K+等对其稳定性无影响[7, 12]。在0~150 mg/L,随着Cu2+和Fe2+浓度增加,甜菜红素保留率呈直线性降低趋势;且Cu2+较Fe2+的影响更大,添加150 mg/L的Cu2+后甜菜红素的保留率低于70%,同等浓度Fe2+处理后的保留率为80% [12]。AGNIESZKA等[18]研究表明,Cu2+使甜菜苷发生脱氢反应生成新甜菜苷,而新甜菜苷经氧化后会同时发生脱氢和脱羧反应生成2-脱羧-黄新甜菜苷。此外,FeCl3会导致甜菜红素由红色变成黄绿色,添加Al(NO3)3和CuSO4会导致其分别在贮藏5 d和1 d后变黄绿色和绿色[16]。
3.1.5 加工过程
3.1.5.1 热处理
热处理是食品中常用的加工方法。如图2所示,经热处理后甜菜红素的结构发生改变。随着热处理时间延长或温度升高,甜菜红素的降解率升高[19]。研究发现,经高温热处理5 h后,甜菜红素保留率仅有25%。有趣的是,较低温度长时间热处理后甜菜红素可再生。例如,在85 ℃加热1~3 h后,火龙果果汁中有10%甜菜红素再生[19];但加热4~5 h后甜菜红素再生率降低,主要是由于其初级热降解产物甜菜醛氨酸和环多巴5-O-β-葡萄糖苷在长时间加热下被进一步分解,抑制其再生。甜菜红素的热稳定性与其来源有关。研究表明,与甜菜根相比,红火龙果中的甜菜红素在经过50~100 ℃下热处理后在冷藏中具有更高的颜色保留率[17]。这可能与火龙果果汁中的酸度较高以及所含单体结构不同有关。在另一项研究中,将甜菜根和火龙果源的甜菜红素加入牛奶中,发现在50 ℃或85 ℃下巴氏杀菌后,含乳饮料中甜菜根源甜菜红素含量显著低于红火龙果源[20]。甜菜根中甜菜红素主要由甜菜苷和异甜菜苷组成,在长时间的加热下会降解为甜菜醛氨酸,在70 ℃下容易降解并热降解成甜菜黄素[19]。而火龙果源的甜菜红素含有较多的丙二酰甜菜苷,它对热处理较甜菜苷或异甜菜苷更稳定。即使经过热降解后丙二酰甜菜苷被分解为甜菜苷而非甜菜醛氨酸,从而使得体系中甜菜红素的损失降低。因此该研究也提示火龙果源甜菜红素较甜菜根源的更适合用于食品加工,毕竟目前热加工依然是最为常见的食品加工方法。
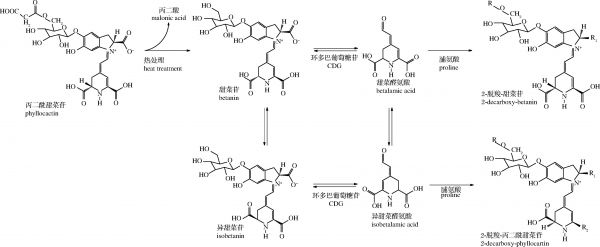
图2 火龙果源甜菜红素在热处理后的水解裂解和缩合反应
Fig.2 Hydrolytic cracking and condensation of betacyanins from pitaya fruit after heat treatment
注:CDG:cyclodopa glucoside,环多巴葡萄糖苷。
3.1.5.2 超声波加工
超声波加工是传统热处理的一种替代技术,由于超声波所产生空化气泡的破裂形成原位高温高压以及微射流很容易破坏生物细胞壁、并有利于胞内成分溶出,因此借助超声波以及热辅助超声波等技术可使液态物料中可溶性固形物释放到液质中,促进包括色素物质的释放。在相同提取温度和固液比的条件下,通过对比水浸提和超声波辅助萃取法,在25 ℃下以50 kHz超声波辅助萃取30 min,对火龙果果肉中甜菜红素的提取率达90.08%,远高于浸提法(73.27%);但在相同条件下对果皮中甜菜红素的提取率超声辅助并不具备优势,其提取率为浸提法的一半(47.07%)[13]。采取热辅助超声波作为杀菌技术,在达到相应保质期时,发现其对果汁中甜菜红素的保留率具备优势。例如,经过热辅助超声波处理后,在4 ℃贮存8周后甜菜红素保留率依然可达83%[21]。本团队的研究结果也表明,采用热辅助超声波处理(380 W、50 ℃、40 min)红肉火龙果汁,其中甜菜红素的保留率达到87.2%[22]。
3.1.5.3 高静压加工
高静压(high hydrostatic pressure,HHP)是一种非热加工技术,其对食品感官品质、理化指标和营养特性的不良影响较低。研究表明,经HHP处理(500 MPa、10 min)的火龙果果汁中甜菜红素含量为1.4~1.5 mg/g(干重),其保留率为92%~100%,可见HHP对甜菜红素影响甚微[23]。与火龙果源甜菜红素相似地,采用HHP处理仙人掌梨饮料时,发现在400 MPa时无影响;提高压强至550 MPa下处理2~4 min,其中甜菜红素增加4%~7%[24]。因此,未来可考虑采用HHP加工以更好地保留火龙果果汁及饮料中的甜菜红素。
3.1.5.4 喷雾干燥
喷雾干燥是现代食品工业中一种常见的干燥方法。将火龙果及果皮浆喷雾干燥成粉可在各类食品中用作天然着色剂,因为富含甜菜红素具备抗氧化活性。采用喷雾干燥发现火龙果皮浆粉中具有较高的甜菜素保留率和较低的水分活性,果皮粉颜色漂亮、溶解度和吸湿性能。高浓度的麦芽糊精和较低的喷雾干燥入口/出口温度可以使甜菜红素在干燥过程中更稳定,例如当入口和出口温度分别为155~175 ℃和75~85 ℃时,所得果粉中甜菜红素更稳定[25]。
3.1.6 抗氧化剂
食品加工中往往会添加抗氧化剂,其存在可通过移除体系中的氧以减少甜菜红素被氧化。常用的有抗坏血酸、生育酚、茶多酚等天然来源抗氧化剂。据报道适量抗坏血酸和异抗坏血酸等有助于提高甜菜红素的稳定性,可降低在85 ℃下加热1 h后火龙果汁的L*(亮度)和C*(彩度)变化,其中添加1.0%抗坏血酸效果最佳[9]。LEONG等[26]得到相似结果,添加0.1%~1%的抗坏血酸有助于提高在4℃和25℃贮藏10 d期间甜菜红素的保留率,且0.5%时效果最好。但TANG等[11]的结果表明,在pH 5.0时,添加0.7%抗坏血酸的甜菜红素溶液在25 ℃下放置12 h后,其保留率高达99%;当添加量大于0.7%后,抗坏血酸将变为促氧化剂,导致色素保留率随浓度增大而降低;此外,他们还发现添加0.25%抗坏血酸的色素提取液在贮藏期间色泽变化较对照组减小,尤其是a*(红绿)值。因此,在加工中应添加合适的抗氧化剂及适合剂量。
3.1.7 其他
加工及贮运中其他因素如碳水化合物、EDTA、食品添加剂、酚类物质及O2等的存在也可能影响甜菜红素的稳定性[7,16]。在有O2条件下甜菜红素不稳定,贮藏过程应尽量降低氧气浓度,以降低其氧化降解速率[27]。研究表明葡萄糖、木糖、蔗糖麦芽糖和乳糖在短时(24 h)内可以保护甜菜红素的颜色,添加0.2%~0.3%即可提高甜菜红素稳定性;而草酸、水杨酸和酒石酸不利于其稳定性[28]。此外,苯甲酸钠、EDTA和山梨醇等有利于甜菜红素保持红色;H2O2和淀粉会使溶液颜色变浅;没食子酸的羟基会和甜菜红素的羧基发生酯化反应,使其变成褐色[16, 28]。在ABTS阳离子自由基的作用下,甜菜苷会转化成2-脱羧-甜菜苷或2-脱羧-黄新甜菜苷[18],这对其稳定性十分不利。
综上可知,高温、强酸、强碱环境、光照、加工过程以及及金属离子对甜菜红素的影响较大,加工过程应尽量避免温度>50 ℃,pH<3,pH>7,各种光线的照射及Zn2+、Fe2+、Fe3+、Cu2+及Al3+等多种金属离子。
3.2 提高甜菜红素稳定性的方法
提高天然色素稳定性的方法主要包括添加稳定剂(β-胡萝卜素、抗坏血酸、异抗坏血酸等),辅色作用(分子间辅色、分子内辅色、自聚作用及金属螯合作用),微胶囊化,色素分子结构修饰及改善色素加工贮存环境等。常用于稳定甜菜红素的方法主要有添加稳定剂、辅色及微胶囊化。
3.2.1 添加稳定剂
抗坏血酸、异抗坏血酸、酚类物质及碳水化物等,在一定程度上可改善色素环境,有效地提高甜菜红素的稳定性。据报道[29]加入抗坏血酸可显著提高甜菜红素在贮藏期间的保留率,例如添加1%抗坏血酸的样品在光照条件下贮藏6个月后甜菜红素保留率超过70%,未添加组低于10%。茶多酚对甜菜红素也有保护作用,其效果弱于抗坏血酸。添加1 mg/mL茶多酚和1 mg/mL抗坏血酸的样品在常温下贮藏20 d后甜菜红素保留率分别为80%和90%,二者均高于未添加组(仅50%)。苯甲酸钠、甜菊糖和甜蜜素等食品添加剂对甜菜红素稳定性无影响[30]。此外,添加0.07%~1.12%山梨醇可在一定程度上延缓甜菜红素的降解,从而提高其在贮藏4 d内的保留率[28]。
3.2.2 辅色处理
辅色是指天然色素与辅色素之间通过分子内辅色、分子间辅色、自聚和金属螯合等几种途径实现呈色基团结构稳定和辅助呈色作用。已知植物中辅色素多达30多种,包括多酚类、类黄酮、生物碱、氨基酸、有机酸及多糖等[31]。例如,硒和抗坏血酸可以增强红色珊瑚浆果果汁中甜菜红碱的稳定性和颜色强度(色度)。在90 ℃热处理后,或在25 ℃贮存约3周后,纯化的甜菜苷最大紫外吸收波长红移9 nm [32]。徐馨等[28]研究表明0.01%~0.25% EDTA对甜菜红素有一定保护作用,未添加组和添加0.25% EDTA样品溶液在30 ℃下贮藏4 d后色素的保留率分别为53%和70%。提取物中微量Fe3+、Al3+等金属离子会干扰色素稳定性,加入EDTA后这些金属离子被螯合形成稳定的化合物,从而减少金属离子对甜菜红素稳定性的影响[28]。LIMA等[33]将γ-氧化铝、Mg-AlO、Mg、Zn-AlO和沸石用于甜菜红素的吸附和隔离,通过核磁共振波谱等观察到γ-氧化铝中甜菜碱的吸附可以通过酸碱相互作用使色素保持20个月以上。
3.2.3 微胶囊化
微胶囊化是利用多糖或蛋白质等作为壁材将色素包埋,再经喷雾干燥后得到粉末状物质,以阻隔空气、水分及光照等外界条件的干扰,从而实现提高色素稳定性的一种较为常用方法。许多研究表明麦芽糊精作为壁材的稳定效果较好。例如,麦芽糊精包埋的甜菜红素在贮藏期间抗热能力最强,保证了结构完整性,且半衰期(t1/2)较长,平均保质期为53周[34]。类似研究中,在避光条件下贮藏6个月,包埋后甜菜红色素保留率高达75%[34]。与未改性淀粉微胶囊相比,利用改性淀粉包埋火龙果源甜菜红素具有更好的着色力和稳定性。以菊粉和乳清蛋白混合使用比单独使用麦芽糊精进行包埋的色素稳定性更好。此外,海藻酸盐也被用于其他来源甜菜红素的微胶囊化。例如,在pH 3.0下,添加刺槐豆胶、海藻酸盐和阿拉伯胶显著改善了甜菜红素经HHP处理后的颜色稳定性[35]。
综上,可在允许条件下,通过添加适量抗坏血酸、山梨醇及EDTA等来提高甜菜红素的稳定性;也可通过制备微胶囊以延长色素的着色力及贮藏期。
4 火龙果源甜菜红素的应用
根据食品安全国家标准(GB 2760—2014),甜菜红素作为着色剂可按需适量添加到相关食品中。由于其结构的特殊性,除着色作用外甜菜红素还可以作为天然抗氧化剂、抑菌剂和指示剂。以下将介绍火龙果源甜菜红素的应用及相关研究进展。
4.1 着色剂
甜菜红素亲水性较强,尤其在液态食品中的着色能力较好。甜菜红素在酸奶中着色性好,色泽均匀,产品色泽与一种商业化草莓味酸奶的色泽可接受度相似其加入同时增加了酸奶的自由基清除能力[36]。火龙果皮中的甜菜红素在饮料、布丁、干制面条中着色均匀,色泽诱人且稳定;但在蛋糕中着色效果差[37]。这是由于甜菜红素为水溶性色素,而蛋糕制作过程中需加入大量油脂导致其难着色。果冻和酒等产品中也可加入甜菜红素,其最佳添加量分别为40 mg/100 g和23 mg/100 mL[38]。火龙果含有丰富的营养元素,可将火龙果作为原料应用于乳制品和复合果蔬汁中并赋予亮丽色泽;也可将其中甜菜红素提取出来再添加,且由于火龙果源甜菜红素不存在土臭素和吡嗪类等不良风味,这在很大程度上扩大了其应用范围。
此外,甜菜红素在在纺织、化妆品及药品等领域也具有潜在的应用价值。已有报道从仙人掌果实中提取甜菜红素为天然染料,采用叶绿素a进行生物媒染,并应用超声波工艺对羊毛织物进行染色,使染料耗竭率在短时间内从30%提高到60%,所得织物样品具有良好的耐水洗、耐光、耐干湿摩擦牢度性能[39]。仙人掌果实源甜菜红素与火龙果源甜菜红素相似极高,且其加工处理更为简便;未来可考虑拓展火龙果源甜菜红素的应用范围,例如充分利用果皮中甜菜红素到纺织品着色中,以扩展其作为红-紫色系天然着色剂的应用领域。
4.2 抗氧化剂与抑菌剂
甜菜红素具有较好的抗氧化活性和抑菌作用。火龙果源甜菜红素对羟自由基、超氧阴离子自由基和DPPH自由基具有清除能力,其中对DPPH自由基的清除能力与维生素C相当;随着色素浓度增加,对自由基的清除能力越大[40]。将火龙果皮源甜菜红素制备成100 mg/L和1 000 mg/L的微胶囊,添加到肉糜中,可以抑制经HHP处理(500 MPa、10 min)后在4 ℃下贮藏9 d内其蛋白质的氧化过程,最大限度减少贮藏中肉糜纹理的变化[41]。相似的,从石竹目仙人掌科的仙人掌梨果中提取的甜菜红素也具有抗氧化和抑菌作用[42]。甜菜红素的亲水特性可使其通过破坏细胞膜或抑制蛋白质合成来抑菌。研究表明甜菜红素提取液可抑制金黄色葡萄球菌和蜡状芽孢杆菌等致病菌[42]。将其应用到切片牛肉和意大利香肠中,可抑制微生物生长、降低意大利香肠的硬度和咀嚼性、维持肉制品色泽、质地及营养,有效地延长货架期[43]。因此,虽然相关报道较少,上述结果表明火龙果源及相近种属仙人掌梨果中的甜菜红素不仅可作为天然着色剂,还可以作为抗氧化剂和抑菌剂加以开发和应用,未来还具有较大的研发和应用空间。
4.3 天然指示剂
基于在不同pH值下甜菜红素呈现不同颜色的特性,已有一些研究将其开发作为一种天然酸碱指示剂。将60%~100%的火龙果果皮浆和0%~4%的甘油作为成膜基质,通过调节成膜液的pH值可以制备指示膜用于猪肉包装,可达到肉眼识别并区分新鲜、次新鲜和腐败变质的猪肉[44]。将甜菜红素加入马铃薯淀粉中可以制备具有pH传感和氨敏感性的淀粉基薄膜,可以作为一种安全环保的智能包装材料,直观地辨别在冷藏过程中鱼的新鲜程度[45]。研究表明火龙果中甜菜红素可与羧甲基纤维素和甘油混合制成薄膜,可作为鳕鱼新鲜度的指示剂,通过对二甲胺的响应(红色→棕色→黄色)确定鳕鱼的腐败程度,且低色素添加量(10 g/L)的响应速度最快,变色程度最大[25]。与同色系的花青素相比,甜菜红素作为指示剂的研究相对较少,这是由于其对环境pH变化响应较花青素弱,但未来可以通过系统研究膜体系中甜菜红素浓度、初始pH、与成膜基质的结合方式,以及通过结构改性等方法来提高其指示敏感度,以用于不同智能食品包装中。此外,加入甜菜红素可以改善薄膜的相容性、溶胀性、机械性能、抗氧化活性和抗菌性能,这也可赋予甜菜红素膜更多的应用可能。
5 结论与展望
综上,本文主要对火龙果来源甜菜红素的提取、理化特征、稳定性及其应用进行综述,主要结论为:火龙果源甜菜红素主要由8种单体组成,其主要发色基团为1,7-二偶氮庚甲碱;目前主要的提取方法包括浸提法、微波辅助提取、超声波辅助提取、超临界萃取及双水相萃取;温度、pH、光照、金属离子等多种因素均会影响其稳定性,可通过加入稳定剂、辅色或微胶囊化来提高加工过程中甜菜红素的稳定性;甜菜红素可作为天然抗氧化剂、抑菌剂和酸碱指示剂广泛应用于食品领域。
基于前人相关研究及应用进展,建议今后在以下几个方面深入研究:一是可应用新兴技术优化甜菜红素的提取,或采取多技术联用以提高其提取得率。二是深入研究加工过程中甜菜红素的降解途径及其机制,以提高其稳定性。三是充分利用火龙果源甜菜红素不含土嗅味的优势,开发新产品,提高其在食品、化妆品及医药等方面的应用。
参考文献
[1] 蒋边. 火龙果色素研究进展[J]. 食品工程, 2015(4):6-10.
JIANG B. Research progress of pitaya pigment[J]. Food Engineering, 2015(4):6-10.
[2] 苗璇. 食用天然色素研究应用现状及其发展前景展望[J]. 化工管理, 2013(10):5-7; 9.
MIAO X. Research and application status and development prospect of edible natural pigment[J]. Chemical Enterprise Management, 2013(10):5-7; 9.
[3] CELLI G B, BROOKS M S L. Impact of extraction and processing conditions on betalains and comparison of properties with anthocyanins—a current review[J]. Food Research International, 2017, 100:501-509.
[4] 张玉霜, 许庆轩, 李红侠, 等. 甜菜色素种类分布和应用研究进展[J]. 中国农学通报, 2015, 31(24):149-156.
ZHANG Y S, XU Q X, LI H X, et al. Progress of application and distribution of betalains[J]. Chinese Agricultural Science Bulletin, 2015, 31(24):149-156.
[5] YAO X Y, QIN Y, ZHANG M, et al. Development of active and smart packaging films based on starch, polyvinyl alcohol and betacyanins from different plant sources[J]. International Journal of Biological Macromolecules, 2021, 183:358-368.
[6] FATHORDOOBADY F, MIRHOSSEINI H, SELAMAT J, et al. Effect of solvent type and ratio on betacyanins and antioxidant activity of extracts from Hylocereus polyrhizus flesh and peel by supercritical fluid extraction and solvent extraction[J]. Food Chemistry, 2016, 202:70-80.
[7] 陈冠林. 红肉火龙果色素提取、纯化及其抗氧化、降血脂作用的研究[D]. 广州: 广东药学院, 2013.
CHEN G L. Studies on extraction, purification, antioxidant and lipid-regulating effects of pigments from red pitaya[D].Guangzhou: Guangdong Pharmaceutical University, 2013.
[8] 朱文娴, 夏必帮, 廖红梅, 等. 四种红肉火龙果品种制汁适宜性评价研究[J]. 食品与发酵工业, 2020, 46(3):167-173.
ZHU W X, XIA B B, LIAO H M, et al. Evaluation of suitability of four red pitahaya varieties for juice pressing[J]. Food and Fermentation Industries, 2020, 46(3):167-173.
[9] HERBACH K M, ROHE M, STINTZING F C, et al. Structural and chromatic stability of purple pitaya (Hylocereus polyrhizus[Weber]Britton &Rose) betacyanins as affected by the juice matrix and selected additives[J]. Food Research International, 2006, 39(6):667-677.
[10] PRIATNI S, PRADITA A. Stability study of betacyanin extract from red dragon fruit (Hylocereus polyrhizus) peels[J]. Procedia Chemistry, 2015, 16:438-444.
[11] TANG C S, NORZIAH M H. Stability of betacyanin pigments from red purple pitaya fruit (Hylocereus polyrhizus): Influence of pH, temperature, metal ions and ascorbic acid[J]. Indonesian Journal of Chemistry, 2010, 7(3): 327-331.
[12] RAMLI N S, ISMAIL P, RAHMAT A. Influence of conventional and ultrasonic-assisted extraction on phenolic contents, betacyanin contents, and antioxidant capacity of red dragon fruit (Hylocereus polyrhizus)[J]. The Scientific World Journal, 2014, 2014:964731.
[13] NUNES A N, SALDANHA DO CARMO C, DUARTE C M M. Production of a natural red pigment derived from Opuntia spp. using a novel high pressure CO2 assisted-process[J]. RSC Advances, 2015, 5(101):83106-83114.
[14] STINTZING F C, CARLE R. Functional properties of anthocyanins and betalains in plants, food, and in human nutrition[J]. Trends in Food Science &Technology, 2004, 15(1):19-38.
[15] SIOW L F, WONG Y M. Effect of juice concentration on storage stability, betacyanin degradation kinetics, and sensory acceptance of red-fleshed dragon fruit (Hylocereus polyrhizus) juice[J]. International Journal of Food Properties, 2017, 20(3):623-632.
[16] 郑舒文. 基于红肉火龙果色素的鱼鲜度检测智能包装的研究与制作[D]. 北京: 中国农业科学院, 2019.
ZHENG S W. Research and preparation of intelligent packaging for fish freshness detection based on red dragon fruit pigment[D].Beijing: Chinese Academy of Agricultural Sciences, 2019.
[17] SHAARUDDIN S, GHAZALI H M, HAMED MIRHOSSEINI S, et al. Stability of betanin in pitaya powder and confection as affected by resistant maltodextrin[J]. LWT, 2017, 84:129-134.
[18] KUMORKIEWICZ A, SZMYR N, POPENDA , et al. Alternative mechanisms of betacyanin oxidation by complexation and radical generation[J]. Journal of Agricultural and Food Chemistry, 2019, 67(26):7455-7465.
[19] HERBACH K M, STINTZING F C, CARLE R. Thermal degradation of betacyanins in juices from purple pitaya [Hylocereus polyrhizus (Weber) Britton &Rose] monitored by high-performance liquid chromatography-tandem mass spectometric analyses[J]. European Food Research and Technology, 2004, 219(4): 377-385.
[20] GOKHALE S V, LELE S S. Betalain content and antioxidant activity of Beta vulgaris: Effect of hot air convective drying and storage[J]. Journal of Food Processing and Preservation, 2014, 38(1):585-590.
[21] ZHU W X, AI Y N, FANG F, et al. Application of thermosonication in red pitaya juice processing: Impacts on native microbiota and quality properties during storage[J]. Foods, 2021, 10(5):1041.
[22] LIAO H M, ZHU W X, ZHONG K, et al. Evaluation of colour stability of clear red pitaya juice treated by thermosonication[J]. LWT, 2020, 121:108997.
[23] SANDATE-FLORES L, DE J ROSTRO-ALANIS M, MANCERA-ANDRADE E I, et al. Using high hydrostatic pressures to retain the antioxidant compounds and to reduce the enzymatic activity of a pitaya-pineapple (Stenocereus sp.-Fragaria ananassa) beverage[J]. Journal of Food Science and Technology, 2017, 54(3):611-619.
[24] JIMÉNEZ-AGUILAR D M, ESCOBEDO-AVELLANEDA Z, MARTN-BELLOSO O, et al. Effect of high hydrostatic pressure on the content of phytochemical compounds and antioxidant activity of prickly pears (Opuntia ficus-indica) beverages[J]. Food Engineering Reviews, 2015, 7(2):198-208.
[25] BAKAR J, EE S C, MUHAMMAD K, et al. Spray-drying optimization for red pitaya peel (Hylocereus polyrhizus)[J]. Food and Bioprocess Technology, 2013, 6(5):1332-1342.
[26] LEONG H Y, OOI C W, LAW C L, et al. Investigation of betacyanins stability from peel and flesh of red-purple pitaya with food additives supplementation and pH treatments[J]. LWT, 2018, 98:546-558.
[27] ATTOE E L, VON ELBE J H. Degradation kinetics of betanin in solutions as influenced by oxygen[J]. Journal of Agricultural and Food Chemistry, 1982, 30(4):708-712.
[28] 徐馨, 李霞, 丁金龙. 食品添加剂对火龙果皮红色素稳定性的影响[J]. 中国食品添加剂, 2018(4):141-147.
XU X, LI X, DING J L. Effect of food-additives on the stability of red pigment from pitaya peel[J]. China Food Additives, 2018(4):141-147.
[29] HERBACH K M, MAIER C, STINTZING F C, et al. Effects of processing and storage on juice colour and betacyanin stability of purple pitaya (Hylocereus polyrhizus) juice[J]. European Food Research and Technology, 2007, 224(5):649-658.
[30] 王春丽. 红甜菜甜菜红素的稳定性及降血脂作用研究[D]. 哈尔滨: 东北林业大学, 2011.
WANG C L. Study on the stability and hypolipidemic effect of betacyanin from red beet[D].Harbin: Northeast Forestry University, 2011.
[31] MAZZA G, BROUILLARD R. The mechanism of co-pigmentation of anthocyanins in aqueous solutions[J]. Phytochemistry, 1990, 29(4):1097-1102.
[32] KHAN M I, GIRIDHAR P. Enhanced chemical stability, chromatic properties and regeneration of betalains in Rivina humilis L. berry juice[J]. LWT-Food Science and Technology, 2014, 58(2):649-657.
[33] LIMA E, BOSCH P, LOERA S, et al. Non-toxic hybrid pigments: Sequestering betanidin chromophores on inorganic matrices[J]. Applied Clay Science, 2009, 42(3-4):478-482.
[34] GANDA-HERRERO F, CABANES J, ESCRIBANO J, et al. Encapsulation of the most potent antioxidant betalains in edible matrixes as powders of different colors[J]. Journal of Agricultural and Food Chemistry, 2013, 61(18):4294-4302.
[35] SELIG M J, CELLI G B, TAN C, et al. High pressure processing of beet extract complexed with anionic polysaccharides enhances red color thermal stability at low pH[J]. Food Hydrocolloids, 2018, 80:292-297.
[36] GENGATHARAN A, DYKES G A, CHOO W S. The effect of pH treatment and refrigerated storage on natural colourant preparations (betacyanins) from red pitahaya and their potential application in yoghurt[J]. LWT, 2017, 80:437-445.
[37] 贺江, 刘蕊, 韩淯欣, 等. 火龙果果皮色素提取及其性质与应用[J]. 江苏农业科学, 2017, 45(21):213-215.
HE J, LIU R, HAN Y X, et al. Extraction, properties and application of pigment from pitaya peel[J]. Jiangsu Agricultural Sciences, 2017, 45(21):213-215.
[38] 陈艳红, 陈慧蓉, 李爱贞, 等. 火龙果果皮红色素的微波提取工艺及其应用[J]. 激光生物学报, 2013, 22(2): 185-192.
CHEN Y H, CHEN H R, LI A Z, et al. Microwave extraction of red pigment from the peel of pitaya fruit and its application[J]. Journal of Laser Biology, 2013, 22(2): 185-192.
[39] GUESMI A, LADHARI N, BEN HAMADI N, et al. First application of chlorophyll-a as biomordant: Sonicator dyeing of wool with betanin dye[J]. Journal of Cleaner Production, 2013, 39:97-104.
[40] 黎海利, 刘锴栋, 袁长春, 等. 红肉火龙果果皮色素提取工艺优化及其抗氧化活性[J]. 食品与发酵工业, 2014, 40(12):203-209.
LI H L, LIU K D, YUAN C C, et al. Extraction and antioxidant activity of pigment from red pitaya peel[J]. Food and Fermentation Industries, 2014, 40(12):203-209.
[41] CUNHA L C M, MONTEIRO M L G, COSTA-LIMA B R C, et al. Effect of microencapsulated extract of pitaya (Hylocereus costaricensis) peel on color, texture and oxidative stability of refrigerated ground pork patties submitted to high pressure processing[J]. Innovative Food Science &Emerging Technologies, 2018, 49:136-145.
[42] TENORE G C, NOVELLINO E, BASILE A. Nutraceutical potential and antioxidant benefits of red pitaya (Hylocereus polyrhizus) extracts[J]. Journal of Functional Foods, 2012, 4(1):129-136.
[43] PALMERI R, PARAFATI L, RESTUCCIA C, et al. Application of prickly pear fruit extract to improve domestic shelf life, quality and microbial safety of sliced beef[J]. Food and Chemical Toxicology, 2018, 118:355-360.
[44] AI Y N, WANG G X, FANG F, et al. Development of real-time intelligent films from red pitaya peel and its application in monitoring the freshness of pork[J]. Journal of the Science of Food and Agriculture, 2022, 102(12):5512-5522.
[45] NAGHDI S, REZAEI M, ABDOLLAHI M. A starch-based pH-sensing and ammonia detector film containing betacyanin of paperflower for application in intelligent packaging of fish[J]. International Journal of Biological Macromolecules, 2021, 191:161-170.
相关知识
火龙果的食用功效与保健作用
植物蛋白肉研究进展
火龙果的5大功效
孕妇叶酸正确服用率及其影响因素研究进展
国内大数据与膳食营养健康的研究及应用进展
健康照明应用研究发展与展望
研究进展
黑龙江省利用优质生态资源发展健康养生游
夏季吃火龙果有什么好处?
适合减肥的3款火龙果营养餐
网址: 火龙果来源甜菜红素的研究及应用进展 https://www.trfsz.com/newsview306523.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






