菊苣化学成分及其药理作用研究进展
Abstract: Cichorium intybus which is widely distributed in China, has been used as Uygur folk medicines for years. From the phytochemical view, the second metabolites such as polysaccharides, triterpenes, flavonoids, phenolic acids, and sesquiterpene lactone had been reported from this species. The pharmacological research mainly focused on their hepatoprotective, antibacterial, hypoglycemic, hypolipidemic, and antihyperuricemic activities. The present paper reviews the phytochemistry and biological activities of C. intybus through accessing Web of Science and multiple databases for biomedical sciences.
Key words:Cichorium intybus L. sesquiterpene lactone polysaccharides hepatoprotective effect hypoglycemia
菊苣Cichorii Herba为菊科(Compositae)植物菊苣Cichorium intybus L. 及毛菊苣Cichorium glandulosum Boiss. et Hout的干燥地上部分或根,又名蓝菊,维语称“卡申纳”,作为维吾尔族习用药材收载于《新疆中草药手册》[1],其性味微苦、咸、凉,具有清肝利胆、健胃消食、利尿消肿之功效,用于治疗湿热黄疸、胃痛食少、水肿尿少等病症[2]。除药用外,菊苣还作为牧草和蔬菜广泛应用,其作为保健饮品和功能性食品也受到了国际保健食品界的青睐。文献研究发现,针对菊苣药材的化学成分和药理活性研究主要集中在菊苣C. intybus上,本文对近年来有关菊苣C. intybus的化学成分和药理作用研究进展进行了总结,以期为菊苣的深入研究和利用提供参考。
1 化学成分
目前从菊苣中已分离得到多糖类、萜类(尤其是倍半萜类)、黄酮类、酚酸类化合物和多种维生素、金属元素等化学成分。
1.1 多糖类
菊苣中存在大量的糖类成分,如葡萄糖、果糖、蔗糖和多糖等,其中多糖类成分中以菊粉居多,此外还有糊精和淀粉[3, 4]。
菊粉是贮存多糖,在菊苣根中的量丰富,主要由1个线性的以C-2→1位连接的β-D-呋喃果糖单元和终端为C-1→2位连接α-D-吡喃葡萄糖的果聚糖聚合而成,其分子链长度的多分散性取决于植物的生命周期。菊粉具有不寻常柔性构象,源于其呋喃环并非聚氧乙烯类大分子主链的一部分[5]。
1.2 萜类化合物 1.2.1 倍半萜类
倍半萜内酯是菊苣苦味的原因,山莴苣素(1)、山莴苣苦素(2)、8-脱氧山莴苣素(3)和11β,13-二氢山莴苣苦素(7)是其主要苦味成分[6]。由于日光可诱发内酯双键水合,因此,提取菊苣中的倍半萜内酯类成分需要低温、避光处理[7]。菊苣中发现的倍半萜类化合物可分为3类:愈创木烷型内酯类(guaianolide)、桉烷型内酯类(eudesmane)和吉马烷型内酯类(germacrane),目前已分离鉴定的倍半萜类化合物见表 1和图 1。
 表 1 菊苣中倍半萜类成分Table 1 Sesquiterpenes in Cichorii Herba
表 1 菊苣中倍半萜类成分Table 1 Sesquiterpenes in Cichorii Herba 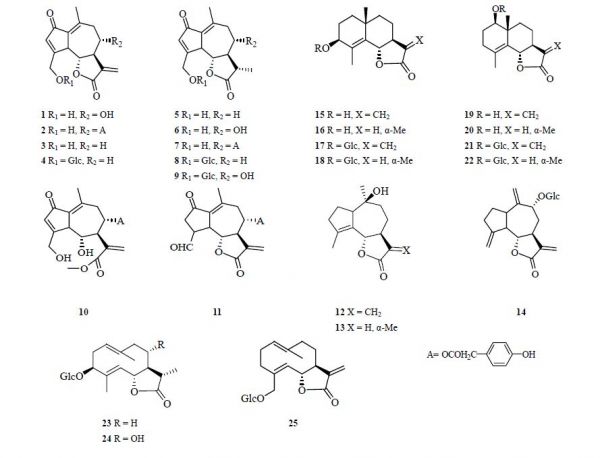 图 1 菊苣中倍半萜类化合物的化学结构Fig. 1 Chemical structures of sesquiterpenoids in Cichorii Herba
图 1 菊苣中倍半萜类化合物的化学结构Fig. 1 Chemical structures of sesquiterpenoids in Cichorii Herba 1.2.2 三萜类
目前,从菊苣中发现的三萜类化合物主要有乙酸降香萜烯醇酯(26)、α-香树脂醇(27)、蒲公英萜酮(28)、伪蒲公英甾醇(29)等[18],其结构见图 2。
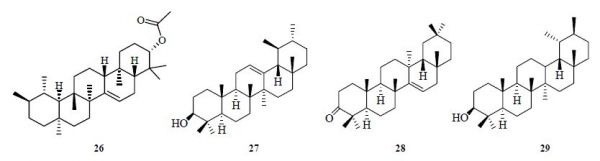 图 2 菊苣三萜类化合物的化学结构Fig. 2 Chemical structures of triterpenoids in Cichorii Herba
图 2 菊苣三萜类化合物的化学结构Fig. 2 Chemical structures of triterpenoids in Cichorii Herba 1.3 黄酮类化合物
黄酮类化合物广泛分布于植物界,在菊苣地上部分也发现了黄酮类化合物(30~36),主要包括黄酮类和黄酮醇类[19, 20, 21, 22]。另外,在菊苣根部发现了山柰酚(37)。高华杰等[23]研究发现菊苣的变种结球红菊苣Cichorium intybus var. foliosum Hegi. 的鲜艳花瓣中含4种主要花色苷成分,分别为矢车菊素- 3-O-葡萄糖苷(38)、矢车菊素-3-丙二酰半乳糖苷(39)、矢车菊素-3-丙二酰葡萄糖苷(40)[24]、矢车菊素-3-琥珀酰葡萄糖苷(41),其中化合物40量最高,占花色苷总量的82.01%。目前从菊苣中分离鉴定的黄酮类化合物及其结构见图 3和表 2。
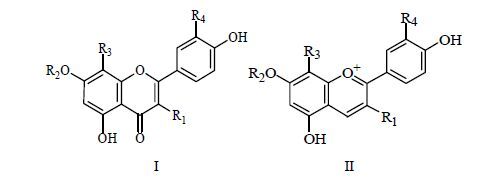 图 3 菊苣中黄酮类化合物母核结构Fig. 3 Skeletons of flavonoids in C. intybus and C. intybus var. foliosum
图 3 菊苣中黄酮类化合物母核结构Fig. 3 Skeletons of flavonoids in C. intybus and C. intybus var. foliosum  表 2 菊苣中黄酮类化合物Table 2 Flavonoids in Cichorii Herba
表 2 菊苣中黄酮类化合物Table 2 Flavonoids in Cichorii Herba 1.4 酚酸类化合物
菊苣常被作为咖啡的替代品,主要与其含有酚酸类成分有关。据报道,菊苣中的酚酸类成分主要为咖啡酸衍生物,其中菊苣酸(43)量最高,另外还有咖啡酸(42)、单咖啡酰酒石酸(44)、绿原酸(45)、3,5-二咖啡酰奎宁酸(46)、4,5-二咖啡酰奎宁酸(47)等[25, 26, 27],其结构见图 4。
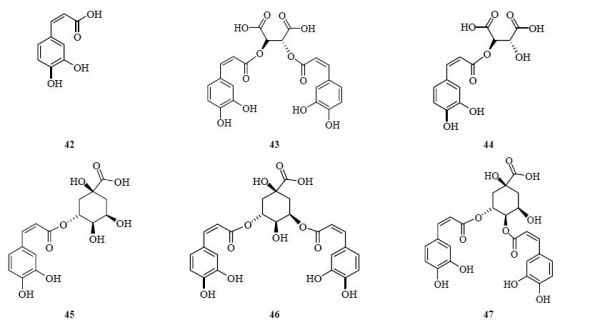 图 4 菊苣中酚酸类成分Fig. 4 Main phenols in Cichorii Herba
图 4 菊苣中酚酸类成分Fig. 4 Main phenols in Cichorii Herba 1.5 苯丙素类成分
菊苣中含有常见的苯丙素类化合物,如香豆素(48)、伞形花内酯(49)、秦皮乙素(50)、秦皮甲素(51)、野莴苣苷(52)、东莨菪内酯(53)[28]。Malarz等[26]从带须根的菊苣根中分离出1个新的木脂素苷,经鉴定为 (7S,8R)-3′-去甲基-去氢二松柏醇-3′-O-β-吡喃葡萄糖苷(54)。Kisiel等[29]用甲醇完全提取菊苣叶片冻干愈伤组织,得到紫丁香苷(55)及其蜂胶木脂素类衍生物4α-4′-O-hydroxysyring-aresinol(56)、4α-hydroxy- syringaresinol-4′-O-β-glucopyranosides(57)、4β- hydroxysyringaresinol-4′-O-β-glucopyranosides(58)和4氧代丁香脂素葡萄糖苷(59)等[30],其结构见图 5。
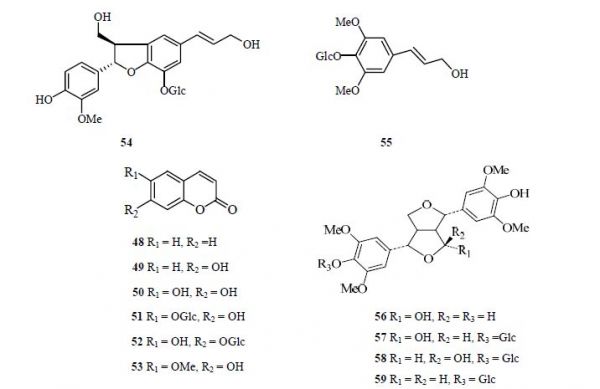 图 5 菊苣苯丙素类化合物Fig. 5 Main phenylpropanoids in Cichorii Herba
图 5 菊苣苯丙素类化合物Fig. 5 Main phenylpropanoids in Cichorii Herba 1.6 其他成分
从菊苣中还检测到多种脂肪酸如棕榈酸、硬脂酸、油酸及其他多种挥发性成分[31, 32]。此外,菊苣中还含有双乙酰-β-戊烷二酮、糠醛、5-羟甲基糠醛、麦芽酚、甲基呋喃醇、乙酸丙酮酸、乳酸糖和2,3,4,9-四氢-1H-吡啶并-(3,4b)-吲哚-3-羧酸[33, 34]。其他成分还有戊乙醛、橙黄胡椒酰胺、对羟基苯乙酸甲酯、2-乙酰基吡咯、4-乙酰基吡咯、香草醛等[35, 36]。菊苣叶中含有丰富的维生素A、B1、B2、C和胡萝卜素[37]以及钙、镁、钠、钾、铁、锌和锰等金属元素[38]。
2 药理活性 2.1 保肝活性
现代药理学研究证明,菊苣具有显著的保肝活性。Heibatollah等[39]研究发现菊苣地上部分50%乙醇提取物对四氯化碳(CCl4)诱导的肝损伤大鼠具有保肝作用。Saggu等[40]通过检验肝细胞增殖细胞核抗原PCNA和DNA片段,探究菊苣果实甲醇提取物对4-叔辛基酚诱导的肝损伤雄性大鼠的改善作用,证实菊苣果实提取物能显著降低4-叔辛基酚对肝脏的毒性。此外,通过对过氧化氢诱导的毒性HepG2细胞系进行测试,发现菊苣叶黄酮提取物可使细胞损伤恢复,并呈现浓度依赖性,推测菊苣黄酮类化合物可能是其发挥肝保护作用的有效成分[41, 42]。
Zafar等[43]考察菊苣根和根愈伤组织水提取物对CCl4诱导的肝损伤大鼠的抗肝毒性作用,发现2种提取物均可使CCl4处理动物的相关血清酶活性大大减少,后者效果更突出。秦冬梅等[44]通过观察模型动物的肝脏、脾脏指数,相关血清酶活性水平和肝脏病理组织学变化等指标,验证菊苣根提取物中脂溶性成分和水溶性成分对化学性或酒精性肝损伤均具有显著的保护作用。
另有研究表明,菊苣50%乙醇提取物的保肝作用机制可能是其显著的抗氧化活性,同时预防肝细胞抗氧化物质的耗尽,防止脂质过氧化,从而防止其DNA损伤。此外,菊苣根提取物可加速磷脂合成,加快肝细胞修复速度[45]。
2.2 抗菌活性
菊苣地上部分和根提取物具有显著的抗菌活性。Rani等[46]运用纸片扩散法发现菊苣叶的甲醇提取物对伤寒沙门氏菌具有中度的抗菌活性。通过体外琼脂扩散法对菊苣根提取物的抑菌活性进行研究,发现菊苣根醋酸乙酯提取物比其他溶剂提取物表现出更强的抑菌活性,该提取物对枯草芽孢杆菌、金黄色葡萄球菌、伤寒沙门氏菌的抑制作用强于藤黄微球菌和大肠杆菌[47, 48]。
菊苣根提取物还有很强的抗真菌活性。徐雅梅等[49]发现菊苣根乙醇和醋酸乙酯提取物均有一定的抑制植物病原真菌和细菌活性,醋酸乙酯提取物抗菌效果更佳。Koner等[50]通过硅胶柱色谱得到的菊苣根醋酸乙酯馏份具有抑制酵母和霉菌生长的活性,但其正己烷提取物则无显著活性,表明其抗菌成分应是其极性化合物。
Mares等[51]研究发现菊苣提取物可抑制动物和人皮肤癣菌的生长,并从提取物中筛选出倍半萜内酯类化合物山莴苣素(1)、山莴苣苦素(2)、8-脱氧山莴苣素(3)和11β,13-二氢山莴苣素(6)。Papetti等[52]运用HPLC-DAD-MS2分析具有抗菌活性的菊苣提取物,发现该提取物中含有大量有机酸成分,这些成分可阻止导致牙龈炎、蛀牙的口腔病原体的生长,具有干扰口腔病原菌形成生物膜的能力。
2.3 降糖活性
Pushparaj等[53]研究发现菊苣全草80%乙醇提取物能降低链脲佐菌素诱导的糖尿病模型大鼠的肝葡萄糖-6-磷酸酶活性,从而降低肝葡萄糖的产生,口服葡萄糖耐量实验显示,菊苣提取物在剂量为125 mg/kg时降血糖作用最强。
咖啡酸和绿原酸(CGA)是单咖啡酰酯,为潜在的抗糖尿病先导化合物。Tousch等[54]报道了从菊苣中分离纯化的二咖啡酰菊苣酸(CRA)对葡萄糖摄取和胰岛素分泌的影响,结果表明CRA和CGA能增加L6肌细胞葡萄糖的吸收,同时刺激INS-1E细胞和大鼠胰岛细胞分泌胰岛素。膜片钳研究表明,CRA和CGA并不是通过关闭ATP敏感性钾通道(KATP通道)来发挥降血糖作用,说明降血糖机制不同于磺脲类药物。另有研究发现[55],菊苣提取物对葡萄糖摄取有促进作用,该作用源于其对肌肉葡萄糖摄取的外周效应,而非同CGA一样产生对肝葡萄糖-6-磷酸酶的抑制作用。
Muthusamy等[56, 57]运用放射性标记的葡萄糖摄取和脂质的积累检测分析菊苣叶甲醇提取物(CME)对葡萄糖转运和3T3-L1脂肪细胞分化的影响,验证了CME中的鞣酸成分可通过抑制蛋白质酪氨酸磷酸酶1B(PTP1B)而降低血糖水平,而对于非胰岛素依赖型糖尿病不能诱导3T3-L1脂肪细胞合成脂肪,同时发现CGA与CME存在协同效应。
2.4 调血脂和抗高尿酸血症活性
鲁友均等[58]研究了菊苣根水提物和菊粉对血清脂质、蛋黄三酰甘油和胆固醇的影响,结果显示菊苣提取物和菊粉均具有调血脂活性,且前者活性更强;此外还发现菊苣根水提物还具有降低蛋黄三酰甘油和胆固醇的作用。张泽生等[59]研究发现菊苣仔根水提物和75%乙醇提取物对高脂血症仓鼠血脂水平均具有调节作用,并能抑制脂质过氧化。其中乙醇提物降低总胆固醇、三酰甘油水平的效果略优于水提物,而水提物对高密度脂蛋白胆固醇水平的升高作用更加明显。
孔悦等[60, 61]观察菊苣提取物对高尿酸、高三酰甘油血症鹌鹑血脂、血尿酸的影响,结果显示菊苣提取物能显著降低模型动物血清中的尿酸和三酰甘油水平,提示菊苣提取物具有调血脂和降尿酸的功能,对高尿酸高三酰甘油血症具有较好的调节作用,但是对胆固醇水平没有明显影响。此外,萨翼等[62]还发现高、中剂量的菊苣提取物能降低血清黄嘌呤氧化酶活性。
菊苣提取物可显著降低高三酰甘油、高尿酸并高血糖交互紊乱大鼠的血清三酰甘油、尿酸、血糖水平,其作用机制与抑制脂肪酸合成酶及血清黄嘌呤氧化酶活性、增加血清胰岛素有关[63]。李慧等[64]研究发现,菊苣有效组分可显著降低由高血糖引发的血清三酰甘油、尿酸、血糖升高,其作用机制可能是通过降低肝脏脂肪酸合成酶活性和血清游离脂肪酸水平,并升高心肌脂蛋白脂酶和肝脏肝脂酶活性来达到综合调节脂、糖、尿酸交互紊乱的作用。黄胜男等[65]研究发现菊苣能有效降低高尿酸血症模型鹌鹑尿酸水平,可能与其降低尿酸代谢酶5'-核苷酸酶、腺苷脱氨酶、嘌呤核苷磷酸化酶、鸟嘌呤脱氨酶、黄嘌呤氧化酶的活性有关。朱春胜等[66]对菊苣降尿酸作用进行了谱效关系研究,结果表明菊苣地上部分具有较好的降尿酸药效,其中,绿原酸、菊苣酸等化合物对降尿酸药效的贡献度较大。
另外,林志健等[67]证实菊苣提取物可明显改善由高嘌呤饮食引发的高尿酸血症及腹型肥胖,其作用机制可能是通过降低肝脏乙酰辅酶A羧化酶、脂肪酸合成酶及黄嘌吟氧化酶活性,从而发挥综合调节尿酸及腹部脂肪堆积的作用。
2.5 抗氧化和抗炎活性
菊苣根、茎叶和种子含有不同的抗氧化成分[68]。研究表明,菊苣叶的甲醇提取物对1,1-二苯基-2-三硝基苯肼(DPPH)具有较高的清除能力,其IC50值为67.2 μg/mL[38]。
Minaiyan等[69]用不同剂量的菊苣根和地上部分的70%乙醇提取物分别处理胰腺炎雄性小鼠,考察结果显示iv和ig菊苣提取物均能有效降低小鼠体内淀粉酶和脂肪酶水平,且能减少炎症特征,证实菊苣提取物能有效防止实验性急性胰腺炎。
2.6 其他活性 2.6.1 杀虫作用
Mansour等[31]分别用石油醚、氯仿、醋酸乙酯和甲醇连续提取菊苣全草药材粉末,毒性筛选结果显示石油醚和氯仿提取物对蚊幼虫、成虫和家蝇具有高效杀除能力。孙娈姿等[70, 71]采用冷浸和超声波提取相结合的方法,分别获得了菊苣叶片醋酸乙酯、乙醚和石油醚提取物,应用饲喂称重法及叶碟法研究3种提取物对黏虫幼虫生长发育的影响及拒食效应,结果表明3种提取物对黏虫均有抑制生长发育及致死作用,其中醋酸乙酯提取物活性最强。Molan等[72]考察从菊苣中提取的缩合鞣质和倍半萜苷内酯粗品对体外1级和3级鹿肺线虫幼虫以及3级消化道线虫运动的作用,发现缩合鞣质对所有实验幼虫均有较强抑制活性,而倍半萜苷内酯对胃液中3级线虫幼虫的运动具有选择性抑制作用,这些次生代谢物的活性解释了菊苣能减少寄生虫的原因。
2.6.2 镇痛镇静作用
Wesołowska等[73]研究发现,菊苣具有苦味的倍半萜内酯山莴苣素(1)及其衍生物山莴苣苦素(2)和11β,13-二氢山莴苣素(6)对小鼠有镇痛和镇静作用,其中山莴苣苦素镇痛效果最强,山莴苣素和山莴苣苦素在小鼠自发活动实验中也表现出了镇静作用。
2.6.3 促进伤口愈合
在土耳其民间菊苣被用于医治伤口愈合。Süntar等[74]研究表明,菊苣的甲醇提取物显示促进伤口愈合的作用,β-谷甾醇被认为是其活性成分,其作用机制可能是由于其显著的抗炎和抗氧化作用,以及对透明质酸酶和胶原酶的抑制作用。
2.6.4 提高免疫功能
Kim等[75]研究表明,菊苣乙醇提取物不仅可显著增加乙醇中毒小鼠循环系统中白细胞的数量和相关器官肝脏、脾脏、胸腺的相对质量,还可显著增加小鼠迟发型超敏反应,吞噬活性、自然杀伤细胞活性和细胞增殖以及γ干扰素的分泌,证实菊苣乙醇提取物可以阻止或恢复乙醇诱导的动物免疫毒性。此外,菊苣中酚酸衍生物和倍半萜类化合物被证明可诱导解毒酶对抗某些癌细胞[76]。陈瑞奇等[77]观察菊苣酸(43)具有诱导人急性髓系白血病细胞株HL-60凋亡的作用,发现其能呈浓度依赖性地降低HL-60细胞增殖活性和促进细胞凋亡,并增强caspase-3活性和下调Bcl-2蛋白表达。
3 展望
菊苣中含有丰富的生物活性成分,其传统的功效经过现代药理学的科学评价正逐渐被证实和挖掘。菊苣具有丰富的药理活性,如肝脏保护、抗炎、抗糖尿病、抗高尿酸血症等作用,与其含有多种化学成分如黄酮类、萜类、酚酸类化合物密切相关。
在过去的几十年里,关于菊苣的化学成分和药理活性已有较多文献报道,然而由于临床试验设计的局限性,它对人体健康有益的真实原因还不明确,如菊苣降血糖和抗高尿酸血症机制值得进一步研究。针对菊苣的药理作用研究,目前的研究多停留在粗提物上,对其具体的药效物质基础研究还不够深入,未来需要解决的问题主要是明确菊苣各粗提物的化学成分组成,挖掘具有确切生物活性的药效物质。此外,目前的研究多集中在菊苣传统主治功效方面,对于其相关的副作用或毒性研究还有待开展。
目前,菊苣开发出来的相关产品有以菊苣减肥茶为代表的保健饮品、菊苣饼干、菊苣猴头菇片等,随着菊苣越来越多治疗效果的科学证据被发现,菊苣相关产品及产业化会具有更广阔的发展前景。
参考文献
[1] 新疆部队后勤部卫生部. 新疆中草药手册[M]. 乌鲁木齐:新疆人民出版社, 1970.[2] 中国药典[S]. 一部. 2010.[3] Gupta A K, Kaur N, Singh R. Fructosan metabolism in Cichorium intybus roots[J]. Phytochemistry, 1986, 25(12):2765-2768.[4] Pazola Z, Cieslak J. Changes in carbohydrates during the production of coffee substitute extracts, especially in the roasting process[J]. Food Chem, 1979, 4(1):41-52.[5] Hébette C L M, Delcour J A, Koch M H J, et al. Complex melting of semi-crystalline chicory (Cichorium intybus L.) root inulin[J]. Carbohydr Res, 1998, 310(1):65-75.[6] Van Beek T A, Maas P, King B M, et al. Bitter sesquiterpene lactones from chicory roots[J]. J Agric Food Chem, 1990, 38(4):1035-1038.[7] Bischoff T A, Kelley C J, Karchesy Y, et al. Antimalarial activity of lactucin and lactucopicrin:sesquiterpene lactones isolated from Cichorium intybus L.[J]. J Ethnopharmacol, 2004, 95(S2/3):455-457.[8] Mamoru S, Toshio M, Kaoru U, et al. Sesquiterpene lactones from Cichorium endivia L. and C. intybus L. and cytotoxic activity[J]. Chem Pharm Bull, 1988, 36(7):2423-2429.[9] Kisiel W, Zielinska K. Guaianolides from Cichorium intybus and structure revision of Cichorium sesquiterpene lactones[J]. Phytochemistry, 2001, 57(4):523-527.[10] Holzer K, Zinke A. Uber die bitterstoffe tier zichorie (Cichorium intybus L.)[J]. Monatschr Chem, 1953, 84(5):901-909.[11] Rees S B, Harborne J B. The role of sesquiterpene lactones and phenolics in the chemical defence of the chicory plant[J]. Phytochemistry, 1985, 24(10):2225-2231.[12] Na Z E, Cho J Y, Lee H J, et al. Complete 1H and 13C NMR assignments of sesquiterpene lactone glucosides from Ixeris sonchifolia[J]. Magn Reson Chem, 2007, 45(3):275-278.[13] Pyrek J S. Sesquiterpene lactones of Cichorium intybus and Leontodon autumnalis[J]. Phytochemistry, 1985, 24(1):186-188.[14] Miyase T, Fukushima S. Studies on sesquiterpene glycosides from Sonchus oleraceus L.[J]. Chem Pharm Bull, 1987, 35(7):2869-2874.[15] El-Feraly F S, Chan Y M, Benigni D A. Magnolialide, a novel eudesmanolide from the root bark of Magnolia grandiflora[J]. Phytochemistry, 1979, 18(5):881-882.[16] Marco J A. Sesquiterpene lactones from Artemisia herba-alba subsp. herba-alba[J]. Phytochemistry, 1989, 28(11):3121-3126.[17] Michalska K, Kisiel W. The first guaian-12-oic acid glucopyranosyl ester and other constituents from Picris rhagadioloides (L.) Desf. (Asteraceae)[J]. Molecules, 2008, 13(2):444-451.[18] 杜海燕, 原思通, 江佩芬. 菊苣的化学成分研究[J]. 中国中药杂志, 1998, 23(11):682-704.[19] Dem'yanenko V G, Dranik L I. Flavonoids of Cichorium intybus[J]. Khim Prir Soedin, 1973, 9(1):115.[20] Aboul-Ela M A, Abdul-Ghani M M, El-Fiky F K, et al. Chemical constituents of Cirsium syriacum and Cichorium intybus (Asteraceae) growing in Egypt Alexandria[J]. J Pharm Sci, 2002, 16(2):152-156.[21] El Lakany A M, Ghani M M A. Chemical constituents and biological activities of Cichorium intybus L.[J]. Nat Prod Sci, 2004, 10(2):69-73.[22] Heimler D, Isolani L, Vignolini P, et al. Polyphenol content and antiradical activity of Cichorium intybus L. from biodynamic and conventional farming[J]. Food Chem, 2009, 114(3):765-770.[23] 高华杰, 何洪巨, 王文琪, 等. 结球红菊苣(Cichorium intybus var. foliosum Hegi.)花色苷初步研究[J]. 食品工业科技, 2010, 31(1):141-143.[24] Innocenti M, Gallori S, Giaccherini C, et al. Evaluation of the phenolic content in the aerial parts of different varieties of Cichorium intybus L.[J]. J Agric Food Chem, 2005, 53(16):6497-6502.[25] Ferioli F, D'Antuono L F. An update procedure for an effective and simultaneous extraction of sesquiterpene lactones and phenolics from chicory[J]. Food Chem, 2012, 135(1):243-250.[26] Malarz J, Stojakowska A, Szneler E, et al. A new neolignan glucoside from hairy roots of Cichorium intybus L.[J]. Phytochem Lett, 2013, 6(1):59-61.[27] Sinkovič L, Demšar L, Žnidarčič D, et al. Phenolic profiles in leaves of chicory cultivars (Cichorium intybus L.) as influenced by organic and mineral fertilizers[J]. Food Chem, 2015, 166:507-513.[28] Rastogi R P, Mehrotra B N. Glossary of Indian Medicinal Plants[M]. New Delhi:Nat I Sci Commun Inf Res, 2002.[29] Kisiel W, Michalska K. Root constituents of Cichorium pumilum and rearrangements of some lactucin-like guaianolides[J]. Z Naturforsch, 2003, 58(11/12):789-792.[30] Malarz J, Stojakowska A, Szneler E, et al. Furofuran lignans from a callus culture of Cichorium intybus[J]. Plant Cell Rep, 2005, 24(4):246-249.[31] Mansour S A, Ibrahim R M, El-Gengaihi S E. Insecticidal activity of chicory (Cichorium intybus L.) extracts against two dipterous insect-disease vectors:Mosquito and housefly[J]. Ind Crops Prod, 2014, 54:192-202.[32] Bais H P, Dattatreya B S, Ravishankar G A. SPME GC-MS analysis of volatile compounds of C. intybus[J]. J Sci Food Agric, 2003, 83(8):769-774.[33] Chadha Y R. The Wealth of India. Raw Materials (Vol. I:A)[M]. New Delhi:Publications & Information Directorate, CSIR, 1985.[34] 何轶, 郭亚健, 高云艳. 菊苣根化学成分研究[J]. 中国中药杂志, 2002, 27(3):209-210.[35] Sannai A, Fujimori T, Katō K. Studies on favour components of roasted chicory root[J]. Agric Biol Chem, 1982, 46(2):429-433.[36] 娄猛猛, 李国玉, 赵文斌, 等. 菊苣全草化学成分基础研究[J]. 石河子大学学报:自然科学版, 2011, 29(2):210-214.[37] Clevely A, Richmond K. The Complete Book of Herbs[M]. London:Dorling Kindersley, 1988.[38] Abbas Z K, Saggu S, Sakeran M I, et al. Phytochemical, antioxidant and mineral composition of hydroalcoholic extract of chicory (Cichorium intybus L.) leaves[J]. Saudi J Biol Sci, 2015, 22(3):322-326.[39] Heibatollah S, Reza N M, Izadpanah G, et al. Hepatoprotective effect of Cichorium intybus on CCl4-induced liver damage in rats[J]. Afr J Biochem Res, 2008, 2(6):141-144.[40] Saggu S, Sakeran M I, Zidan N, et al. Ameliorating effect of chicory (Cichorium intybus L.) fruit extract against 4-tert-octylphenol induced liver injury and oxidative stress in male rats[J]. Food Chem Toxicol, 2014, 72:138-146.[41] Madani H, Talebolhosseini M, Asgary S, et al. Hepatoprotective activity of Silybum marianum and Cichorium intybus against thioacetamide in rat[J]. Pakistan J Nutr, 2008, 7(1):172-176.[42] Neha M, Deepshikha P K, Vidhu A, et al. Determination of antioxidant and hepatoprotective ability of flavonoids of Cichorium intybus[J]. Int J Toxicol Pharm Res, 2014, 6(4):107-112.[43] Zafar R, Ali S M. Anti-hepatotoxic effects of root and root callus extracts of Cichorium intybus L.[J]. J Ethnopharmacol, 1998, 63(3):227-231.[44] 秦冬梅, 胡利萍, 曹文疆, 等. 维药菊苣提取物对小鼠急性酒精性肝损伤的保护作用[J]. 中药实验方剂学杂志, 2011, 17(7):128-131.[45] 王良信. 菊苣根提取物的保肝作用[J]. 国外医药, 2008, 23(2):81.[46] Rani P, Khullar N. Antimicrobial evaluation of some medicinal plants for their anti-enteric potential against multi-drug resistant Salmonella typhi[J]. Phytother Res, 2004, 18(8):670-673.[47] Nandagopal S, Kumari B D R. Phytochemical and antibacterial studies of chicory (Cichorium intybus L.)-A multipurpose medicinal plant[J]. Adv Biol Res, 2007,12(1):17-21.[48] Petrovic J, Stanojkovic A, Comic L J, et al. Antibacterial activity of Cichorium intybus[J]. Fitoterapia, 2004, 75(7):737-739.[49] 徐雅梅, 呼天明, 张存莉, 等. 菊苣根提取物的抑菌活性研究[J]. 西北植物学报, 2006, 26(3):615-619.[50] Koner A, Ghosh S, Roy P. Isolation of antimicrobial compounds from chicory (Cichorium intybus L.) root[J]. Int J Res Pure Appl Microbio, 2011, 1(2):13-18.[51] Mares D, Romagnoli C, Tosi B, et al. Chicory extracts from Cichorium intybus L. as potential antifungals[J]. Mycopathologia, 2005, 160(1):85-91.[52] Papetti A, Mascherpa D, Carazzone C, et al. Identification of organic acids in Cichorium intybus inhibiting virulence-related properties of oral pathogenic bacteria[J]. Food Chem, 2013, 138(S2/3):1706-1712.[53] Pushparaj P N, Low H K, Manikandan J, et al. Anti-diabetic effects of Cichorium intybus in streptozotocin-induced diabetic rats[J]. J Ethnopharmacol, 2007, 111(2):430-434.[54] Tousch D, Lajoix A D, Hosy E, et al. Chicoric acid, a new compound able to enhance insulin release and glucose uptake[J]. Biochem Bioph Res Com, 2008, 377(1):131-135.[55] Azay-Milhau J, Ferrare K, Leroy J, et al. Antihyperglycemic effect of a natural chicoric acid extract of chicory (Cichorium intybus L.):A comparative in vitro study with the effects of caffeic and ferulic acids[J]. J Ethnopharmacol, 2013, 150(2):755-760.[56] Muthusamy V S, Anand S, Sangeetha K N, et al. Tannins present in Cichorium intybus enhance glucose uptake and inhibit adipogenesis in 3T3-L1 adipocytes through PTP1B inhibition[J]. Chem-Biol Interact, 2008, 174(1):69-78.[57] Muthusamy V S, Saravanababu C, Ramanathan M, et al. Inhibition of protein tyrosine phosphatase 1B and regulation of insulin signalling markers by caffeoyl derivatives of chicory (Cichorium intybus) salad leaves[J]. Brit J Nutr, 2010, 104(6):813-823.[58] 鲁友均, 呼天明, 张存莉, 等. 菊苣提取物和菊粉降脂活性研究[J]. 西北植物学报, 2007, 27(6):1147-1150.[59] 张泽生, 吴瑕, 王超, 等. 菊苣仔根提取物对高脂血症仓鼠血脂的影响[J]. 食品工业科技, 2013, 34(9):352-355.[60] 孔悦, 刘小青, 张冰, 等. 菊苣提取物对高尿酸高甘油三酯血症鹌鹑血尿酸血脂的影响[J]. 北京中医药大学学报, 2004, 27(5):29-31.[61] 孔悦, 张冰, 刘小青, 等. 菊苣提取物对高尿酸血症动物模型的作用及机制研究[J]. 现代中西医结合杂志, 2003, 12(11):1138-1139.[62] 萨翼, 张冰, 刘小青, 等. 菊苣提取物对鹌鹑血尿酸血脂的影响[J]. 中药新药与临床药理, 2004, 15(4):227-229.[63] 孔悦, 张冰, 刘小青, 等. 菊苣提取物对高甘油三酯、高尿酸并高血糖血症大鼠影响的实验研究[J]. 中华中医药杂志, 2005, 20(6):379-380.[64] 李慧, 刘小青, 张冰, 等. 菊苣有效组分对高甘油三酯和高尿酸血症并高血糖大鼠脂代谢的影响[J]. 中西医结合学报, 2008, 6(2):157-162.[65] 黄胜男, 林志健, 张冰, 等. 菊苣干预高尿酸血症鹌鹑尿酸及相关代谢酶活性研究[J]. 中药新药与临床药理, 2015, 26(1):9-13.[66] 朱春胜, 林志健, 张冰, 等. 菊苣降尿酸作用的谱效关系研究[J]. 中草药, 2015, 46(22):3386-3389.[67] 林志健, 张冰, 刘小青, 等. 中药菊苣对鹌鹑高尿酸血症并腹型肥胖的干预研究[J]. 中华中医药杂志, 2014, 29(8):2493-2497.[68] Shad M A, Nawaz H, Rehman T, et al. Determination of some biochemicals, phytochemicals and antioxidant properties of different parts of Cichorium intybus L:A comparative study[J]. J Anim Plant Sci, 2013, 23(4):1060-1066.[69] Minaiyan M, Ghannadi A R, Mahzouni P, et al. Preventive Effect of Cichorium intybus L. Two extracts on cerulein-induced acute pancreatitis in mice[J]. Int J Prev Med, 2012, 3(5):351-357.[70] 孙娈姿, 杜金鸿, 呼天明, 等. 菊苣叶片不同溶剂提取物对粘虫的生物活性[J]. 植物资源与环境学报, 2010, 19(4):31-36.[71] 孙娈姿, 杜金鸿, 呼天明, 等. 菊苣叶提取物的抑虫活性研究[J]. 安徽农业科学, 2010, 38(32):18195-18197.[72] Molan A L, Duncan A J, Barry T N, et al. Effects of condensed tannins and crude sesquiterpene lactones extracted from chicory on the motility of larvae of deer lungworm and gastrointestinal nematodes[J]. Parasitol Int, 2003, 52(3):209-218.[73] Wesołowska A, Nikiforuk A, Michalska K, et al. Analgesic and sedative activities of lactucin and some lactucin-like guaianolides in mice[J]. J Ethnopharmacol, 2006, 107(2):254-258.[74] Süntar I, Akkol E K, Keles H, et al. Comparative evaluation of traditional prescriptions from Cichorium intybus L. for wound healing:Stepwise isolation of an active component by in vivo bioassay and its mode of activity[J]. J Ethnopharmacol, 2012, 143(1):299-309.[75] Kim J H, Mun Y J, Woo W H, et al. Effects of the ethanol extract of Cichorium intybus on the immunotoxicity by ethanol in mice[J]. Int Immunopharmacol, 2002, 2(6):733-744.[76] Im S S, Kim J R, Lim H A, et al. Induction of detoxifying enzyme by sesquiterpenes present in Inula helenium[J]. J Med Food, 2007, 10(3):503-510.[77] 陈瑞奇, 罗桂芳, 张宗利, 等. 菊苣酸诱导人白血病细胞HL-60凋亡作用及机制研究[J]. 中南药学, 2014, 12(12):1208-1210.相关知识
菊苣根的禁忌及副作用
研究进展
穿戴式生理参数监测及其临床应用研究进展
孕妇叶酸正确服用率及其影响因素研究进展
西安爱菊健康文化体验园研学,西安爱菊健康文化体验园研学旅游,西安研学基地
镇痛分娩临床应用的研究进展
陈莉明教授:抗肥胖药物研究进展、挑战及展望
丰富环境改善睡眠与认知障碍的作用及研究进展
饮食中有机磷酸酯暴露现状及其对消化系统影响的研究进展
人体成分分析在慢性病健康管理应用的研究进展
网址: 菊苣化学成分及其药理作用研究进展 https://www.trfsz.com/newsview307992.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3820
- 2男女激情后不宜做哪些事 3682
- 3早上怎么喝水最健康? 3618
- 4习惯造就健康 影响健康的习惯 3277
- 5五大原因危害女性健康 如何保 3172
- 6连花清瘟、布洛芬等多款感冒药 2948
- 7男子喝水喉咙里像放了刀子一样 2451
- 810人混检核酸几天出结果?1 2216
- 9第二轮新冠疫情要来了?疾控中 2211
- 10转阴多久没有传染性?满足四个 2153






