科研丨BMC Medicine(IF:11.15): 肥胖女性的多组学肠道微生物组特征
编译:微科盟溧阳,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
肥胖和相关合并症是当今世界面临的主要健康挑战,其发病率在全球范围迅速上升。肠道微生物组最近已成为人类健康的关键调节剂,可影响肥胖的发生和发展,这主要是因为它参与了食物摄入和代谢的调节。然而,深入探讨人体肠道微生物组在肥胖中的作用的研究仍然很少,而探究其与饮食行为关系的研究更少。为了提高我们对肥胖表型中肠道-微生物-大脑轴的了解,在意大利女性队列中表征了肥胖的肠道微生物组特征。收集了63名超重/肥胖女性和37名正常体重女性的粪便样本,并通过16S rRNA扩增子测序、宏基因组、宏转录组和脂质组学的多组学方法进行分析。然后寻找与人体测量、临床、生化和营养数据的关联,特别关注饮食的认知和行为方面。本研究确定了肠道微生物组的四个组成聚类,虽然它们与体重没有明显关联,但与饮食习惯和行为有不同的相关性。这些聚类在功能特征上也有差异,即转录活性和粪便代谢产物。特别是饮食行为不受控制的OB女性主要以低多样性微生物为特征,很少且相关性差的物种(如Ruminococcus torques和Bifidobacterium spp.)表现出低转录活性,特别是参与次级胆汁酸生物合成和神经内分泌信号传导(即神经递质、吲哚和大麻素受体配体的产生)的基因。在粪便中发现了大量的初级胆汁酸和固醇。通过发现与饮食模式相关的特殊肠道微生物组,为阐明肥胖表型中的肠-脑轴通信奠定了基础。在确认本文提出的假设的前提下,我们的工作可以帮助指导设计基于微生物组的精确干预措施,旨在重组微生物网络,以支持健康饮食-微生物组-肠-脑轴,从而抵消肥胖和相关并发症。
论文ID
原名:Multi-omics gut microbiome signatures in obese women: role of diet and uncontrolled eating behavior
译名:肥胖女性的多组学肠道微生物组特征:饮食和不受控制的饮食行为的作用
期刊:BMC Medicine
IF:11.15
发表时间:2022.12
通讯作者:Silvia Turroni
通讯作者单位:意大利博洛尼亚大学
DOI号:10.1186/s12916-022-02689-3
实验设计
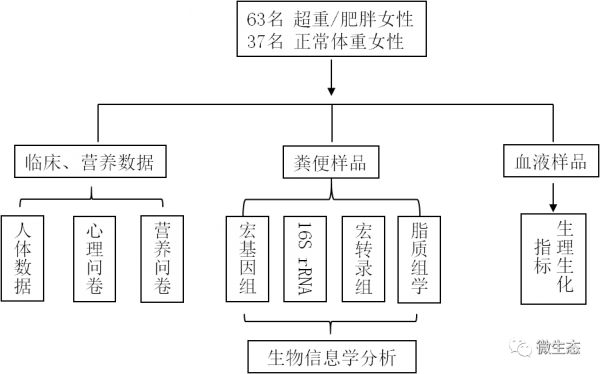
结果
1.研究队列描述
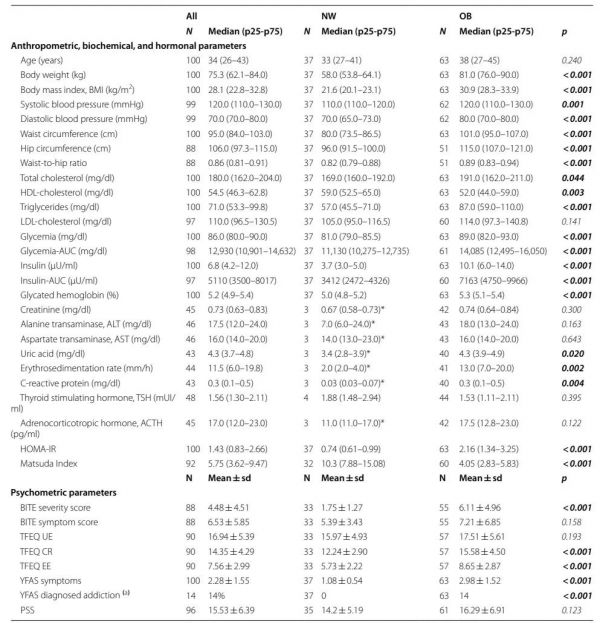
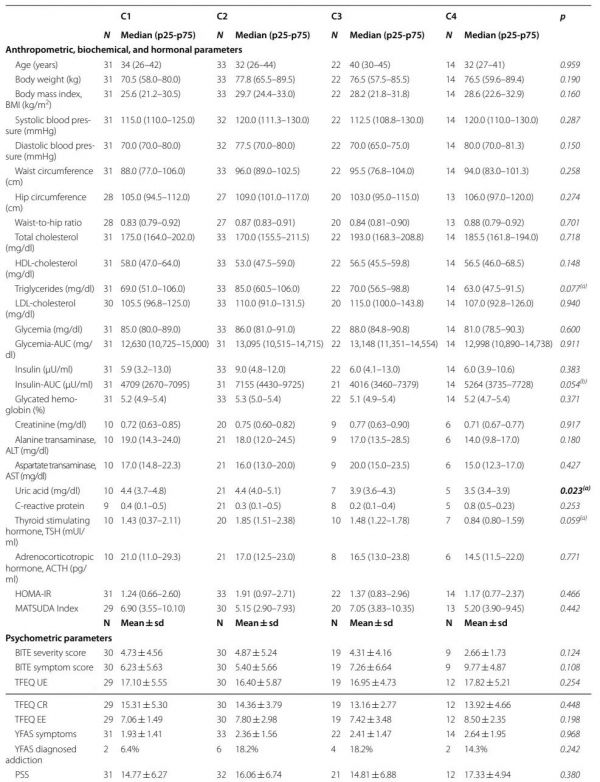
招募100名绝经前妇女,表1报告了所有招募参与者的人体测量和实验室参数以及心理测试结果。整个研究队列包括63名超重/肥胖(OB;BMI为25.6至39.8 kg/m2)和37名正常体重(NW;BMI为18.5至24.6 kg/m2)女性。与NW组相比,OB女性的体重、BMI、腰围和臀围以及腰臀比显著增高(P<0.001),收缩压和舒张压更高(P≤0.001),其中三名OB女性接受了降压治疗。与NW组相比,OB组女性的总胆固醇和甘油三酯水平更高(P≤0.04),而NW组的高密度脂蛋白胆固醇更高(P=0.003)。OB组的葡萄糖代谢指数(即血糖、胰岛素、糖化血红蛋白以及口服葡萄糖耐量试验期间葡萄糖和胰岛素的曲线下面积(AUC))高于NW组(P<0.001)。五名OB女性和一名NW女性空腹血糖水平大于100 mg/dl,但均未患2型糖尿病。最后,OB组的胰岛素抵抗患者比例明显高于NW组(OB组为44.4%,NW组为0%,P<0.001),这与胰岛素抵抗/敏感表型与BMI之间的关系一致,并有较强相关性(r=0.478,P<0.0001)。心理测试问卷因其中一些数据不完整(参与者填写不完整)而被丢弃:12份BITE、10份TFEQ(三因素饮食问卷)和4份PSS(压力知觉量表)。一名OB女性在两个BITE分量表中表现出高分,表明很有可能符合饮食障碍诊断标准。TFEQ分量表的平均得分如下:TFEQ UE(不受控制的进食)为16.91±5.37;TFEQ CR(认知抑制)为14.35±4.27;TFEQ EE(情绪进食)为7.59±2.98。在完成YFAS(耶鲁食物成瘾量表)的100名参与者中,14名(均属于OB组)被诊断为FA(食物成瘾),而整个队列的平均FA症状评分为2.28±1.55。NW组中没有一位女性表现出高FA分数。平均PSS评分为16.03±5.91;两名OB患者表现出较高的PSS评分。与NW组相比,OB组在BITE严重程度(P<0.001)、TFEQ CR(P<0.001)、TFEQ EE(P<0.001)和FA症状评分(P<0.001)以及FA诊断(P<0.01)方面表现出显著更高的分数。
表1 入选女性的基线特征:人体测量、生化和激素参数以及心理测量数据。Wilcoxon秩和检验得到的P值为NW与OB的比较(显著值为粗体)。
2.肠道菌群分析和聚类鉴定
16S rRNA基因测序共产生650万条序列,平均每个样本73152(±38578,sd) reads,11874个操作分类单元(OTUs)的序列同一性为97%。OB和NW组的GM(肠道微生物组)多样性和结构存在显著差异(图1)。基于OTU比例的Spearman相关系数的分层聚类识别到四种聚类模式(命名为C1至C4;图2)。其中一个聚类包括48%的NW女性(C1),而其余三个聚类(C2-C4)主要包括OB女性(C2:72%;C3和C4:64%),但不同聚类间没有统计学差异(P=0.38)。有趣的是,这四个聚类的生物多样性也不同,C1和C3多样性最高,而C2和C4最低(P<8×10−4)。C2的多样性低于C1和C3(P<3×10−4),而C4多样性比C1更低(P=0.05)(图2)。为了确定整个数据集GM结构的趋势,首先建立了属的共丰度关联,将相关细菌分类群聚类为五个共丰度组(CAGs),根据每组中的优势(即最丰富的)属来命名:Bifidobacterium(紫色)、Ruminococcus(蓝色)、Dorea(绿色)、Prevotella(浅蓝色)和Bacteroides(粉色)。Wiggum图显示了通过OTU确定的四个聚类的GM组成关系,显示出五个CAG的独特丰度模式(图3)。每个聚类(C1至C4)构成一个稳定状态,代表一组显著不同于其他组的GM结构特征的个体(P<0.001)。然而,应注意的是,在基于加权UniFrac的PCoA中,不同聚类间没有显著分离(P>0.05),这表明差异与丰富的GM组成无关。通过比较主要属的相对丰度也证实了这些结果。从包括大多数NW女性的聚类(即C1)到主要包括OB女性的聚类(C2-C4),微生物群的变化伴随着独特的优势CAG。具体而言,C1的特征是所有5个CAG的共存和较高的Prevotella相对丰度。而在C2-C4中,5个CAGs中至少有一种缺失。在C2中,尽管没有Bifidobacterium CAG,但保留了其他四个代表性CAG。另一方面,C3缺少Bifidobacterium CAG,但Prevotella和Ruminococcus CAG的丰度较高。最后,C4的特征是在Bifidobacterium CAG富集的同时,缺少Bacteroides CAG。
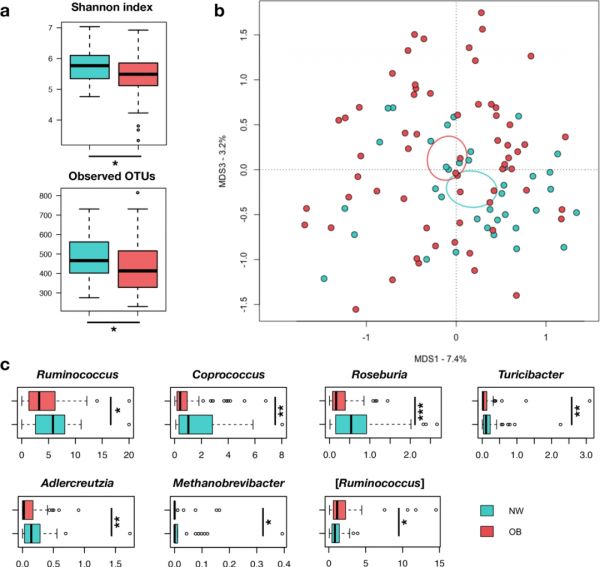
图1 超重/肥胖女性的肠道菌群结构与正常体重女性的肠道菌群结构不同。
(a)使用Shannon指数和observed OTUs来衡量超重/肥胖(OB)和正常体重(NW)女性肠道菌群的α多样性;(b)基于OB和NW女性肠道微生物群分布之间未加权UniFrac距离的主坐标分析(PCoA)图(p=0.007)。椭圆表示每个组95%的置信区间。(c)显示两组间显著差异细菌属的相对丰度分布的箱线图。*p < 0.05; ** p < 0.01; *** p < 0.001;Wilcoxon秩和检验。
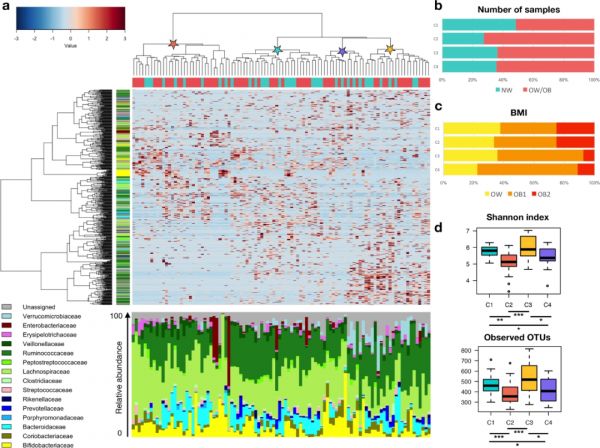
图2 肠道微生物群结构允许将整个数据集分为四个不同的聚类。
(a)基于OTU相对丰度的Spearman相关系数的分层聚类,过滤至少20%的参与者的存在。拟杆菌门,蓝色;厚壁菌门,绿色;变形菌门,红色;放线菌门,黄色。底部的条形图显示了微生物群的相对丰度。(b)条形图显示了每个聚类中正常体重(NW)和超重/肥胖(OB)女性的百分比,以及后者在BMI状态方面的分布:超重(OW)、1级肥胖(OB1)和2级肥胖(OB2)。(d)使用Shannon指数和observed OTUs测量四个微生物群(C1–C4)的α多样性。
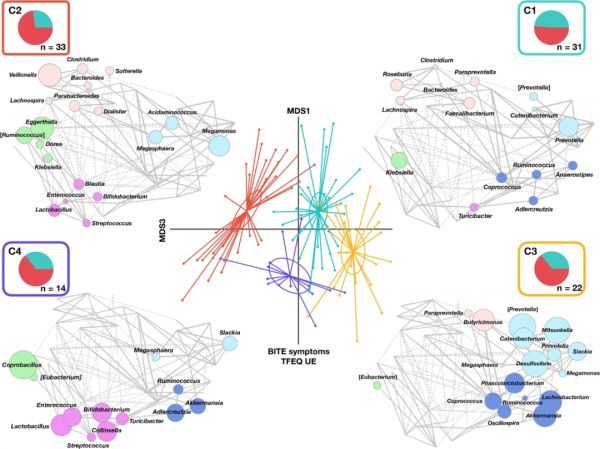
图3 正常体重和超重/肥胖女性的肠道微生物结构与饮食行为相关。
PCoA图显示了四种显著不同的聚类(C1至C4;P<0.001。饼图代表了每个聚类中正常体重(青色)和超重/肥胖(粉色)女性的分布;圆形颜色指CAG,根据每组中最丰富的属来命名:Bifidobacterium(紫色)、Ruminococcus(蓝色)、Dorea(绿色)、Prevotella(浅蓝色)和Bacteroides(粉色)。
3.正常体重和超重/肥胖女性的微生物群与临床和行为指标之间的关系
人口统计学和临床变量以及饮食行为与非加权uniFrac PCoA分析主轴的关系如图3和表2所示。特别是,基于整个队列的分位数(中位数)年龄调整回归分析,GM结构向负PCo2值的转变(如低多样性聚类C4)与较高的BITE症状评分(表明暴食行为)和TFEQ UE评分(表明不受控制的饮食)相关。比较四组参与者的基线临床状况,发现人体测量数据以及生化特征和炎症生物标志物均没有差异。除尿酸外,所有组中参数都相似,C2组的尿酸高于C4组(P=0.02),但这些值仍在正常范围内(表3)。尽管没有达到统计学意义,但与C3或C4相比,C2组参与者的甘油三酯、胰岛素(AUC)和促甲状腺激素水平也更高(P≤0.08)。最后,在比较C1-C4组时,没有发现胰岛素抵抗率的差异(P=0.47)。关于心理测试,C2显示出最高的BITE严重性评分(P=0.1),而C4显示出最高BITE症状评分(P=0.1),与PCo2轴的关联一致(图3)。
为了进一步探讨GM与饮食行为之间的关系,根据YFAS问卷,并考虑饮食行为引起的压力影响,根据对不受控制的饮食行为的诊断,将OB女性分为以下三组:低成瘾性进食行为(即有2种或更少症状,O_LA)和高成瘾性进食行为(即有3种或更多症状),伴有(O_DHA)或无(O_HA) FA。C1的O_DHA女性比例最低(7%),C2最高(36%)。另一方面,C1组与C2组的O_HA女性比例相似(C1组为19%,C2组为18%)。C4的O_HA女性比例最高(36%),其次是C3(27%)。O_LA女性的比例在C1组最高(26%),而在其他组相似(C2组:18%;C3:18%;C4:14%)。NW女性中没有一人表现出不受控制的饮食行为。
表2 参与者元数据和微生物群组成之间的关联。
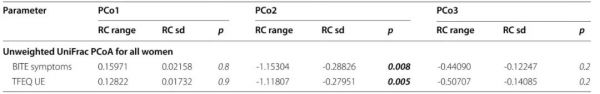
表3 四种肠道微生物群的人体测量、生化和激素参数以及心理测试数据的比较。
4.饮食对正常体重和超重/肥胖女性肠道菌群的影响
为了确定影响GM排序(P<0.05)的食物类型,将食物频率问卷(FFQ)的食物数据叠加在图3的未加权UniFrac PCoA图上(图4)。调味品和调味料、橄榄油、油炸土豆和香肠以及加糖饮料、牛奶和酸奶的摄入增加与C2的GM结构有关。另一方面,C4的特点是奶酪的摄入量较高,而C1和C3的特点是上述所有食物的摄入量较低。纤维摄入量(克/1000千卡)与PCoA第一轴呈正相关,并且在C1中似乎更高(图4b)。其他三个聚类显示出相似的纤维摄入量,且C2低于C1(P=0.03)。总能量摄入(kcal/天)呈相反趋势,与PCo1呈负相关,在C2、C3和C4聚类中更高(图4b)。与更大的不受控制饮食倾向(TFEQ UE)和加重的BITE症状评分一致,C4聚类显示出比C1更高的能量摄入(P=0.04)。在大量营养素摄入方面(图4c),与C1相比,C4的碳水化合物摄入增加,脂肪摄入减少(分别为0.05和0.04)。C3的脂肪摄入量也低于C1(P=0.01)。
进一步探究了FFQ数据,其中第一个轴描述了超过13.7%的数据集方差,包含了之前对微生物群PCoA的FFQ数据的相关性分析中确定的大部分食物类型(即奶酪、加糖饮料、调味料和调味品)。基于Ward连锁聚类和欧式距离,共识别到三个饮食组:D1(低蛋白/高碳水化合物)、D2(高蛋白/低碳水化合物)和D3(高脂肪/高蛋白)(图5a)。D1的特点是更多地食用甜食、饼干和鸡蛋,D2食用咸零食、油炸食品、肉类、火腿片和自制三明治,而D3食用乳制品(即奶酪、牛奶和酸奶)。随后,根据摄入食物的数量、分布和健康价值计算了每个饮食组的健康食物多样性(HFD)指数。HFD显示,D2和D3是最多样化的饮食,而D1最少(P=0.0002;图5b)。
通过匹配受试者的饮食和微生物组,寻找与OB表型相关的组合。结果发现在OB女性中,较少多样化的D1饮食和C2微生物群的组合最为普遍(占OB的25%),特别是在O_LA(14%)和O_DHA(6%)女性中,其次是O_HA女性中的D1-C4组合(6%)。有趣的是,没有OB女性属于D2-C4组合,对于NW亚组,发现三个饮食组在C1微生物群中分布均匀,其中D1-C1组合最为普遍(占NW的19%)。五分之三具有C4微生物群结构的NW女性(8%)与多样化较低的D1饮食有关,而其余五分之二(5%)与D2饮食有关。
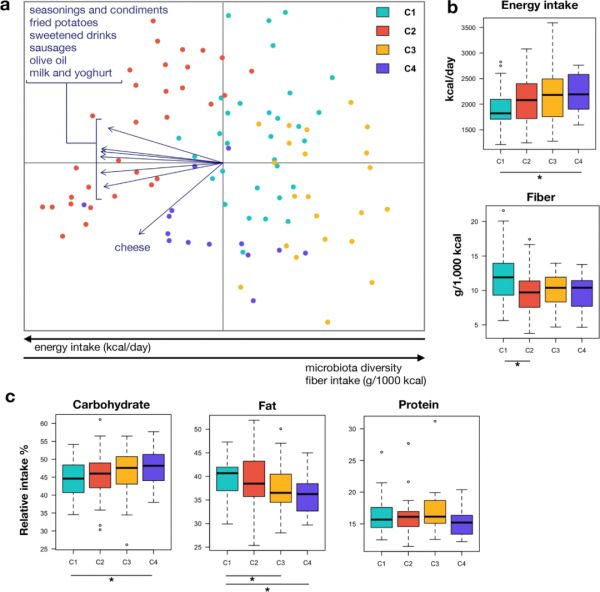
图4 不同的食物消耗量表征了不同的微生物结构。(a)基于粪便微生物群的非加权UniFrac距离的PCoA。
仅显示与样本分离显著相关的食品类型(P<0.05)。不同聚类用不同颜色表示(C1–C4,见图1)。底部的黑色箭头表示沿着PCo1的微生物群多样性、能量和纤维摄入梯度的方向。(b)所有女性的总能量摄入(单位:千卡/天)和纤维消耗量(单位:每1000千卡消耗的纤维克数)以及(c)大量营养素摄入的百分比汇总。
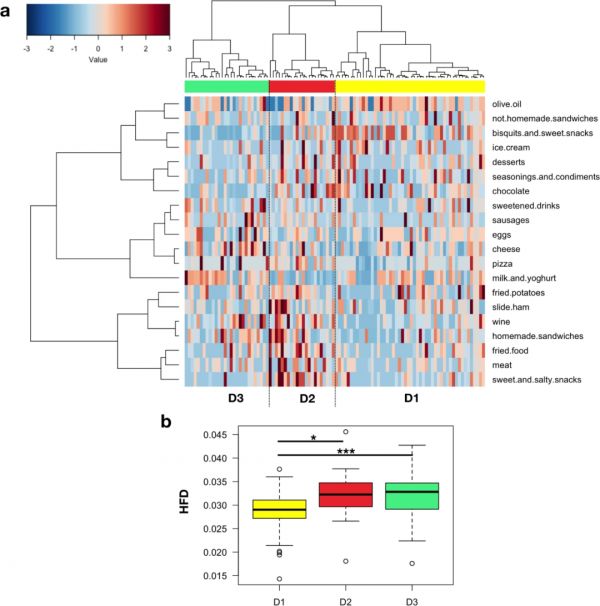
图5 不同女性的饮食模式在健康食物多样性指数方面不同。
(a)热图通过Ward连锁聚类和欧式距离显示了三个饮食组(D1–D3),欧氏距离应用于食物频率问卷数据的对应分析中的第一特征向量。(b)健康食物多样性(HFD)指数在各饮食组中的分布的箱线图。*p = 0.02; *** p = 0.0001;Wilcoxon秩和检验。
5.肥胖和不受控制的饮食行为的物种水平微生物组特征
对45个DNA样本(31个OB女性,14个NW女性)进行宏基因组测序,共获得15 Gb的配对末端reads。宏基因组数据集主要由8种细菌组成,它们对生态系统变异的贡献率为52.5–56.6%,并在四个聚类(C1-C4)中分布不同:Faecaliberium prausnitzii、Bifidobacterium adolescentis、Bifidobacteria longum、 Ruminococccus bromiii、Eubacterium rectale、Akkermansia muciniphila、Bacteroides vulgatus和Subdoligranulum spp.(图6a)。特别是,与C2相比(P=0.03),C1聚类中富含R. bromii;与C3和C4相比(P<0.03),C1中富含F. prausnitzii(图6b)。另一方面,与C1相比,C2富含Ruminococcus torques(P=0.05),这是一种会损害肠道屏障完整性的粘液溶解细菌。此外,相对于C1和C3(P<0.02)以及C1和C4(P<0.03),C2中A. muciniphila和R. bromii丰度较低。至于其他主要表征进食行为不受控制的OB女性的其他GM类型(即C3和C4),C3显示出比C2更高水平的A. muciniphila和Subdoligranulum spp.(P<0.02)。与C3相比,C4中E. rectale丰度较高(P=0.008),以及与其他三组相比,C4中B. adolescentis和B. bifidum丰度较高(P<0.05),可能是由于奶酪的消费量较大。
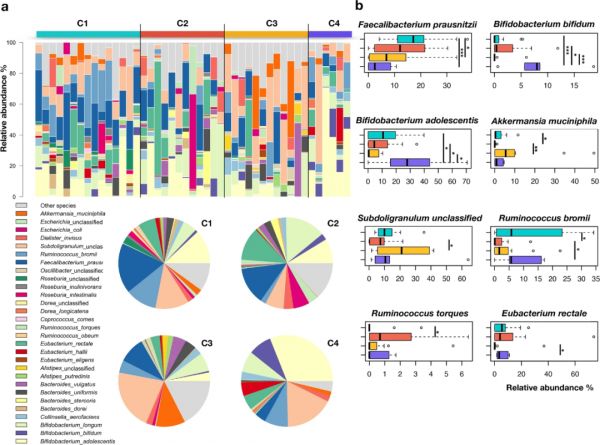
图6 种水平上的菌群特征。
(a)参与者肠道微生物在种水平上的相对丰度;(b)研究组之间丰度显著较高或较低的细菌物种相对丰度分布的箱线图。*p < 0.05; ** p < 0.005; *** p < 0.0005; Wilcoxon秩和检验。
7.肥胖和不受控制的饮食行为中肠道微生物组和粪便脂质组的转录活性
对同一样本进行了宏基因组测序,以研究不同GM聚类的物种水平部分及其转录活性。根据我们的发现,主要由NW女性组成的C1聚类中最具转录活性的部分包括八种Bacteroides spp.(即B. faecis、B. finegoldii、B. cellulosilyticus、B. massiliensis、B. coprophilus、B. dorei、B. plebeius、B. vulgatus)、两种Bifidobacterium spp.(B. dentium和B. animalis)、Coprococcus catus、Lachnospiraceae bacterium(5_1_63FAA)、两种Roseburia spp.(R. intestinalis和R. inulinivorans)和Escherichia coli。在包含更多OB女性的C2、C3、C4聚类中发现总体上Bacteroides spp. 减少,而富含一般的次优势物种(例如,Anaerostipes hadrus和Anaerostipes finegoldii以及C4中的Gordonibacter pamelaae)。另一方面,当与其他聚类(即C1、C2、C4)相比时,发现C3具有转录活性物种(主要包括O_HA女性)多样性最高,其主要特征是三种Alistipes spp.(即A. finegoldii、A. onderdonkii、A. shahii)、Megamonas hypergale、两种Coprococcus spp.(即C. sp. ART55 1和C. eutractus)、Parabacteroides distasonis、Barnesiella intestinihominis、三种Bacteroides spp. (B. nordii、B. ovatu、B. vulgatus)、三种Ruminococcus spp.(即R. torque、R. obeum、R. bromii)、R. intestinalis、Methanobrevibacter smithii、两种Eubacterium spp.(E. eligens、E. siraeum)和E. coli过多。最后,发现C4(包括最高比例的O_HA女性)的转录多样性最低,其特征是很少但极其活跃的细菌种类,包括G. pamelaeae、Lactobacillus casei/paracasei、B. bifidum、Adlercreutzia equolifaciens、E. rectale、Roseburia hominis和S. thermophilus。
接下来,我们评估了四种GM中的核心物种和基因分布,重点关注涉及碳水化合物、氨基酸、脂质和外源代谢的KEGG途径。发现只有C1和C2的细菌物种覆盖了所有上述代谢活动。另一方面,C3聚类显示出更高的生物多样性,主要与碳水化合物和氨基酸代谢有关,而C4几乎没有外源代谢。在KEGG通路的分布方面,糖酵解具有最高的转录丰度,并且与核苷酸糖和丙酮酸代谢通路一起在所有样本中都过度转录。其他转录组途径包括单糖(如果糖、甘露糖和半乳糖)的分解和支持核酸合成的非氧化磷酸戊糖循环以及必需和含硫氨基酸代谢(如甘氨酸、丝氨酸和苏氨酸、半胱氨酸和蛋氨酸)。在不同聚类特异性方面,C1转录组在上述功能中特别丰富,表明通过相应的GM实现了总体有效的基础代谢。另一方面,C2显示出丙酸盐代谢特有的高转录物丰度。C3转录组总体上是最活跃和多样化的,大量转录物参与几种氨基酸代谢、脂肪酸生物合成、丁酸代谢和戊糖/葡萄糖醛酸盐的相互转化。C4转录组显示用于甘油脂和甘油磷脂代谢的转录物丰度增加,表明脂肪酸消化发生变化。还值得注意的是,C3和C4都显示出参与芳香族氨基酸(即苯丙氨酸、酪氨酸、色氨酸)生物合成的基因转录增加,已知芳香族氨基酸参与肠-脑通讯。
最后,对粪便样本进行的脂质组学分析识别出一些代谢物,与C3和C4相比,C1和C2中的SCFAs(即丁酸盐、乙酸盐、丙酸盐)水平更高(P≤0.01),C3和C4富含大量转化甾醇,如粪甾醇、5β-谷甾醇和5β-樟脑甾醇(P≤0.04)。另一方面,最高水平胆固醇与C2相关(P≤0.05)。根据Matysik等人提出的定义,C2包括许多非胆固醇和低胆固醇转换物,而C3中包括许多高胆固醇和非胆固醇转换物。C2和C4中胆汁酸总量更高,其中C2和C4特别富含胆酸和鹅去氧胆酸(P≤0.03)。
通过sPLS探究脂质组学与GM转录活性之间的相关性,发现主要包括OB女性(尤其是C4)的GM聚类特征之间的相关性最强。特别是,5β-谷甾醇(C3和C4中富集)与F. prausnitzii参与的次级胆汁酸生物合成,以及B. longum(与半乳糖代谢、糖酵解/糖异生、半胱氨酸和蛋氨酸代谢相关)和R. bromii参与的甘油脂代谢途径呈正相关。后者与B. longum参与的半乳糖代谢一起,也显示出与SCFAs中乙酸和丙酸较强的负相关性,与它们在C3和C4中的较低水平一致。
8.与代谢稳态相关的微生物基因的转录变异
8.1 食物摄入和能量消耗——ClpB和胆汁酸
一些GM衍生代谢物和细菌蛋白能参与大脑交流并调节能量摄入。其中,伴侣蛋白ClpB(酪蛋白水解肽酶B)已被证明模拟了促厌食的POMC衍生的α-MSH(α-促黑素细胞激素)激素,能够影响宿主食欲。另一方面,由于胆汁酸在脂质吸收中的作用,以及通过激活参与产热的宿主受体,有助于调节宿主能量稳态。因此,本研究专门评估了四个GM聚类中ClpB和参与胆汁酸微生物代谢的酶的转录水平。ClpB仅在C1(主要包括NW女性)中由A. muciniphila、在C2(主要在O_DHA女性)中由L. ruminis、以及在C1、C3和C4中由A. equolifaciens转录。在胆汁酸代谢方面,发现了三种酶的特异性转录水平,即胆酰甘氨酸水解酶(K01442)、7-α-羟基类固醇脱氢酶(K00076)和3-脱氢-胆汁酸δ4,6-还原酶(K07007)。编码初级胆汁酸解偶联酶K01442的微生物基因被C1和C3的几个微生物物种转录,即C1中的R. intestinalis、C. catus、B. animalis、Coprococcus comes、Eubacterium ventriosum、Dorea longicatena和A. shahii、C3中的R. obeum、M. smithii、A. finegoldii、P. distasonis、Eubacterium hallii、A. onderdonkii和A. equolifaciens。相反,K01442在C2和C4中分别由A. hadrus和L. casei/paracasei转录。K00076参与次级胆汁酸生物合成,发现它仅在C1中由E. coli转录,而无论饮食行为如何,在包括更多比例OB女性的C2-C4聚类中没有观察到转录活性。K07007是另一种参与次级胆汁酸生物合成的酶,在C1中由C. catus和M. smithii转录,在C2中由R. obeum、A. shahii和E. rectale转录,以及在C3中由R. bromii、Coprococcus sp. ART55_1和M. hypermegale转录,而在C4中只观察到F. prausnitzii和R. homanis微弱的转录活性。
8.2 神经内分泌信号色氨酸代谢物、阿片类、内源性大麻素和GABA
随后研究了专门参与色氨酸(Trp)、内源性大麻素(eCBs)和阿片类药物代谢以及GABA(能够与中枢神经系统相互作用并影响摄食行为的生物活性分子)生物合成的微生物转录活性。结果发现C1和C4的Trp相关转录活性较C2和C3低,只有轻微的转录活性负责吲哚-3丙酮酸转化为吲哚-3乳酸(K03778),分别归属于R. ntestinalis和R. hominis。另一方面,虽然由不同细菌参与,但C2、C3、C4(主要包括OB女性)聚类均通过其他基因(K00170和K00172)增加了丙酮酸转化为乙酰辅酶A的转录活性。有趣的是,主要包括O_DHA女性的C3聚类具有最高的微生物活性,可通过色氨酸酶(K01667)将Trp直接转化为吲哚,其中A. finegoldii、A. muciniphila、A. shahii、B. ovatus和A. onderndonkii是转录活性最高的物种。关于eCB系统,我们查询了转录组数据集,以获取参与大麻素受体内源性配体前体生物合成的微生物酶。结果显示,三酰甘油脂肪酶(K01046)参与二酰基甘油的形成,其仅在C1中由B. dentium转录。C2显示出B. dentium的残留活性,而在C3和C4中未观察到转录活性。
关于阿片类代谢,C1显示出β-葡萄糖醛酸酶(K01995)的最高转录水平,β-葡萄糖醛酸酶是参与吗啡代谢途径的微生物酶,由B. dentium、B. longum和B. finegoldii产生。另一方面,在包含更多OB女性的聚类中未发现Bifidobacterium和Bacteroides spp.的转录活性,C2中的E. coli、C3中的F . prausnitzii和C4中的R. hominis仅具有轻微转录活性。
最后,参与GABA产生的谷氨酸脱羧酶基因(K01580)在C1中由B. faecis、B. cellulolyticus、B. uniformi和B. finegoldii转录。对于主要包括OB女性的GM类型,K01580在C2中由B. dentium和B. fragilis转录,在C3中由Bacteroides egghertii、B. nordii、B. caccae、B. ovatus和A. finegoldii转录。有趣的是,在C4中观察到较低甚至为零的转录活性。
讨论
这是第一项使用多组学方法来探讨肥胖患者的基因、饮食和不受控制的饮食行为之间的关联的研究。所有这些数据都与饮食摄入和各种临床和心理测量方法相结合,以提供肥胖表型表征中的肠-脑轴通讯。正如在其他研究中已经观察到的,我们首先表明,与NW女性相比,OB女性的GM具有一些不良生物特征,即多样性减少和组成变化,包括典型的健康相关分类群(主要是来自Lachnospiraceae和Ruminococceae科的SCFA生产菌)的比例降低,而机会病原体或致病菌(例如Ruminococcus)的比例增加。
接下来,为了进一步探究GM结构,在稳态方面,通过评估GM之间的相似程度,确定了独特的菌群组成,每个聚类都具有不同的成员及它们之间的相互联系。在本研究中,我们确定了4个GM集群(C1-C4),它们的生物多样性不同,C1和C3值最高,C2和C4值最低,CAG丰度也不同。其中C1是最多样的,同时存在五种鉴定到的CAG(即Bifidobacterium、Prevotella、Ruminococcus、Dorea和Bacteroides CAGs),而其他聚类至少缺少一种CAG,如C2和C3的Bifidobacterium CAG和C4的Bacteroides CAG。此外,C4的特征是有较高丰度的Bifidobacterium CAG。在探究与宿主表型数据的联系时,发现C2聚类中的女性在尿酸含量方面存在差异,并表现出甘油三酯、胰岛素和促甲状腺激素水平较高的趋势。饮食行为方面,暴饮暴食行为和不受控制的饮食与C4聚类有特殊关联。根据YFAS调查问卷的定义,这一聚类中O_HA女性的比例最高,即具有高成瘾性饮食行为。另一方面,C2包含的O_DHA女性比例最高,而C1最低。
饮食习惯方面,我们发现总能量摄入量在包括较多OB女性(即C2至C4)的群体中较高,这与更大的不受控制的饮食倾向和加剧的BITE症状评分一致。与C1相比,C4还与碳水化合物摄入增加和脂肪摄入减少有关,而后者的特点是纤维消耗量最高。最近在人群水平队列中研究了GM与健康相关饮食之间的关系,强调了基于食物来源异质性、质量和饮食模式的有利和不利微生物群的变化。我们的研究结果也与Medawar最近关于饮食行为与膳食纤维摄入之间关系的研究结果一致,这表明属于Ruminococcus属的有益细菌(在C2聚类中丰度较低)与更健康的饮食行为相关。GM更倾向于解释肥胖引起代谢表型的改变(例如我们研究中的C2聚类),与其说与不健康食品的消费有关,不如说与Ruminococceae和Lachnospiraceae科的缺失有关,这通常与对胰岛素和葡萄糖稳态的有益作用有关。
然后应用宏基因组学和宏转录组学,以进一步探索所识别的不同GM聚类的分类结构和功能。前者使我们能够识别一些有区别的物种,如有益分类群R. bromii和F. prausnitzii,其在C1聚类中富集,以及A. muciniphila,在C3中富集。Akkermansia属被确定为下一代益生菌,并因其参与改善代谢受损个体的代谢健康而被广泛研究,其在OB女性中与FA呈负相关。另一方面,另一种粘液分解菌R. torque在C2中更常见(主要包括O_DHA女性),其在代谢综合征和炎症性肠病患者中丰度增加。此外,该菌已被证明通过抑制A. muciniphila的生长来改变外粘液层中的微生物生态位,并改变肠道屏障,从而导致代谢性内毒素血症。最后,C4聚类(O_HA女性比例最高)相关的结构主要以Bifidobacterium spp.为特征。后一发现与现有文献相反,文献表明双歧杆菌不仅可以通过影响肠道食欲激素和GM组成来改善OB女性的体重,甚至还可以作为精神生物制剂影响压力、焦虑和抑郁相关行为。此外,Kohn及其同事最近探究了细菌属与大脑网络连通性之间的关联,为双歧杆菌丰度与注意力和潜在记忆相关的大脑网络活动之间的关系提供了证据。另一方面,如上所述,Bifidobacterium在C4中的高丰度可能与奶酪的较高摄入量有关。
总的转录组数据与先前关于GM聚类组成结构的数据一致,即C1和C3在转录活性物种方面也是最多样的,而C2和C4较低(尤其是C4),并且倾向于仅由少数物种主导转录。此外,主要包括OB女性的所有聚类中Bacteroides spp.的总体丰度下降。尽管关于肥胖患者中Bacteroides spp.水平的数据存在矛盾,但最近一项针对OB女性FA的研究强调了该属与大脑区域的连通性呈负相关,而与神经保护代谢产物吲哚丙酸酯呈正相关。值得注意的是,C4聚类显示出Bifidobacterium spp.的活性增加,但也显示出其他一般次优势种的活性增加,如G. pamelae。后者从一名患有急性克罗恩病的患者的结肠中分离出来,表明其可能具有促炎作用,并发现其仅能代谢少量碳源,这可能支持C4聚类与多样化饮食的关联。
即使在功能层面上,C4聚类也是最差的,几乎没有参与外源代谢的转录物(如C3)。只有更多的与脂质代谢和芳香族氨基酸生物合成相关的转录物(后者与C3共享),众所周知,其代谢产物可刺激肠-脑通信。另一方面,C1聚类较好地涵盖了所有核心代谢活动和管家功能(即碳水化合物、氨基酸、脂质和外源代谢),与NW女性的关联一致。C2聚类也是如此,主要表现在O_DHA女性中,尽管丙酸代谢的转录物特别丰富,研究显示SCFA可以减少对高热量食物的预期奖励反应。当关注与食物摄入和能量消耗以及神经内分泌信号相关的特定微生物基因时,发现了一些特殊的特征,这些特征能够区分包含OB女性的聚类。参与次级胆汁酸生物合成的基因在C2-C4聚类中很少或没有转录,脂质代谢谱也证明了这一点,C2中初级胆汁酸富集,在肥胖和代谢紊乱中初级胆汁酸水平普遍升高,除与代谢表型密切相关外,还可能导致屏障功能丧失和炎症。另一个值得注意的发现是,C2聚类中有许多低胆固醇和非胆固醇转化物,其中缺乏与胆固醇转化相关的细菌(如Ruminococcus、Coprococcus和Subdoligranulum)。与此一致的是,C3聚类的粪甾烷醇浓度最高。然而,GM的粪甾烷醇生成活性仍需要验证,据我们所知,目前还没有关于胆汁酸代谢和胆固醇转化与不受控制饮食行为之间可能存在关系的证据。在主要包括OB女性的聚类(尤其是C3)中存在一些与产生Trp衍生吲哚相关的高转录活性微生物基因。在OB受试者中,吲哚通常会减少,但值得一提的是,它们的过度生产最近被证明会导致动物模型中焦虑和抑郁样行为明显改变,这部分支持了我们的研究结果。另一方面,C2-C4聚类存在低mRNA水平的β-葡萄糖醛酸酶。这可能与饮食失调有关,最近的研究表明,β-葡萄糖醛酸酶活性降低与阿片类药物耐受性之间存在联系,阿片类药物与OB相关行为(如享乐体验和暴食)有关。最后,C4聚类显示出两个低至零转录活性的基因,一个参与甘油二酯的生物合成,另一个参与GABA的产生,GABA是哺乳动物大脑中的主要抑制性神经递质。最后一项发现与现有文献完全一致,该文献报道了肥胖和行为改变(如焦虑和抑郁)中GABA水平的降低,并将其与动物模型中食物摄入的降低联系起来。然而,迄今为止已经在大量所谓的精神益生菌中观察到谷氨酸脱羧产生GABA,包括Bifidobacterium spp.,在C4聚类中高度转录和表达。这可能表明,并非所有双歧杆菌物种/菌株都具有这种活性,或者在某些微生物组合和宿主病理生理因素的背景下,这种活性被抑制。至于可能与大麻素系统相关的基因,值得注意的是,临床试验表明,补充富含甘油二酯的油可以增加脂肪氧化,通过减少饥饿感、食欲和进食欲望来更好地控制食物摄入量。因此,我们推测C4聚类(主要表现在O_HA女性中)可能导致饱腹感/饥饿调节系统受损,因为它在控制食物摄入的功能方面特别差。
总之,通过探索性的多组学方法,将有关GM结构、生态网络、转录活性和脂质代谢的数据与饮食摄入信息以及临床和心理测试结果相结合,我们发现GM可以呈现一系列结构,其特征在于不同的微生物多样性和功能,它们可能反映宿主生理的许多方面,与宿主因素(包括饮食习惯和行为)有不同的相关性。特别是,行为高度失控的OB女性总体上GM多样性较低(C2和C4),主要由少数物种(R. torques和Bifidobacterium spp.)控制,且转录活性有限,特别是与已知在健康的肠-脑轴中起关键作用的代谢产物(如次级胆汁酸和GABA)相关。与此一致的是,他们的粪便中存在大量的初级胆汁酸和固醇,包括胆固醇。GM也与能量摄入增加有关。C2中的尿酸、胆固醇和SCFA水平较高,C4中纤维和碳水化合物摄入量较高,这对人类健康的潜在差异影响值得进一步关注。相比之下,NM女性的特征是GM有较高多样性(C1聚类),富含与健康相关的菌群,如R. bromii和F. prausnitzii,总体上相互连接较为紧密,具有转录活性,涵盖了主要的细菌代谢途径。C1聚类还以高纤维消耗和高SCFA水平为特征。必须指出的是,虽然C3聚类主要包括OB女性并且与SCFAs水平降低和固醇转化率较高相关,但它与C1聚类有许多共同特征,这表明C3聚类结构可能更容易重新定向。尽管收集了大量信息,但仍存在一些局限性:参与者根据MINI访谈进行了精神障碍筛查访问,并完成了一系列心理测试问卷,但可以完全排除心理困扰症状的存在;样本量小(尤其是O-HA组的OB女性);与自我报告的FFQ相关的潜在误差;NW/OB女性在GM聚类中的分布缺乏显著性;缺乏所有入选女性的临床数据,这可能导致未能确定聚类特异性临床特征;探索性关联分析方法和多重推理试验的高误报概率;缺乏使用更详尽的代谢组学方法来评估多个生物样本中可能由GM引起的其他分子;以及缺乏机制验证。
结论
该探索性研究表明,GM的独特组成和功能结构与饮食习惯和行为密切相关,从而使我们对与OB和不受控制的饮食行为相关的系统生物学产生了令人信服的假设。特别是在行为高度不受控制的OB女性中发现GM以低多样性,少数微生物为主,转录和脂质代谢较差为特征,这可能会对肠-脑通信产生负面影响。我们的发现应该在更大的患者队列中得到验证,并与动物实验相结合,以阐明潜在的机制。一旦得到证实,这些发现将为实施精准的微生物导向干预策略铺平道路,主要目的是恢复多样性,即微生物组成、生态相互作用和功能,从而形成一种饮食-GM-肠道-大脑轴,促进健康行为并预防OB相关并发症。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
早减肥,少患癌!BMC:肥胖使女性患子宫癌的风险增加一倍
环境如何通过微生物组影响人的健康?
肠道菌群及其代谢产物与妊娠期糖尿病相关性的研究进展
Nature子刊:移植瘦子的肠道菌群,能够改善肥胖患者健康
IF=91.2!南方医院证实:8小时饮食减肥法,靠谱!
电磁辐射对人体健康影响的多组学研究进展
Lancet综述:炎症性肠病患者的孕期指南
瘦型非酒精性脂肪肝的临床特征和蛋白质组学分析,Frontiers in Endocrinology
Nature首次证实:节食会改变肠道菌群组成,增加致病菌
联合国教科文组织授予乔杰赤道几内亚国际生命科学研究奖
网址: 科研丨BMC Medicine(IF:11.15): 肥胖女性的多组学肠道微生物组特征 https://www.trfsz.com/newsview36540.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






