
免疫代谢领域的飞速发展为靶向代谢的肿瘤免疫治疗提供了良好前景。将代谢抑制剂与免疫检查点抑制剂(immune checkpoint blockade, ICB)、放化疗和/或饮食治疗相结合为癌症治疗提供了新的方法。然而,如何在复杂的肿瘤微环境(tumor microenvironment, TME)中最好地的利用上述方案仍待探讨。肿瘤细胞代谢中癌基因驱动的变化可以影响TME以限制免疫反应,减少抗癌治疗效果。这也表明,靶向代谢通路来重塑TME或可促进免疫反应。2020年,Jackie E. Bader等人在《Molecular cell》杂志上发表了一篇题为《Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy》的综述,探讨了目前在TME中将免疫细胞代谢转变为促炎症状态的策略,并强调需要更好的复制生理条件,以选择目标,阐明机制,并优化代谢抑制剂。现介绍如下:

背景 肿瘤微环境(tumor microenvironment, TME)即肿瘤细胞产生和生活的内环境,其不仅包括了肿瘤细胞本身,还有与肿瘤细胞有密切联系的细胞、细胞间质等。TME中血管分化较差,导致氧气和营养输送以及代谢废物清除效率低进而导致TME中营养物质限制、低pH、低氧和代谢物质积聚。快速增殖的肿瘤细胞与进行抗肿瘤防御的免疫细胞竞争相对匮乏的营养物质,使得肿瘤细胞本身就可营造一种抗免疫的代谢微环境。在这种情况下,免疫细胞迫使自身产生耐受表型相关的代谢适应,如T细胞主要依赖有氧糖酵解和谷氨酰胺分解代谢来维持自身能量供应。最终,这些代谢适应可降低免疫细胞的抗肿瘤效力。因此,调节细胞代谢可为肿瘤治疗提供良好的方向。寻找既可以抑制肿瘤细胞代谢,提高TME营养水平或调节免疫代谢来增加炎症效应的靶点可最优化肿瘤治疗效力。但关键问题在于,一些对肿瘤细胞至关重要的代谢通路同样对免疫细胞的功能和状态至关重要。抑制这些通路可能达到相反的效果。此外,一些代谢通路具有环境特异性,不同的微环境可能导致不同的结果。
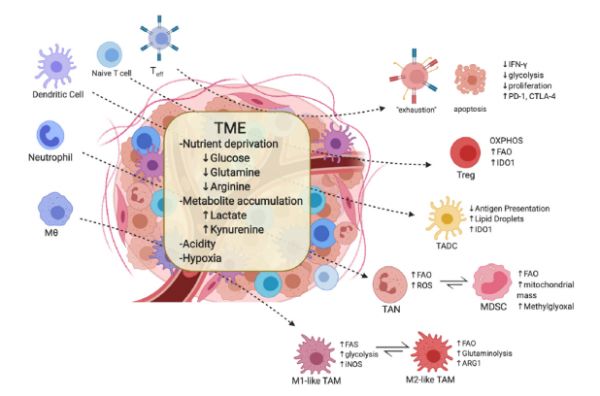
图1 肿瘤微环境和相关的免疫细胞代谢TME可加快效应T细胞(Teff)的耗竭并增加细胞表面免疫检查点的表达,促进调节性T细胞(Treg)、M2型巨噬细胞和骨髓源性抑制细胞(myeloid-derived dendritic cells, MDSCs)的分化和聚集。TME还产生独特的髓系细胞亚群如肿瘤相关树突状细胞(tumor-associated dendritic cells, TADCs)和肿瘤相关中性粒细胞(tumor-associated neutrophils, TANs),也被认为具有抑制性和耐受表型。
靶向TME中的低糖 肿瘤细胞增强的糖酵解以及TME中血管交换条件较差可导致TME中的葡萄糖利用率受限。将淋巴瘤细胞和T细胞共培养发现,淋巴瘤细胞对T细胞施加营养剥夺和代谢竞争,限制了它们产生效应细胞因子的能力。降低的葡萄糖利用率可限制T细胞的扩张和效应功能,或最终导致细胞衰竭。低糖环境还可诱导FOXP3的表达,增加T细胞从Teff向Tregs的分化。此外,肿瘤细胞中糖酵解代谢的加速增加了肿瘤源性粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony-stimulating factor, GM-CSF)和巨噬细胞CSF的产生进而促进MDSCs的浸润,抑制Teff的功能。以TME中的低糖可用性为目标的结果好坏参半。通过抑制糖酵解调节酶或使用竞争性葡萄糖类似物2-DG来减少癌细胞的糖酵解可能有效地减少癌细胞增殖并有助于形成长期记忆CD8+T细胞,但它也能抑制肿瘤浸润效应免疫细胞的增殖和功能。例如,Ho等人发现过表达糖异生酶PCK1可增强T细胞的抗肿瘤作用,这表明糖酵解中间产物在效应T细胞增殖和功能中发挥重要作用。最近发现,中和MDSC产生的甲基乙二醛二羰基活性可以提高肿瘤免疫治疗的疗效。包括PD-1, PD-L1和CTLA-4在内的免疫检查点可抑制免疫细胞的代谢重编程和糖酵解,增加脂肪分解和FAO。用检查点抑制剂阻断上述通路可通过恢复糖酵解和有利的合成代谢通路来挽救肿瘤浸润淋巴细胞(tumor-infiltrating lymphocytes, TILs)的功能(图2)。与此一致,利用CTLA-4, PD-1和PD-L1的抗体纠正了肿瘤诱导的葡萄糖对T细胞代谢的限制,恢复T细胞糖酵解和干扰素γ(IFN-γ)的产生。对于其他免疫细胞如骨髓特异性细胞,阻断PD-1可减少肿瘤的生长,而其背后的代谢机制尚不确定。尽管检查点阻断可显著提高肿瘤治疗的疗效,但其对高糖酵解性肿瘤(新抗原载量高、高水平的TILs、低MDSCs和IFN-γ分泌增加)最为有效。相反,对PD-1阻断反应性差与肿瘤糖酵解程度的相关性不如肿瘤高氧化磷酸化。这些数据显示了细胞代谢和检查点阻断之间的明确联系,结合代谢干预来破坏癌症代谢可能提高检查点抑制剂在不同肿瘤类型中的疗效。
靶向TME中的乳酸 肿瘤细胞在缺氧条件下的糖酵解活性增强会增加乳酸的积累,酸化TME。肿瘤细胞的乳酸产量可增加40倍,而乳酸脱氢酶(lactate dehydrogenase, LDH)与肿瘤大小和临床严重程度呈正相关。乳酸可通过降低T细胞增殖和IFN-γ的产生来抑制Teff功能,并通过降低TME的pH进一步抑制免疫功能。低pH可显著促进单核细胞源性的树突状细胞的分化,这些细胞减少葡萄糖消耗,上调线粒体呼吸基因和抑制mTORC1活性。因此,中和TME中低pH值可能促进抗癌免疫治疗。在黑色素瘤模型中,当与抗PD-1免疫治疗联合使用时,口服碳酸氢盐缓冲TME可以抑制肿瘤生长,与过继T细胞转移联合使用时提高生存率。T细胞活化V结构域Ig抑制剂(V-domain Ig suppressor of T cell activation, VISTA)与免疫检查点功能相关。在酸性pH下,VISTA可选择性抑制T细胞,VISTA或其受体PSGL-1的选择性抗体可逆转体内的免疫抑制。此外,在MC38肿瘤模型中,联合阻断VISTA和PD-1可导致肿瘤排斥。这项研究为利用TME的酸性环境来提高肿瘤治疗的效率提供了新的方向。除了维持TME的生理pH值外,乳酸堆积还对免疫细胞有直接的免疫抑制作用。首先,乳酸抑制单核细胞活化和树突状细胞分化,促进巨噬细胞向M2型极化。乳酸还可抑制NK细胞的功能,增加MDSCs,进一步促进免疫抑制微环境的形成。此外,癌细胞产生的乳酸激活免疫细胞和内皮细胞上的G蛋白偶联受体(GPR81),促进血管生成和免疫逃逸。在小鼠中敲除这一信号通路可减少IL-10的产生,抑制Tregs的生成。乳酸还可促进Treg在TME中的存活,因为Tregs具有氧化外源性乳酸的强大能力。上述研究表明,靶向乳酸反应通路或受体,如GPR81,或可为癌症治疗提供一种很有前途的方法。靶向LDH可产生很好的抗癌效果但对免疫细胞的作用不一。使用小分子或siRNA抑制LDH可改善肿瘤内乳酸水平和肿瘤退化但也可导致T细胞和IFN-γ产生减少。另一种针对乳酸的方法是抑制乳酸转运体。单羧酸转运体(monocarboxylate transporter, MCT)1和/或4抑制剂可增加细胞内乳酸,减少糖酵解,增强肿瘤细胞的死亡。并可增加T细胞IL-2和IFN-γ分泌,表明MCT干扰物可抑制肿瘤细胞增殖并支持T细胞活化。联合使用MCT1和4的抑制剂以及二甲双胍,可以在癌细胞中引起致命的能量危机。
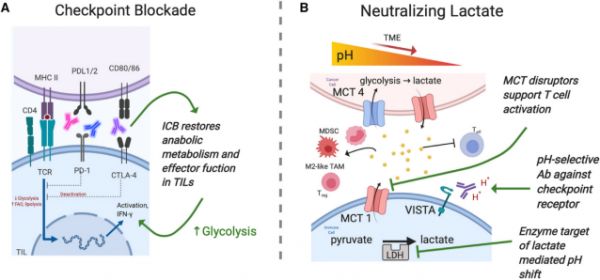
图2 葡萄糖代谢相关的治疗靶点
靶向氨基酸代谢 氨基酸是细胞代谢过程中不可或缺的部分。每个氨基酸在不同的代谢过程中扮演不同角色,谷氨酰胺、精氨酸和色氨酸可同时调节肿瘤进展和免疫反应(图3)。
谷氨酰胺和谷氨酸 谷氨酰胺是继葡萄糖之后循环中最丰富的氨基酸,也是癌细胞消耗最迅速的营养物质。谷氨酰胺可用来维持进行有氧糖酵解的癌细胞的TCA通量,为脂质合成提供柠檬酸。此外,谷氨酰胺分解可以抑制氧化应激,维持线粒体膜的完整性,有助于增殖细胞的存活。谷氨酰胺酶(GLS)将谷氨酰胺转化为谷氨酸,可抑制某些癌症的代谢。阻断GLS可减少谷氨酸,导致氧化还原和线粒体应激,细胞对此的反应是增加对天冬氨酸的依赖,作为谷氨酸再生和维持细胞氧化还原的手段。靶向这一途径可以减少癌细胞对葡萄糖的消耗。与癌症和免疫细胞都需要的葡萄糖不同,谷氨酰胺可能被癌症和免疫细胞不同地利用。巨噬细胞亚群表现出对谷氨酰胺依赖性的内在差异。例如,M2巨噬细胞比M0巨噬细胞消耗更多的谷氨酰胺,而M1促炎巨噬细胞可被谷氨酰胺分解抑制。在乳腺癌模型中,抑制谷氨酰胺代谢通过减少MDSC的聚集,促进其向炎性M1型巨噬细胞转化,降低肿瘤生长。抑制巨噬细胞内谷氨酰胺的产生可促进巨噬细胞向M1型转化并增强糖酵解,激活HIF-1α。这表明,可以靶向细胞内的谷氨酰胺,促进肿瘤相关巨噬细胞(TAM)向M1转化抑制肿瘤的生长。谷氨酰胺代谢在Teff激活中增加。去除谷氨酰胺可以改变Th1分化,并将CD4+T细胞转化为Treg表型。T细胞中谷氨酰胺转运蛋白ASCT2的遗传缺失导致Th1和Th17细胞的生成和功能受损而Tregs并无改变。阻断谷氨酰胺代谢联合抗PD-1可通过抑制肿瘤代谢和促进T细胞葡萄糖代谢、表观遗传重编程和细胞毒性进而显著改善了抗肿瘤作用。

图3 氨基酸相关治疗靶点
靶向脂肪酸代谢 高增殖的癌细胞表现出对脂质和胆固醇的高亲和力。许多癌细胞可上调脂质和胆固醇生物合成的酶。过量的脂质和胆固醇储存在脂滴中,这与癌症的侵袭性在数量上相关。因此,抑制脂肪酸合酶(fatty acid synthase, FASN)可用于肿瘤治疗。然而,抑制癌细胞中的脂肪酸代谢也间接影响免疫细胞的功能(图4)。脂肪酸和脂质堆积对不同免疫细胞的影响不同,但脂质聚集通常导致免疫抑制作用。在髓系细胞中,细胞内脂质的堆积增强氧化代谢,促进免疫抑制。不饱和脂肪酸油酸的存在使髓源性骨髓细胞极化为免疫抑制的M2型TAM。肿瘤浸润性DC细胞(tumor-infiltrating DCs, TIDCs)的异常脂质积累损害了它们的抗原呈递。在小鼠卵巢癌模型中,TIDCs从TME中摄取过多的脂质导致T细胞启动和激活差。TME中脂肪酸堆积对免疫细胞有直接影响,在小鼠肿瘤模型中通过靶向FAS或FAO改善脂肪丰度是有益的。比如,利用乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)抑制剂TOFA抑制FAS可正常化DCs中脂质水平以恢复其活性,并大大提高了癌症疫苗的效果。在卵巢癌模型中,抑制FASN也可部分挽救TIDC功能。或者,抑制脂肪酸氧化(fatty acid oxidation, FAO)可限制M2型巨噬细胞的免疫抑制功能。靶向T细胞中的脂肪酸代谢可对不同的T细胞亚群产生不同的作用。一方面,FAO是CD8+记忆性T细胞形成的必要条件,然而它对Tregs的分化也很重要,阻断FAO可阻断免疫抑制性Tregs的聚集。在小鼠黑色素瘤模型中,CD8+ TILs增强脂肪酸的PPAR-α信号传导和分解代谢,以保持其效应功能。最近发现,脂质转运体CD36促进肿瘤中Treg的存活和功能。抑制T细胞脂肪酸结合蛋白FABP5,增强Treg抑制。而抑制FASN可保护T细胞避免再刺激诱导的细胞死亡(restimulation-induced cell death, RICD)。因此,抑制FASN可避免TME中的T细胞因反复受到T细胞抗原受体(T cell receptor ,TCR)的刺激导致凋亡,增强T细胞的抗肿瘤作用。此外,破坏FAO对RICD并无重要影响,这突出了不同脂肪酸代谢途径在编程免疫细胞凋亡敏感性方面的特异性。在另一项研究中,抑制FAO可减缓肿瘤生长,促进T细胞抗肿瘤作用。复杂的脂质和胆固醇代谢为调节TME和特定的免疫细胞群提供了机会。
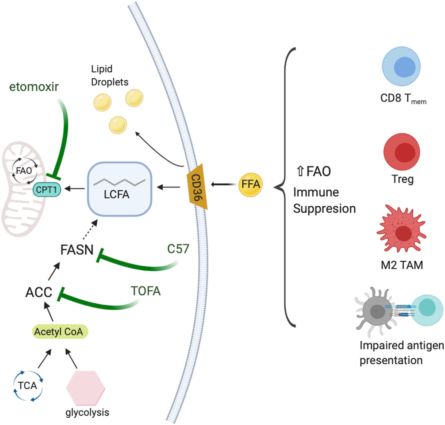
图4 TME中脂质代谢
“论肿道麻”点评
免疫代谢通过调节TME提供了广泛的机会以确定新靶点,改善癌症治疗。虽然专注于癌症或免疫细胞的单一代谢途径的研究有助于更好地理解TME内的代谢,但一个特定途径的单一酶或转运体无法从整体水平把控TME。而将代谢靶点与化疗或靶向干预治疗(包括免疫检查点阻断)相结合的方法,为提高临床疗效提供了最大的潜力。例如,二甲双胍可缓解异种移植瘤的缺氧状态,使其对ICB敏感,增强免疫细胞功能。此外,PD-L1上丝氨酸残基的磷酸化依赖于AMPK,这可增强其降解。在乳腺癌患者活检样本中,临床反应、AMPK激活与PD-L1低表达之间存在显著相关性。TME特异性治疗的另一个重要考虑因素是TME对免疫细胞运输的影响。宿主菌群结构的影响与癌症免疫治疗(特别是免疫检查点阻断)的成功密切相关。考虑到细胞代谢对癌症治疗的影响,人们越来越重视营养和饮食干预。有趣的是,非常低碳水化合物或生酮饮食促进了一些抗癌免疫疗法,而高脂肪饮食可能加剧恶性肿瘤。同样,热量限制(CR)可以改善某些癌症的发病率和严重程度。具体而言,生酮饮食、CR或间歇性禁食改善的结果与TIL百分比增加和Treg减少相关。生酮饮食消耗葡萄糖,从而降低肿瘤糖酵解产生的乳酸。随后导致肿瘤变小。MDSC频率降低,抗肿瘤免疫反应整体改善。然而,饮食操纵可调节肠道微生物群,进而影响肿瘤和免疫代谢,甚至在调节肿瘤对多种癌症免疫治疗的反应中发挥重要作用。尽管微生物干扰(间接通过改变饮食或直接通过益生菌和/或粪便移植)可以使个性化的免疫治疗成为可能。但由于肠道微生物的复杂功能,实现这一可能仍需更多的研究。
未来的研究重点在于建立模型系统,更好的复制生理条件,以揭示代谢途径背后的明确机制,克服环境依赖的细胞代谢方面。大多数免疫代谢领域的研究都是基于体外培养条件下快速增殖的优化培养基或仅限于小鼠模型的体内观察而得出的广泛结论。考虑到TME的复杂性,研究结果需在多种模型中重复。除癌细胞外,免疫细胞的表型变化也需关注。近年来,肿瘤代谢、免疫代谢和免疫治疗领域的研究日益深入,使人们能够更深入的了解这些途径,并推进综合方法来改善癌症治疗。
编译:花晴,述评:许平波
审校:张军,缪长虹
原始文献:Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy. Bader, J E; Voss, K; Rathmell, J C. Mol Cell. 2020;78(6):1019-1033. doi: 10.1016/j.molcel.2020.05.034. Epub 2020 Jun 18.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
【论肿道麻】肿瘤脂肪酸代谢在治疗抵抗和肥胖中的作用
【论肿道麻】饮食和运动在肿瘤代谢中的作用
mRNA疗法:肿瘤免疫治疗的新曙光?
靶向代谢治疗,推动免疫治疗革命
中国医学科学院等团队合作发现最新抗肿瘤免疫治疗策略
解婧:“饿死”肿瘤是重要的抗癌思路
STAT调控肿瘤脂质代谢
《中国恶性肿瘤学科发展报告(2021)》—肿瘤营养未来展望篇
【论肿道麻】Sirtuins: T细胞代谢和功能的重要调节因子
【论肿道麻】Nature Reviews Cancer:饮食干预作为癌症的治疗手段
网址: 【论肿道麻】靶向代谢改善肿瘤微环境的抗肿瘤免疫疗法 https://www.trfsz.com/newsview373269.html
 免疫代谢领域的飞速发展为靶向代谢的肿瘤免疫治疗提供了良好前景。将代谢抑制剂与免疫检查点抑制剂(immune checkpoint blockade, ICB)、放化疗和/或饮食治疗相结合为癌症治疗提供了新的方法。然而,如何在复杂的肿瘤微环境(tumor microenvironment, TME)中最好地的利用上述方案仍待探讨。肿瘤细胞代谢中癌基因驱动的变化可以影响TME以限制免疫反应,减少抗癌治疗效果。这也表明,靶向代谢通路来重塑TME或可促进免疫反应。2020年,Jackie E. Bader等人在《Molecular cell》杂志上发表了一篇题为《Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy》的综述,探讨了目前在TME中将免疫细胞代谢转变为促炎症状态的策略,并强调需要更好的复制生理条件,以选择目标,阐明机制,并优化代谢抑制剂。现介绍如下:
免疫代谢领域的飞速发展为靶向代谢的肿瘤免疫治疗提供了良好前景。将代谢抑制剂与免疫检查点抑制剂(immune checkpoint blockade, ICB)、放化疗和/或饮食治疗相结合为癌症治疗提供了新的方法。然而,如何在复杂的肿瘤微环境(tumor microenvironment, TME)中最好地的利用上述方案仍待探讨。肿瘤细胞代谢中癌基因驱动的变化可以影响TME以限制免疫反应,减少抗癌治疗效果。这也表明,靶向代谢通路来重塑TME或可促进免疫反应。2020年,Jackie E. Bader等人在《Molecular cell》杂志上发表了一篇题为《Targeting Metabolism to Improve the Tumor Microenvironment for Cancer Immunotherapy》的综述,探讨了目前在TME中将免疫细胞代谢转变为促炎症状态的策略,并强调需要更好的复制生理条件,以选择目标,阐明机制,并优化代谢抑制剂。现介绍如下:










