体内稳态和肿瘤免疫中的T细胞代谢

背景
传统的CD4+或CD8+T细胞通过表达αβ T细胞受体(TCRs),识别肿瘤抗原和自身抗原,因此在形成癌症或自身免疫性疾病的免疫反应塑造中起到关键作用。在同源抗原刺激后,T细胞被激活、增殖,响应环境信息后进行功能性分化。未经抗原刺激的初始CD8+ T细胞分化为细胞毒性效应细胞和长期记忆细胞。初始CD4+ T细胞分化为Th1、Th2、Th17和Tfh效应细胞,它们也可以形成长期记忆细胞,以及表达Foxp3的免疫抑制Treg细胞。肿瘤免疫疗法的一个长期目标是确定刺激T细胞对肿瘤抗原反应的因素。肿瘤抗原可能是肿瘤特有的(肿瘤特异性抗原)或以时间、空间不同形式表达的自身抗原(肿瘤相关抗原)。癌症的发展通常与免疫抑制性肿瘤微环境(TME)有关,其中肿瘤特异细胞毒性CD8+ T细胞经常不足或功能失调,无法根除恶性细胞。此外,Treg细胞在肿瘤背景下增多并得到功能性成熟,主导免疫抑制性TME的形成。因此,肿瘤抗原通常无法引导有效的抗肿瘤反应。虽然针对免疫检查点通路的治疗通过重振肿瘤特异性T细胞反应在临床上取得了显著成功,但仍存的主要挑战之一是自身免疫样的免疫相关不良事件(irAE)的发展。此外,尽管清除Treg细胞可以迅速根除肿瘤,但Treg细胞功能的丧失促进了严重的自身免疫和炎症并发症的发展。因此,成功的免疫疗法需要深入了解稳态及抗肿瘤免疫的基本机制。
尽管免疫受体、信号蛋白和转录因子决定了T细胞的反应,但新兴数据已确定细胞代谢是T细胞存活、增殖和功能的核心调节剂。代谢重排如何影响原位T细胞功能适应尚未得到充分的探索。最近,大量研究通过探索TME和其他疾病中潜在影响T细胞和Treg细胞功能适应性的免疫代谢变化,试图努力填补这一具有重要治疗意义的空白。本文主要讨论最新进展,特别是TME中效应T细胞和Treg细胞中的免疫代谢。
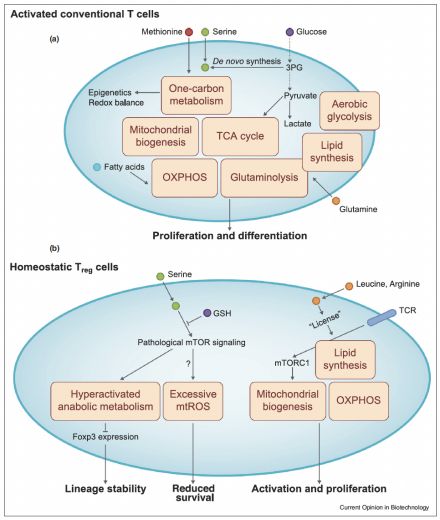
免疫和稳态中的T细胞代谢
细胞-内在代谢途径指导T细胞的激活状态(图1a)。特别是有氧糖酵解、谷氨酰胺分解和线粒体相关功能,如氧化磷酸化(OXPHOS)和单碳代谢,通过调节其激活和分化来支持效应T细胞反应。总的来说,这些途径作为生物能量遗传、生物合成和信号枢纽,允许T细胞的增殖扩张和效应器分化。除了细胞内在代谢因子外,细胞外营养素、代谢物和生长因子环境也调节效应T细胞的功能适应性。事实上,葡萄糖进入细胞对支持有氧糖酵解很重要,而葡萄糖、谷氨酰胺或脂肪酸分解代谢可以通过三羧酸(TCA)循环驱动通量,以支持生物合成反应和线粒体氧化磷酸化,而这两者都对调节T细胞功能至关重要。除了谷氨酰胺外,其他氨基酸也与支持T细胞激活和免疫反应有关。例如,细胞外蛋氨酸调节表观遗传编程,以调整CD8+ T细胞命运,并与丝氨酸(可以从葡萄糖重新合成或从细胞外来源提取)合作,以促进单碳代谢。此外,丝氨酸代谢对于通过合成谷胱甘肽(GSH)来调节细胞氧化还原状态也至关重要,谷胱甘肽是CD4+和CD8+ T细胞反应的重要调节剂。通过整合细胞内和细胞外代谢程序,T细胞对抗肿瘤免疫起着关键作用,是成功免疫疗法的基石。
Treg细胞具有强大的免疫抑制功能,对于保持自身耐受和控制自身免疫和组织炎症反应至关重要。研究结果揭示了细胞代谢过程在调节Treg细胞功能完整性方面的重要作用(图1b)。Treg细胞比效应CD4+ T细胞具有更明显的糖酵解和线粒体代谢。此外,线粒体代谢对支持Treg细胞功能、自我耐受性和免疫稳态至关重要,这体现在Treg特异性缺失线粒体呼吸链组件或线粒体转录因子A(Tfam)时自身免疫性疾病的发展。Treg细胞的激活及功能也需要合成代谢过程,如脂质合成和甲酮酸-代谢依赖性蛋白质异戊烯化;然而,产生ROS的过量有氧糖酵解或线粒体呼吸对Treg细胞谱系稳定性有害。最近的研究揭示了营养素在调节Treg细胞功能适应性方面的重要作用。氨基酸,特别是精氨酸和亮氨酸,通过RagA/B和Rheb1/2发出信号,以允许TCR诱导的mTORC1激活和随后Treg细胞线粒体代谢变化。此外,Treg细胞因GSH丢失导致的丝氨酸摄取和代谢异常导致mTORC1激活、增殖、Foxp3表达和抑制功能受损,导致产生致命的自身免疫炎症,可以通过丝氨酸/甘氨酸缺乏饮食来治疗。最后,肠道免疫稳态由Treg细胞维持,微生物胆汁酸代谢物对结肠Treg细胞的产生和抑制肠道炎症至关重要。这些研究共同表明,Treg细胞的功能完整性和自身免疫反应的抑制需要适当的细胞代谢调控。
肿瘤特异性T细胞的代谢激活
免疫抑制性的TME是癌症的标志之一,也是肿瘤免疫逃逸的基础。效应T细胞在控制癌症发展方面发挥着关键作用;相反,Treg细胞促进TME中的免疫抑制,这通常与肿瘤进展有关。因此,效应T细胞和Treg细胞之间的功能平衡是肿瘤进展中免疫控制有效性的决定因素。最近的研究阐明免疫代谢在决定TME中的效应T细胞(图2)和Treg细胞(图3)的功能适应性方面的作用取得了重大进展,称为效应-调节平衡。
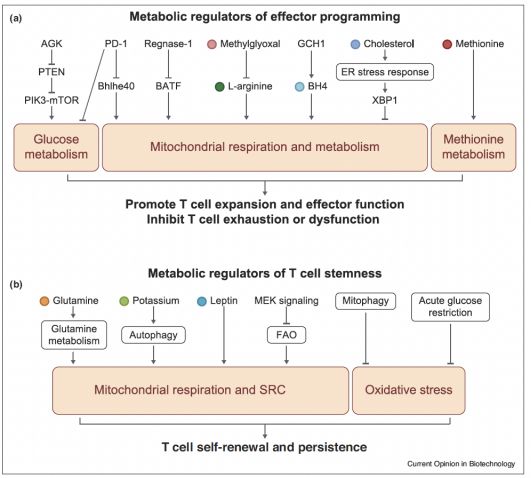 Fig. 2 细胞代谢塑造肿瘤浸润效应T细胞反应和分化
Fig. 2 细胞代谢塑造肿瘤浸润效应T细胞反应和分化 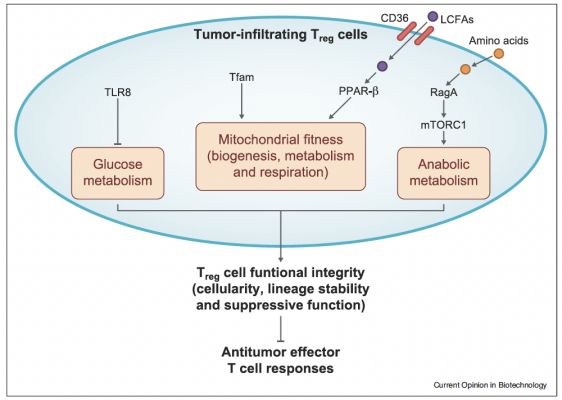
Fig.3 细胞代谢调节肿瘤中Treg细胞的功能适应性
葡萄糖的代谢是肿瘤内T细胞功能的重要调节因子。肿瘤内经常发生对包括葡萄糖在内的营养物质的竞争 。因此,效应CD8+ T细胞中葡萄糖或糖酵解代谢物磷酸烯丙酸酯(PEP)的限制会抑制抗肿瘤反应。然而,最近有报道称,通过急性葡萄糖限制可以提高过继转移的CD8+ T细胞的抗肿瘤活性,这使得它们在葡萄糖再富足摄取时更有效地将葡萄糖衍生的碳穿梭到合成代谢程序中。CD8+ T细胞还可以利用肌苷作为碳源,在体外试验中,葡萄糖受限时,腺苷可以支持细胞增殖和效应器功能,促进效应T细胞在TME中的扩张和功能。T细胞对替代营养源的适应如何影响TME中的效应器功能仍有待充分探索。PI3K-mTOR信号在葡萄糖代谢中具有公认的作用,但其在初级T细胞中的上游调节因子尚未明确。酰甘油激酶(AGK)是一种参与脂和糖脂代谢的酶,通过与抗原识别后与PTEN(拮抗PI3K信号的脂磷酸酶)相互作用并抑制,被确定为mTORC1和随后代谢再编程的上游激活剂,从而促进CD8+ T细胞增殖和抗肿瘤功能。因此,葡萄糖代谢通过调节细胞信号及合成代谢程序以支持肿瘤特异性T细胞功能。
T细胞还需要线粒体满足快速增殖、激活和功能的代谢需求。因此,线粒体适应性受损是肿瘤中效应CD8+ T细胞功能障碍的基础,而恢复线粒体代谢可以恢复肿瘤浸润性效应CD8+ T细胞的功能。近期研究揭示了支持线粒体代谢,从而促进了TME中T细胞扩张和功能的影响因素。转录因子在塑造效应T细胞反应方面具有公认的作用,其介导的代谢程序及其对抗肿瘤T细胞反应的贡献才刚刚开始探索。转录因子BATF通过支持线粒体适应,已被确定为肿瘤特异CD8+ T细胞扩张和肿瘤效应因子功能的限制因素。与肿瘤不同的是,BATF的过度表达不会促进病毒感染模型中效应CD8+ T细胞的扩张。此外,转录因子Bhlhe40有助于维持线粒体代谢,线粒体代谢驱动乙酰辅酶A(CoA)合成和肿瘤浸润CD8+ T细胞的CoA相关表观遗传规划,促进其积累和效应器功能。肿瘤中的CD8+ T细胞功能障碍部分是由PD-1信号传导下游Bhlhe40的下调驱动的。事实上,抗PD-L1阻断依赖性地重振肿瘤浸润的CD8+ T细胞需要Bhlhe40再表达。因此,转录因子可以在抗肿瘤免疫期间调节代谢功能,其活性与关键检查点的阻断途径相交叉,包括PD-1-PD-L1。
近期研究发现了调节TME中效应T细胞功能的代谢物。线粒体呼吸由细胞内代谢物BH4支持,BH4由限速酶GTP环氢酶1(GCH1)产生。在T细胞中敲除GCH1会导致有缺陷的增殖和线粒体呼吸;相比之下,通过过度表达GCH1来促进BH4的产生,可以促进肿瘤浸润CD4+和CD8+ T细胞的增殖,从而抑制肿瘤生长。此外,在TME中,来自髓源性抑制细胞(MDSC)的甲基糖醛通过耗尽L-精氨酸来抑制CD8+ T细胞的线粒体呼吸、激活和增殖。这一观察符合L-精氨酸在支持抗肿瘤效应CD8+ T细胞功能方面的关键作用。这些结果突显了细胞代谢物在调控T细胞线粒体代谢和TME中效应器功能中不可或缺的作用。
TME中T细胞分化状态的代谢控制
肿瘤特异性CD8+ T细胞的抗肿瘤活性取决于它们的分化状态和寿命。最新发现确立了免疫代谢在控制肿瘤浸润效应T细胞命运决定中的作用。在TME中,大多数肿瘤特异性CD8+ T细胞表达高水平的抑制受体,效能有限并经常表现为功能失调的分化状态,被称为“耗竭”。最新的研究已经开始阐明肿瘤浸润CD8+ T细胞功能障碍的代谢驱动因素。虽然质膜胆固醇水平的升高增强了抗肿瘤CD8+ T细胞反应,但肿瘤浸润的CD8+ T细胞对胆固醇的吸收激活了ER应激反应和肌醇需要酶1α(IRE1α)-X盒结合蛋白-1(XBP1)信号,以诱导抑制性受体表达和CD8+ T细胞耗竭,这表明胆固醇代谢在调节T细胞功能中的作用不同。此外,蛋氨酸代谢依赖性表观遗传程序对于建立CD8+ T细胞效应器功能至关重要,但肿瘤细胞通常表达高水平的蛋氨酸转运蛋白Slc43a2,通过在TME中与CD8+ T细胞竞争蛋氨酸导致CD8+ T细胞功能障碍。Slc43a2在肿瘤细胞上的高表达与患者CD8+ T细胞功能障碍有关,补充蛋氨酸可以逆转CD8+ T细胞功能障碍并恢复抗肿瘤反应。因此,探索TME的营养素水平波动如何驱动CD8+ T细胞功能障碍非常重要。
虽然耗尽的CD8+ T细胞的作用有限,但肿瘤浸润的耗竭CD8+ T细胞子集保持了干细胞样状态,并保留了自我更新能力和效应器子集的重建。保持干细胞样状态对于肿瘤特异性CD8+ T细胞的持久性和抗肿瘤疗效至关重要,因此人们非常有兴趣了解促进CD8+ T细胞“干细胞化”以改善肿瘤免疫治疗的代谢程序。特别是改善线粒体适应性的途径已成为TME中干细胞样细胞与功能失调T细胞的关键调节剂。事实上,针对TME中的慢性抗原刺激,CD8+ T细胞的线粒体氧化应激增加,导致与T细胞功能障碍增加相关的干细胞化和抗肿瘤疗效下降。这些影响部分归因于肿瘤浸润的CD8+ T细胞中去极化的线粒体的积累,原因是这些细胞的线粒体减少。研究表明,通过急性葡萄糖限制或抗氧化剂治疗来改变氧化还原代谢,以利于保持耗竭状态,改善CD8+ T细胞的抗肿瘤活性;这种效果与改善T细胞的自我更新能力有关。虽然肿瘤组织中的高钾激活饥饿反应相关线粒体代谢,抑制效应器分化相关表观遗传的重塑,但钾刺激的肿瘤浸润CD8+ T细胞也获得干细胞相关程序,使其具有强大的抗肿瘤活性。线粒体呼吸能力也与CD8+ T细胞干细胞样状态有关,记忆CD8+ T细胞显示高线粒体备用呼吸能力(SRC)。因此,限制谷氨酰胺代谢可以增强氧化代谢和SRC,推动CD8+ T细胞形成一种持久的干细胞样状态,这种状态与抗肿瘤反应有关。此外,脂肪因子瘦素诱导肿瘤浸润的CD8+ T细胞的代谢重排,导致SRC、干细胞样表型和抗肿瘤功能增加。最后,抑制MEK信号可以改善脂肪酸氧化驱动的线粒体OXPHOS,并提高CD8+ T细胞的抗肿瘤免疫的干细胞化。因此,改善线粒体功能的途径,包括SRC和脂肪酸氧化、减少氧化应激,是改善T细胞寿命的希望目标,从而促进T细胞更好地发挥抗肿瘤反应。
抗肿瘤免疫中T细胞代谢活性的负性调控
除了这些线粒体适应的正性调节因子外,研究还揭示了抑制代谢和抑制效应T细胞在抗肿瘤免疫期间扩增和细胞功能的因素。由于有氧糖酵解率高,肿瘤细胞经常产生和分泌乳酸,事实证明乳酸可以通过限制CD8+ T细胞的激活和CD4+ T细胞的有氧糖酵解来减少T细胞反应。卵巢肿瘤被发现通过诱导ER应激和T细胞的下游XBP1信号传导来抑制CD4+和CD8+ T细胞的线粒体代谢;值得注意的是,靶向XBP1可以恢复肿瘤浸润效应T细胞的线粒体呼吸、功能和抗卵巢肿瘤的影响。此外,尽管激活的CD8+ T细胞产生的S-2-羟戊二酸促进CD8+ T细胞的增殖和抗肿瘤活性,但其对映体R-2-羟戊二酸酯是由异基脱氢酶(IDH)突变肿瘤产生并积累在肿瘤组织中,以抑制线粒体呼吸,并使TME中的CD4+和CD8+效应T细胞失去功能。抑制TME中R-2-羟基戊二酸酯的产生可恢复抗肿瘤效应CD8+ T细胞反应,并抑制肿瘤生长。因此,TME中的外部因素可以抑制T细胞的抗肿瘤活性。
亦有研究报告了T细胞代谢重排的细胞内负调节因子。例如,通过检查点阻断分子PD-1和CTLA4发出信号可以改变激活CD4+和CD8+ T细胞的代谢状态,包括减少糖酵解,这表明针对这些分子的免疫疗法可能部分通过重排肿瘤浸润T细胞的代谢程序来发挥作用。此外,内核糖核酸酶Regnase-1作为抗肿瘤CD8+ T细胞反应的主要负调节剂,通过抑制BATF依赖线粒体适应,抑制肿瘤部位特定CD8+ T细胞的扩增后释放。Sirtuin-2(Sirt2)是一种NAD+依赖的脱乙酰酶,通过抑制关键代谢酶的表达来抑制葡萄糖、脂质生成和线粒体代谢,抑制Sirt2可以增强CD4+和CD8+ T细胞的增殖和抗肿瘤功能。SIRT2对T细胞代谢和抗肿瘤反应的抑制也在癌症患者中被发现。总的来说,这些发现表明,代谢是抗肿瘤T细胞扩张和效应器功能的基本决定因素,需要进一步研究以揭示代谢适应性的各种正负调节因素如何在TME中协调。
Treg细胞代谢与肿瘤免疫抑制
Treg细胞常在肿瘤中积聚,它们建立免疫抑制性的TME并抑制抗肿瘤效应器的反应,这使其成为肿瘤免疫治疗的主要障碍和治疗靶点。鉴于Treg细胞在维持自我耐受和免疫稳态方面有不可或缺的作用,选择性地破坏肿瘤中的Treg细胞功能是一个相当大的挑战。例如,Treg细胞特异性缺失RagA(一种鸟嘌呤核苷酸结合蛋白,介导氨基酸诱导的mTORC1激活),激活抗肿瘤T细胞反应并抑制肿瘤生长;而RagA的丧失也会导致延迟出现的自身免疫发展,RagA和RagB的联合缺乏导致小鼠具有坏血症样的致命自身免疫。同样,Treg细胞中对线粒体呼吸链活动很重要的Tfam的缺失会损害肿瘤浸润Treg细胞的积累和谱系稳定性,并抑制肿瘤生长。然而,线粒体呼吸链缺乏的Treg细胞也无法保持自我耐受。因此,Treg细胞代谢程序重排的后果很复杂,如何在肿瘤中实施功能适应性仍有待探索。
Treg细胞表现出不同于效应T细胞的代谢情况,这表明,识别与其独特代谢状态相关的途径,特别是在TME中,可以为肿瘤免疫治疗提供强有力的观点。最近的一项研究在这方面取得了进展,表明葡萄糖代谢对支持人类外周循环中Treg细胞的抑制功能很重要,通过TLR8激活抑制葡萄糖代谢会抑制淋巴组织和肿瘤中的Treg细胞活性。清道夫受体CD36介导长链脂肪酸的摄取,在肿瘤浸润的Treg细胞上表达增加。CD36因其可以保持过氧化物酶体增殖激活受体-β(PPAR-β)信号依赖性线粒体的适应性,为肿瘤Treg细胞积聚所必需。相比之下,脂肪酸结合蛋白5(FABP5)是脂质摄取所需的脂质伴侣,其抑制增强了Treg细胞的抑制能力,这与线粒体适应性改变有关,表明通过FABP5摄取脂肪酸从而抑制Treg细胞的活性。因此,肿瘤浸润的Treg细胞比循环Treg细胞摄入的脂肪酸更少,并显示在FABP5缺乏的Treg细胞中观察到线粒体变化和增强的抑制活性。此外,我们最近发现Treg细胞有选择地需要脂质信号程序来支持他们在TME中的功能性分化。仍需进一步研究来揭示脂质代谢需要何物及通过何种潜在机制去决定肿瘤中Treg细胞适应的,这可能有助于调和这些看似不同的研究结果。通过调节细胞内代谢网络,是否以及如何在TME中选择性地塑造Treg细胞功能适应性也迫切需要研究。
“论肿道麻”述评
虽然多个细胞代谢途径 在 控制效应 T 细胞和 Treg 细胞的功能适应,但不清楚各种代谢因素 是 如何在复杂的疾病环境中 相互 协调 的 。有几个重要问题仍有待解决。首先,需要 明确 细胞代谢在调节 T 细胞功能状态中的特定功能。例如, Gpi1 依赖性 的 代谢是 CD4+ Th17 细胞在 乏 氧炎症但非稳态条件下不可或缺的,这表明 需 进一步探索特定疾病的免疫代谢。有必要确定每个生理环境中与功能相关的调节 因子 和路径,以确定如何在 TME 中进行治疗性修改免疫代谢途径,特别是为了避免自身免疫或 irAE 的发展。 CRISPR-Cas9 联合突变筛选代谢相关因子已成功应用,例如用于抗肿瘤 CD8+ T 细胞反应中,能够系统 地 和 全方面地 发现在特定条件下控制给定 T 细胞功能的关键代谢相关分子和路径。此外, T 细胞的代谢状态需要在疾病背景下进行 描述 ,例如在 CD8+ T 细胞中使用代谢跟踪方法,以揭示 在 体内和体外 研究中 的 T 细胞代谢表型之间的根本差异。其次,鉴于TME和稳态器官中T细胞功能群体的异质性,应在单细胞分辨率下研究代谢因素在调节T细胞功能和命运决定中的作用。例如,单细胞RNA测序结果揭示了Regnase-1和mTORC1在定义肿瘤特异性CD8+ T细胞和CD4+ Th17细胞中记忆细胞样子集中的作用。尖端技术的发展,如将CRISPR联合筛选与单细胞转录组分析相结合,进一步帮助系统地识别T细胞功能中与功能相关的因素,并在单细胞分辨率下做出命运决定。新出现的单细胞代谢分析技术可以揭示T细胞子集或不同组织环境中的细胞子集之间的代谢异质性,也可能有助于描述抗肿瘤效率最高的细胞群,包括某些干细胞样细胞群。第三,最近的研究强调,肿瘤细胞可以通过调节TME中代谢物的可用性使T细胞丧失功能。需要进行更多研究以进一步确定营养感应过程如何影响肿瘤中的T细胞功能。事实上,有新证据表明,系统营养状况会影响抗肿瘤免疫或癌症治疗。此外,来自临床试验的证据支持饮食改变可能会改善癌症治疗的临床预后的观点,但其对免疫系统的影响需要进一步研究。因此,了解常规T细胞或Treg细胞中细胞特异性或微环境特异性营养物质运输、传感和信号的机制,可能会发现针对肿瘤免疫代谢而不会导致如自身免疫或irAE的新疗法。总体而言,对疾病背景下T细胞代谢的详细描述和全面了解将转化为癌症和自身免疫性疾病的创新疗法。编译:关昱;述评:翁梅琳
审校:张军,缪长虹
 参考文献: Leone RD, Powell JD. Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy. Cancer Immunol Res. 2021 Mar;9(3):255-260. doi: 10.1158/2326-6066.CIR-20-0791. PMID: 33648947; PMCID: PMC8240594.
参考文献: Leone RD, Powell JD. Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy. Cancer Immunol Res. 2021 Mar;9(3):255-260. doi: 10.1158/2326-6066.CIR-20-0791. PMID: 33648947; PMCID: PMC8240594. ( 向上滑动查看内容 )
“论肿道麻”系列回顾:
点击标题,温故知新
244.靶向代谢治疗,推动免疫治疗革命
233.Nature Reviews Cancer综述:肿瘤的系统性免疫
232.肿瘤微环境中的铁代谢:固有免疫细胞的贡献
231.肿瘤中固有免疫细胞的代谢
230.Immunity: 炎症、感染、免疫代谢中的自噬
229.手术相关转移的神经免疫调节
228.围术期红细胞输注与胃肠道癌症手术患者全因死亡率和癌症特异性死亡率的相关性研究:一项人群队列研究的长期随访结果
227.Science综述:代谢重塑与癌症进展
226.顶刊发文模拟限制饮食联合激素治疗可诱导乳腺癌消退
225.Cell重磅综述:健康的标志
224.代谢竞争:昼夜节律稳态和肿瘤发生
223.肠道菌群对接受免疫治疗癌症患者的作用:饮食和药物治疗的影响
222..乳酸在炎症和肿瘤微环境中的免疫调节作用
221.肿瘤微环境中的细胞间线粒体转移
220.静脉或吸入麻醉(伴或不伴静脉利多卡因)对乳腺癌术后中性粒细胞胞外诱捕和血管生成生物标志物的影响:一项前瞻性随机试验
219.肌动蛋白调节剂hMENA调节GAS6-AXL轴和促肿瘤癌细胞/基质细胞合作
218.普瑞巴林联合吗啡治疗胰腺癌疼痛的镇痛效果,一项回顾性研究
217.全身麻醉和镇静下行内镜逆行胰胆管造影(ERCP)术后结局的比较
216.原发性乳腺癌患者的麻醉和循环肿瘤细胞:一项随机对照研究
215.如何降低胸外科患者术后肺部并发症
214.音乐与咪达唑仑在缓解术前神经阻滞过程中焦虑的效果比较:一项前瞻性随机对照研究
213.麻黄碱与去氧肾上腺素对麻醉中脑肿瘤患者脑血流和耗氧量的影响——一项随机临床试验
212.美沙酮与吗啡用于妇科肿瘤手术患者术后镇痛的比较:一项随机对照临床研究
211.术中阿片类药物与改善三阴性乳腺癌无疾病复发存活期有关
210.肿瘤细胞转移期间的代谢特征
209.七氟烷麻醉对体内结合单胺氧化酶-B的放射性配体的影响
208.罗哌卡因腹腔注射可缩短晚期卵巢癌术后开始化疗的时间间隔:一项随机对照双盲试点研究
207.地塞米松用量与乳腺癌切除术后早期康复:一项随机双盲试验
206.吸入麻醉与全凭静脉麻醉对消化道肿瘤手术患者预后的影响
205.术后阿片类药物的持续使用
204.非心脏手术术后低血压与心肌损伤的关系
203.人类肿瘤图谱网络:以单细胞分辨率描绘肿瘤的跨时空转变
202.区域麻醉和急性疼痛管理的进展
201.ERAS下术后疼痛及阿片类药物管理
200.肿瘤中免疫细胞的代谢
199.通过饮食调控增强肿瘤治疗效果
198.肿瘤微环境中的代谢交流
197.线粒体代谢:肿瘤治疗靶点
196.围术期干预可改善肿瘤患者的远期生存
195.肿瘤手术中红细胞输注的替代手段
194.代谢重塑与肿瘤进展
193.肿瘤与免疫中的氮代谢
192.老年微环境如何影响肿瘤发展?
191.新兴的治疗靶点:中性粒细胞
190.抗氧化剂与活性氧在肿瘤中的复杂相互作用.
189.局部麻醉药对肿瘤细胞的作用
188.肥胖与CD8+T细胞代谢:在抗肿瘤免疫治疗中的应用
187.免疫检查点抑制剂:麻醉医生需要注意的问题
186.自噬与肿瘤干细胞代谢调控的交互作用
185.丙泊酚全凭静脉麻醉对围术期转归的影响
184.综合应激反应:从机制到疾病
183.肿瘤进展和转移扩散中的免疫串扰
182.恶病质在肿瘤转移中的作用
181.Warburg效应:代谢-肿瘤-间质分数(MeTS)能指导肿瘤免疫治疗吗?
180.模拟禁食与维生素C抗KRAS基因突变肿瘤的协同作用
179.靶向mTOR与肿瘤代谢:经验与创新
178.适者生存:骨髓源性抑制细胞如何在恶劣的肿瘤微环境中生存
177.巨噬细胞免疫代谢中Krebs循环的重生
176.抑制外泌体PD-L1可诱导全身抗肿瘤免疫和记忆功能
175.腺苷代谢:肿瘤治疗的新兴概念
174.靶向调控糖代谢增强免疫治疗:间歇性禁食和热量限制的循证依据
173.肿瘤的“免疫评分”
172.硫化氢调节髓源性抑制细胞功能而发挥抗肿瘤作用
171.肿瘤病因学:一种源于生命主要进化转变的代谢性疾病?
170.靶向肿瘤转移:将肿瘤细胞转变为脂肪
169.生长因子信号通路中的癌基因扩增使肿瘤依赖于膜脂重塑
168.组织免疫细胞的代谢适应
167.限制蛋白饮食重编码肿瘤相关巨噬细胞并增强免疫治疗
166.T细胞共刺激的代谢效应在抗肿瘤免疫中的作用
165.ERAS与结直肠肿瘤术后并发症
164.通过竞争抑制肿瘤
163.巨噬细胞与肿瘤微环境中的代谢
162.乳腺肿瘤微环境中的代谢紊乱
161曲马多可改善乳腺肿瘤患者手术预后
160.持续使用阿片类药物与I期非小细胞肺癌患者肺叶切除术后存活率降低相关
159.术前应用β-受体阻滞剂普萘洛尔可降低乳腺肿瘤转移风险:一项II期临床随机对照试验
158.手术应激与肿瘤进展
157.隔日禁食:一种安全的热量限制替代方案
156.补充GM-CSF和阻断PD-L1可减少膀胱癌术后局部复发
155.靶向代谢调节免疫反应治疗自身免疫性疾病和肿瘤
关注舒医汇视频号
关注麻醉及围术期领域新动态
 声明:古麻今醉公众号为舒医汇旗下,古麻今醉公众号所发表内容之知识产权为舒医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。
声明:古麻今醉公众号为舒医汇旗下,古麻今醉公众号所发表内容之知识产权为舒医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
Cancer Discovery: T细胞代谢与免疫疗法的复杂融合
【论肿道麻】Sirtuins: T细胞代谢和功能的重要调节因子
Nature Metabolism综述:T细胞耗竭的代谢和表观遗传学调控
疫苗增强CAR-T细胞疗法,或根除某些实体瘤
Cell:揭秘肥胖与癌症的“坏勾当”!多余脂肪竟帮癌细胞“抑制”免疫细胞,加速肿瘤生长
【论肿道麻】饮食和运动在肿瘤代谢中的作用
NK细胞疗法=“肿瘤克星”?NK细胞疗法发展现况大解析
靶向代谢治疗,推动免疫治疗革命
【论肿道麻】肿瘤脂肪酸代谢在治疗抵抗和肥胖中的作用
举家团聚,也别忘了提升免疫力,干细胞和免疫细胞谁更强?
网址: 体内稳态和肿瘤免疫中的T细胞代谢 https://www.trfsz.com/newsview373277.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3880
- 2早上怎么喝水最健康? 3664
- 3习惯造就健康 影响健康的习惯 3311
- 4五大原因危害女性健康 如何保 3219
- 5连花清瘟、布洛芬等多款感冒药 2975
- 6男子喝水喉咙里像放了刀子一样 2469
- 710人混检核酸几天出结果?1 2233
- 8第二轮新冠疫情要来了?疾控中 2232
- 9转阴多久没有传染性?满足四个 2167
- 10补肾吃什么 补肾最佳食物推荐 2166






