N糖的生物合成,从内质网到高尔基体
N-糖基化(N-linked glycosylation)是一种重要的蛋白质修饰。影响一些如蛋白质的折叠、半衰期、转运等基本的细胞过程和免疫原性,以及其在细胞间以及细胞外基质成分或病原体之间的相互作用。在真核细胞中,N-Glycan是在两个专门的细胞器,即内质网(ER)和高尔基体中合成的。这两个细胞器共里有几十种功能不同的糖基转移酶和糖苷酶,它们依次对不断增长的寡糖进行修饰。然而,考虑到相关的酶促反应没有任何模板并且相互竞争相同的底物,这种酶促反应的顺序如何安排以保证N-Glycan的正常合成就不是非常清楚了。本文将简单的梳理一下N-Glycan从内质网到高尔基体的合成过程以及相关问题。
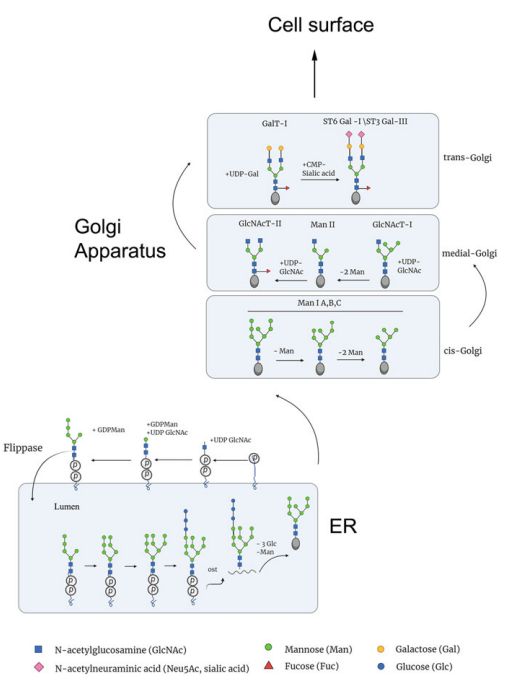
图1:N-糖基化在内质网与高尔基体中的合成过程图示
N-Glycan 在内质网的生物合成过程
N-Glycan的合成基石
N-Glycan在内质网的早期合成中都是保守的,其异质性是出现在其后续的加工过程中。所有的N-Glycan都有一个共同的核心结构(asn-GlcNAc2Man3-),通过在核心结构上添加一些其他末端的糖残基进一步延长。根据所使用的糖残基和连接类型,这些添加物可以显著影响N-Glycan的结构。作为添加物使用的主要是N-乙酰葡糖胺(GlcNAc)、甘露糖(Mannose)、半乳糖(Galactose)、岩藻糖(Fucose)和唾液酸(N-乙酰神经氨酸(Neu5Ac))。在某些情况下,N-乙酰半乳糖胺(GalNAc)残基可以用来构建N-Glycan。葡萄糖(Glucose)残基在内质网的合成过程中也被暂时纳入生长中的N-Glycan中,但是葡萄糖会在N-Glycan后续的合成过程中被移除。
前体合成
内质网腔存在一系列Alg(Asparagine-linked glycosyltransferase)家族的糖基化转移酶,该系列的酶负责协调将脂质连接的寡糖(lipid-linked oligosaccharide,LLO)前体(Glc3Man9-GlcNAc2)装配到膜包埋的磷酸多萜醇(Dol-P)载体上。它们利用核苷酸糖(UDP-GlcNAc、GDP-Man、Dol-P-Man和Dol-P-Glc)作为供体底物,逐步组装LLO。LLO的组装开始于内质网膜的细胞质面,第一个GlcNAc是由糖基化转移酶Alg7p添加的,它使用核苷酸糖UDP-GlcNAc在磷酸多萜醇(Dol-P)载体上生成GlcNAc-PP-dol,随后,Alg13p/Alg14p转移酶使用UDP-GlcNAc中加入第二个GlcNAc,产生成GlcNAc2-PP-dol。接下来,内质网甘露糖转移酶(Alg1、Alg2和Alg11)也相互形成复合物,从核苷酸糖GDP-Man供体中加入五个甘露糖残基,形成Man5GlcNAc2-PP-Dol中间物。因此,在内质网膜的细胞质面上的LLO前体合成涉及三个主要的酶复合物,一个是由Alg7/Alg13/Alg14形成,另外两个由Alg1/Alg2和Alg1/Alg11形成。这种安排可能确保每个甘露糖残基将正确地与前体连接。
随后将Man5GlcNAc2-PP-Dol中间物转运到内质网腔内,这一过程被目前认为是由一种被称为Rft1的蛋白介导的。在内质网腔内,甘露糖基转移酶(Alg3/Alg9/Alg12)和葡萄糖基转移酶(Alg6/Alg8/Alg10)分别通过附加四个甘露糖残基和三个葡萄糖残基来进一步拉长LLO前体。这就完成了前体的合成,产生了Glc3Man9GlcNAc2-PP-Dol结构,该结构以后将被用作供体底物,用于将一个N-glycan整体转移到一个合适的多肽链。值得注意的是,与内质网细胞质面的初始催化步骤不同,在内质网腔内完成LLO前体的合成并不使用核苷酸糖作为供体。相反,在这种情况下,膜包埋的Dol-P-Man和Dol-P-Glc被用作糖供体。它们的合成也发生在内质网膜的细胞质面(分别来自GDP-Man和UDP-Glc),然后被转运到腔内侧。
最常见的糖基化位点序列为Asn-X-Ser/Thr(X不为脯氨酸),这两者中,Asn-X-Thr序列比Asn-X-Ser更受欢迎,主要是因为苏氨酸的侧链甲基与寡糖转移酶(Oligosaccharyltransferase complex,OST)结合域中的天冬酰胺-赖氨酸结构之间的相互作用增加了复合物的稳定性。氨基酸X和侧翼氨基酸的性质也有助于特定序列的糖基化。此外,序列在多肽中的位置、蛋白质的二级和三级结构等都会影响糖基化出现的可能性。因此,单凭序列的存在不能作为N-糖基化的充分预测因素。事实上,在分泌的糖蛋白中,大约有三分之一的已确定的序列仍然是非糖基化的。
葡萄糖残基的移除与蛋白质折叠的质量控制
一旦多肽被转运到内质网腔内并开始折叠,新连接的Glc3Man9GlcNAc2结构将被进一步修改。第一步是由一个跨膜酶α-葡萄糖苷酶I去除末端的葡萄糖残基,然后由可溶性的α-葡萄糖苷酶 II快速去除第二个葡萄糖残基,所得到的单葡萄糖化的寡糖是伴侣蛋白钙连蛋白calnexin和钙网蛋白calreticulin的配体,这些伴侣蛋白也很容易与一种二硫键异构酶ERp57结合,ERp57催化链间和链内二硫键的形成,从而帮助新生糖蛋白的正确折叠。随后最后一个葡萄糖残基会在蛋白折叠过程中被α-葡萄糖苷酶II除去。暴露出疏水区块的未折叠或者错误折叠的蛋白会被UGGT(UDP-glucose-glycoprotein glucosyl-transferase)所识别,此种酶可以再一次将蛋白的甘露糖残基重新添加上葡萄糖从而重新创建一个Glc1Man9GlcNAc2的寡糖结构,该结构再次被伴侣蛋白-二硫键异构酶复合物所作用,进而重新进行蛋白折叠。这种去除和重新添加葡萄糖残基的过程可以持续几个周期,直到蛋白质被正确折叠。
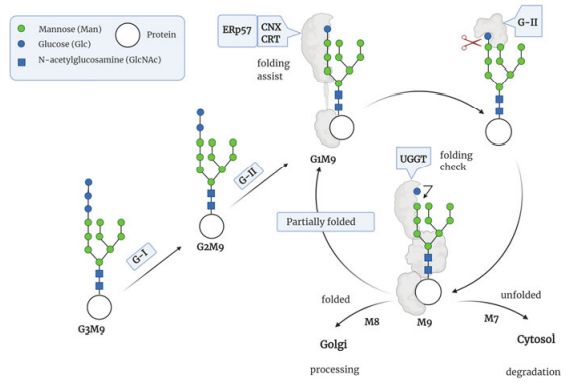
随后甘露糖被内质网甘露糖苷酶I(ERMan1)修剪,从N-连接寡糖的中间分支上去除末端的甘露糖残基。然后生成的Man8GlcNAc2结构可以被LMAN1(Lectin mannose-binding 1)识别,这种甘露糖特异性凝集素可以将糖基化蛋白打包利索装进包被蛋白复合物II(Coat Protein complex II,COPII)从而通过内质网—高尔基体中间体(ERGIC)运送到高尔基体。
内质网中各种条件的变化,比如钙平衡的改变、氧化还原状态和葡萄糖剥夺或突变会导致错误折叠或者未组装的蛋白在内质网中积累并对细胞活力造成损害。细胞本身可以通过启动内质网应激抑制翻译速率并增加伴侣蛋白的表达等来减少损害。如果这些措施还是失败的话,错误折叠的蛋白会被引导通过内质网相关蛋白降解(ER-associated degradation,ERAD)的途径进行清除。此过程开始于内质网甘露糖苷酶I(ERMan1)和 EDEM (内质网 降解增强子 α-甘露糖苷酶样蛋白) 被招募来从一个N-Glycan上裂解出两个甘露糖残基,因此聚糖变得无法被LMAN1识别,从而阻止糖蛋白的后续转运。所生产的Man7GlcNAc2结构中暴露的α(1,6)连接的甘露糖被一个OS-9/XTP3-B凝集素复合物识别,随后通过泛素化将其标记为蛋白酶体降解。
N-Glycan在高尔基体中处理
N-Glycan在高尔基中的进一步处理
进入顺面膜囊的正确折叠的糖蛋白通常携带有8个甘露糖残基的N-Glycan(Man8GlcNAc2)。虽然有些N-Glycan可能未经修饰就离开高尔基体,但它们在人类中的比例通常很低。部分原因是高尔基体中存在一种质量控制机制。高尔基体膜上有一种甘露糖结合凝集素VIP36(Vesicular integral-membrane protein 36),它可以将高甘露糖类型的N-聚糖回收到内质网,VIP36还与位于内质网的伴侣蛋白相互作用,所以,VIP36可以阻止不适当的糖基化糖蛋白分泌到后高尔基体。另一个防止高甘露糖型N-糖蛋白通过高尔基体的机制是在携带单葡萄糖(Glc1Man9GlcNAc2)的糖蛋白到达高尔基体时。糖的部分被高尔基体内切α-甘露糖苷酶在Glcα1-3Manα1-2-Manα1-2支链的两个Man残基之间进行内部裂解,从而产生Man8GlcNAc2异构体,与内质网甘露糖苷酶I在内质网产生的异构体不同。
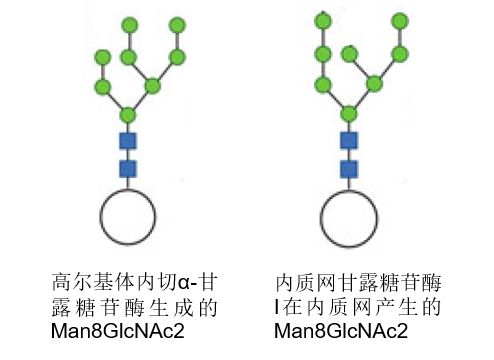
正常情况下,绝大多数N-糖在高尔基体中被一组不同的糖苷酶和一系列糖基转移酶(Mannosyl-glycoprotein-N-acetylglucosaminyltransferase1-5,MGAT1-5)加工成复杂和/或混合型N-糖。处理过程涉及MGAT同聚体和异聚体之间复杂的相互作用,甘露糖苷酶II(ManII)充当中心枢纽。因此,在到达高尔基体后,内质网衍生的MGAT同聚体不仅与其他MGATs,而且与相关的UDP-N-乙酰葡萄糖胺转运体形成异聚体复合物。因此,它们在高尔基体膜上组织成多酶/多转运体集合体。它们的相互作用可能涉及不同的或动态的复合体,以促进顺面膜囊和中间膜囊中N-Glycan的有效处理和分岔。
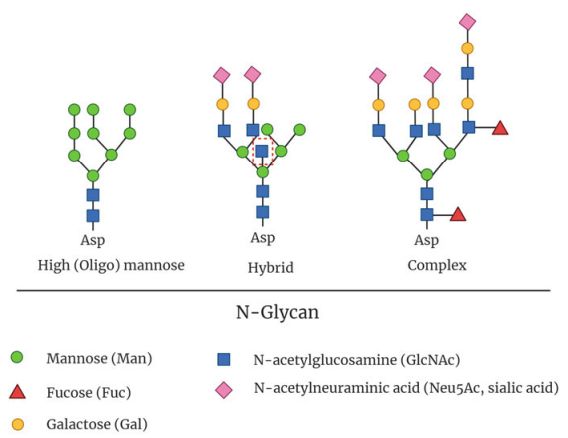
图3:真核生物的细胞表面存在的主要N-Glycan类型。高甘露糖型N-聚糖的特点是在高尔基体中没有经过任何加工。混合型N糖通常只有一个分支在高尔基体中被处理过。复合型N-聚糖则有两到五个分支,在中间膜囊和反面膜囊中形成和终止。
加工开始于顺面膜囊,高尔基体甘露糖苷酶IA-C负责去除三个甘露糖残基,产生Man5GlcNAc2结构。然后, MGAT1使用核苷酸激活的N-乙酰葡糖胺作为供体底物添加第一个GlcNAc。一旦这个GlcNAc被添加,另外两个甘露糖残基被高尔基α-甘露糖苷酶II去除。这为MGAT2创造了一个支架,使其在暴露的甘露糖残基上添加第二个GlcNAc,产生了所有复合型N-聚糖的前体。然后MGAT4和MGAT5可以分别启动第三和第四个GlcNAc分支的合成。另外,MGAT3可以在三甘露糖基核心结构上增加一个GlcNAc(图3中间)。如果在MGAT4和MGAT5添加它们的GlcNAc之前添加这个GlcNAc,MGAT4和MGAT5的第三和第四GlcNAc分支的合成就会停止。这个GlcNAc也不能与任何其他糖残基进一步拉长。它的加入也大大改变了N-Glycan的构象,并抑制了末端糖残基的加入,如唾液酸和岩藻糖。此类GlcNAc的出现也可以抑制α-甘露糖苷酶II。然而,并非所有的hybrid型N-Glycan都包含在三甘露糖核心上一分为二的GlcNAc。因此,第一条GlcNAc快速伸长分支的延伸也可能抑制α-甘露糖苷酶对两个末端甘露糖的必要清除,从而抑制其他GlcNAc分支的建立。
通常情况下, GlcNAc分支通过添加半乳糖、N乙酰葡萄糖胺和唾液酸进一步拉长 。半乳糖几乎总是以β(1,4)-连接的方式被添加到GlcNAc中。这种结构被称为N乙酰半乳糖胺 (LacNAc) ,可以在一个分支中重复数次,形成多LacNAc结构。聚LacNAc结构又可以作为底物,使更多的分支成为触角。这是由一组被称为GCNT2s A-C的特殊酶完成的,通过向内部半乳糖残基添加额外的带有β(1,6)-连接的GlcNAc残基。这些GlcNAc残基也可以随后被β(1,4)-半乳糖基转移酶拉长,形成额外的LacNAc结构。这种支化的N-聚糖被称为I-支化聚糖。它们最常出现在成人红细胞、粘膜上皮、眼睛和嗅球的细胞中。 N-Glycan支链末端经常被各种唾液酸转移酶盖住,除了聚唾液酸化外阻止了分支的进一步延伸。聚唾液酸化N-聚糖通常在神经系统的神经细胞粘附分子 (NCAMs) 中检测到。岩藻糖是另一个不能进一步拉长的残基。它可以被特定的高尔基体岩藻糖转移酶添加到天冬酰胺连接的GlcNAc上,以产生 "核心岩藻糖 "的N-Glycan,或者添加到分叉的GlcNAc残基上。
IgG的N-Glycan
N-糖基化是所有免疫球蛋白的一个重要翻译后修饰,有助于影响其结合特性和效应功能。虽然它们的合成可能与其他N-Glycan没有任何区别,但有一些特殊的问题值得讨论。IgG的N-Glycan通常存在于Fc区,但有一小部分(15-25%)的血清IgG在其可变区中可能含有N-Glycan。这些所谓的 "Fab糖"与Fc区的N-Glycan不同,具有较高比例的末端半乳糖化和唾液酸化以及在三甘露糖核心上将天线一分为二的一个GlcNAc,同时保有核心岩藻糖的比例较低。然而,尚不清楚为什么IgG N-聚糖中的触角数量似乎只限于两个触角(或者如果将双等分甘露糖天线的GlcNAc也视为分支,则为三个)。一种可能的解释是,产生抗体的浆细胞不表达进一步分支所需的MGAT4或MGAT5酶。另一种解释是,添加双等分甘露糖的GlcNAc(或其他一些调节系统)将阻止IgG N-Glycan的进一步分岔。这种系统的存在是合乎逻辑的,因为额外的分支带来的N-Glycan "体积 "的增加可能会干扰内质网中Fc区域的折叠和配对,从而改变已知对其与Fc受体结合和抗体效应功能很重要的构象。同样,目前还不清楚为什么Fab N-Glycan比Fc N-Glycan显示出更高比例的更成熟(更完全加工)的N-Glycan。这种差异是否是由于Fab糖比Fc糖更容易获得,还是其他原因,如细胞外糖基化的增加或糖苷酶的降解减少,还有待探讨。
总结
N-糖基化是蛋白质的一种频繁而复杂的修饰,对单细胞和多细胞生命都是必不可少的。它调节着大量的细胞功能,从蛋白质的折叠、贩运、分类、定位、半衰期和信号传递到增殖、迁移和与周围环境的粘附。对于治疗性抗体来说,不同的糖基化修饰对于抗体功能的影响也是巨大的,例如敲除核心岩藻糖可以极大的提高ADCC活性,高半乳糖则会提高抗体与FcγR的结合能力,详细内容我们会后续专门梳理。
参考文献:Antibody Glycosylation(doi:10.1007/978-3-030-76912-3)
Hetero-oligomeric interactions between early glycosyltransferases of the dolichol cycle(doi:10.1093/glycob/cwp001)
作者:制药农民工
推文用于传递知识,如因版权等有疑问,请于本文刊发30日内联系医药速览。
原创内容未经授权,禁止转载至其他平台。
©2021 医药速览 保留所有权利
来源:医药速览 2022-08-26
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
基于物联网的远程健康管理系统的设计
怎样提高基础代谢率变成易瘦体质
Antioxidants:高剂量的维生素C营养补充剂不能减轻代谢综合征患者的炎症,但可以改善代谢健康指数
基于中医体质理论的中医健康管理体系构建
对N
番石榴果实品质评价及黄酮类化合物合成相关基因挖掘
1+3+N,运动控糖站试点开始啦……
链式多Li掺杂分子H(HC==N—Li)
沼气做能源对室内空气质量及人体健康的影响
蛋白质——生命的物质基础
网址: N糖的生物合成,从内质网到高尔基体 https://www.trfsz.com/newsview439780.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3889
- 2早上怎么喝水最健康? 3671
- 3习惯造就健康 影响健康的习惯 3317
- 4五大原因危害女性健康 如何保 3226
- 5连花清瘟、布洛芬等多款感冒药 2978
- 6男子喝水喉咙里像放了刀子一样 2472
- 710人混检核酸几天出结果?1 2237
- 8第二轮新冠疫情要来了?疾控中 2232
- 9补肾吃什么 补肾最佳食物推荐 2204
- 10转阴多久没有传染性?满足四个 2171






