在国内医药行业进入“应采尽采”时候,有一个细分行业却可以稳坐钓鱼台。
如你所料,正是血制品行业。2021年,我国采血浆量约为9390吨,但实际的血浆需求量则超过20000吨。在残酷的供需关系面前,强如医保也无能为力。在地方的试点中,甚至出现了“涨价式集采”的奇观。
事实上,我国血液制品行业常年处于严重供不应求的状态,人血白蛋白60%以上的市场份额长期被进口产品占据。而血液制品的供给不足,不仅是我国的难题,也是一个全球性的难题。要想彻底解决这一难题,人造血液无疑是最有希望的答案。
人造血——生物医药行业的“圣杯”
早在 17 世纪,想制造合成血液的医生,曾经尝试将牛奶和葡萄酒注入大出血患者体内,失败之后,他们又尝试了羊血。但在血淋淋的事实面前,类似的尝试很快就停下来了。
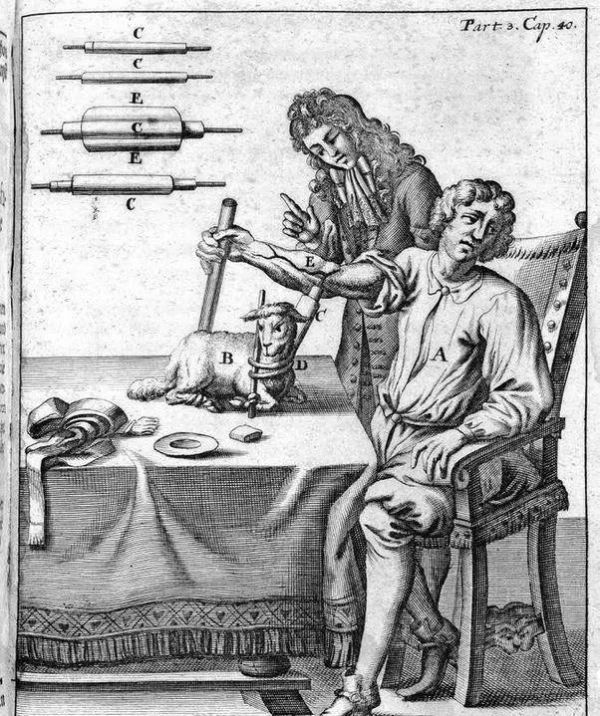
来源:科技前沿
1900年,奥地利医学家卡尔·兰德斯坦纳发现了ABO血型,从此输血救人才成为可能。到了20世纪中后期,由于献血和输血造成一些传染病,比如艾滋病、乙肝、丙肝等的传播和流行,也让人对输血用血产生恐惧。因此,研发安全可靠的人造血液开始成为新的临床需求。
1966年,第一代人造血液,氟化碳乳剂人工血液(PFC)在小鼠身上获得成功。1980年8月6日,中国人造血液的研究在上海获得成功。氟化碳乳剂人工血液是一类具有载氧能力,可暂时替代血液部分功能的液体制剂。主要用于外伤、医疗手术等所致大出血的治疗,但距离代替真正人血,仍有不小的距离。
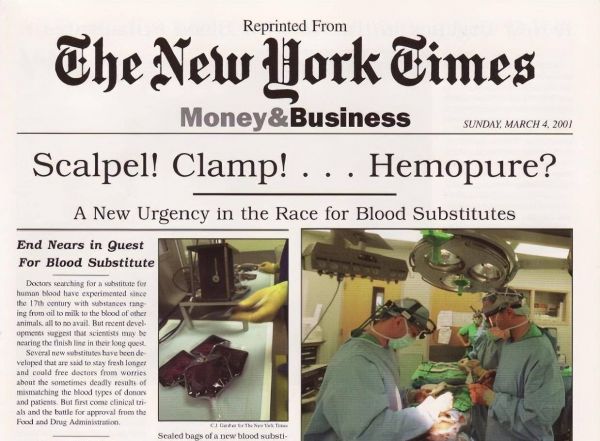
又一次世纪之交,2001年《纽约时报》就对“人造血液”进行过相关报道,美国Biopure公司开发了一种名为Hemopure的“人造血液”。Hemopure以牛源血红蛋白为基础,可以兼容各类血型,在室温下(2℃至30℃)能存放3年。但因为担心疯牛病传播(人造血中可能包含朊病毒),副作用发生率较高等原因,Hemopure最终只在南非获批。这个突破性的产品,最终“沦为”了哈佛商学院的一个案例。
在以Hemopure为代表的血红蛋白的载氧溶液(hboc)之后,科学家们将人造血的希望转向由干细胞生成的红细胞。2022年11 月,英国国民保健制度(NHS)血液与移植中心、布里斯托大学、剑桥大学等机构合作,开展了世界上首次人造红细胞的临床试验。研究团队从约 470 毫升健康人捐献的血液中分离出 50 万个干细胞,在此基础上培养出 500 亿个红细胞,最终筛选出约 150 亿个成长到适合输入人体的红细胞。
无数科学家为了人造血前赴后继,主要原因就是人造血液具备着巨大的临床价值。
首先,人造血液可以很好的解决我国‘血荒’的问题,也可以通过基因编辑培养出稀有血型,弥补血库的空缺;其次,这将极大地减少鲜血输血带来的传染病风险。第三,人造血液方便运输,储存,具备极强的战略价值。
这也是为什么人造血被称为生物医药行业的“圣杯”。
那如果一家初创公司的发展规划是生产人造血,又建设了160吨的产能,这是有可能的吗?
“当然有可能。”康码生物的创始人郭敏博士坚定地回答。“因为,我们是一家具备底层技术的合成生物学公司。”
敢于这么说的底气,来自于康码生物利用无细胞蛋白质合成体系,人工合成的血红蛋白。这种人工合成血红蛋白没有细胞膜,所以没有血型限制,是天然的“熊猫血”。同时因为没有细胞膜,这种血红蛋白氧气和二氧化碳传输的效率增加了85倍,输血效率大幅提升。而且可以在GMP车间内人工合成,无细胞、病毒或微生物、动植物源干扰,所以安全性也更高。

来源:澎湃新闻
而合成生物学,正是近年来最为火爆的新赛道。根据Synbiobeta数据,2021年全球合成生物学领域获得融资总额约180亿美元,相当于过去12年的总和[1]。但在合成生物学爆火的背后,投资人却有一个很大的疑问,“这个合成生物学和传统的微生物发酵,有什么区别?”
如果没什么区别的话,那么A股的贵州茅台,毫无疑问是全球合成生物学的龙头企业。
无细胞合成系统
传统的微生物发酵,核心工艺是菌种筛选,让细菌代代相传,在子子孙孙中间优中选优。
而合成生物学则是将基因组学,信息学,工程学的融合学科。直接利用人类对于DNA的理解,直接用基因编辑技术,给细菌来个“醍醐灌顶”,让细菌成为“细胞工厂”,按照人类给的工艺流程生产各种蛋白质。
比如治疗疟疾的青蒿素,之前是从黄花蒿中萃取制备的,成本较高。而合成生物学直接将黄花蒿合成青蒿素的DNA片段导入了酵母菌中,于是这些酵母菌就成为了“青蒿素工厂”的底盘细胞。
这样的“细胞工厂”相较于化学合成方式而言,占地小、能耗低、产量大。一旦技术成熟,它可以颠覆化工、能源、材料、医药等多个行业。但如何找到这样的底盘细胞,又如何加速细胞生产效率,是卡住合成生物学从实验室走向商业化的瓶颈[1]。
针对合成生物学的商业化难题,康码生物给出的答案是无细胞蛋白质合成系统(cell-free protein synthesis,CFPS)。
无细胞蛋白质合成(cell-free protein synthesis,CFPS)系统是一种快速而且能高通量表达目标蛋白质的技术,是以外源DNA或mRNA为模板,在细胞裂解液提供多种酶的作用下通过补充底物和能量物质来实现蛋白质的体外合成。
简单来说,就是打破了传统的“细胞工厂”模式,将细胞内进行的生产过程搬到了细胞外,从单个细胞各自为战的小作坊,变成了集团化生产的大厂。突破了细胞的生理限制,让细胞底物专注于合成目标蛋白质,将生产效率大幅提高。这一突破,可以算是蛋白质合成领域的“工业革命”。
大家一定非常好奇,既然细胞内合成已经非常成熟,为什么还要多此一举的开发无细胞体系呢?这主要是因为细胞内合成蛋白质的步骤十分繁琐和低效,规模也不易放大,而且有些蛋白质(如血红蛋白、细胞毒性蛋白、复杂蛋白)在细胞内难以表达,所以科学家们就开发了CFPS系统,能够在短时间内实现蛋白质的高通量表达[2]。
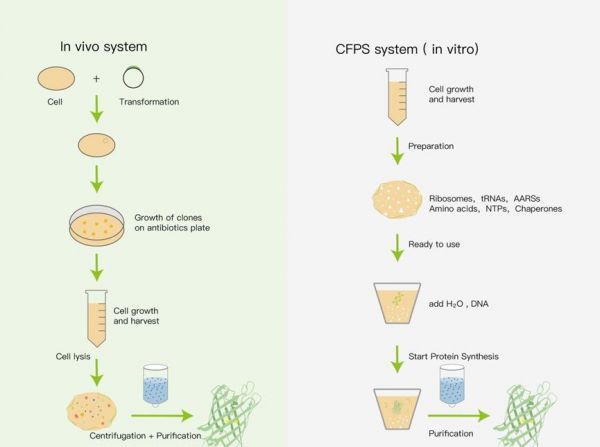
体内细胞和体外无细胞蛋白质合成比较
在体内细胞系统,目的质粒导入细胞,通过培养、裂解和离心纯化获得目的蛋白。
在CFPS系统中,通过从细胞中预先提取出具有合成活性的提取物,再在其中添加DNA模板,在体外直接合成纯化后获得目的蛋白
无细胞蛋白质合成,正是在体外实现生物学的中心法则并在体外重构胞内生命过程,由于它的简单性、开放性、便携性和易放大性,给生物合成工程化提供了极大的自由度,让“合成万物”成为可能。
康码生物自主研发的D2P(DNA到Protein)技术,可以实现定制蛋白质序列,在体外直接走完中心法则——DNA转录成RNA,RNA翻译成蛋白质。和传统的细胞培养方式相比,D2P技术可以实现“所见即所得”,将写好的“代码”(DNA模板)放到酵母细胞抽提物和水中,只需要3个小时,在常温下就能生产出目标蛋白质。
D2P技术具备速度快,通量高,成本低等特点。打破了传统的细胞培养与胞内表达蛋白质体系,将蛋白质合成从传统的以“菌株培养”为核心的农业时代,带入了“去菌株化”的酶促反应大工业时代。
商业化才是硬道理
对于一家具备底层核心技术的合成生物学企业来说,能够量产出具有“市场竞争力”的产品,才是硬道理。
2020年,康码生物完成了世界上第一条5吨级蛋白质工厂自动化产线。2023年4月,康码生物160吨级D2P蛋白质生产基地建成达产,目前仍是全球唯一一家实现吨级以上量产的无细胞体外合成蛋白质企业。
而这一切都起源于8年前。2015年,随着基因剪辑技术的突破,郭敏博士在其近20年的蛋白质合成理论研究的基础上,开始萌生出将无细胞蛋白合成技术商业化的想法。“无细胞蛋白质合成在实验室和理论层面的高效率、应用潜力毋庸置疑,但如何大规模量产,降低制造成本,提高稳定性,实现真正的工业化制造,满足生物医药的高端制造标准,使其真正服务于人类才是关键[3]。”
同年10月,他辞去在美国Scripps研究所的副教授、博导等职位,回国创业,成立了康码生物。
经过8年的不懈努力,康码生物在无细胞体外合成蛋白质领域拥有全球数量最多的专利,已授权和在申请的国内外专利400余项。
除了不断打磨底层技术之外,康码生物也在基于无细胞合成技术,不断开发具备商业化价值的产品。疫情期间,康码生物利用D2P技术已经成功合成出新冠病毒阻断剂——康斯汀蛋白“Kansetin”。康斯汀蛋白可有效阻断新冠病毒的多种突变株,是已知的具有最强抑制力的广谱抗新冠病毒变种的蛋白质分子。
“新冠病毒在感染人体的过程中,首先是刺突糖蛋白(S蛋白)与宿主血管紧张素转化酶2(ACE2)受体结合,康斯汀蛋白可模拟ACE2受体高效结合S蛋白,进而预防新冠的感染。”郭敏介绍[4]。
2022年3月,康码生物实现了基于康斯汀蛋白的“Lencoron ®栏冠”新冠病毒防护系列产品的产业化,日产能达8吨,是世界上第一款基于无细胞蛋白质合成技术大规模生产并销售的产品。
但在郭敏博士心中,人造血才是康码生物的“白月光”。
血液是一种极为特殊的液体器官,其中的物质特别丰富,包括白细胞、红细胞、血小板,以及大量的电解质、蛋白质等,其中血红细胞约占人体血浆体积的45%, 是血液中最主要的活性成份。由于人类全血成分非常复杂,人造全血几乎是不可能的。但用于抢救的输血只是利用红细胞中血红蛋白的携氧功能。所谓的人造血,一般就是指“人造红细胞”。
但由于血红蛋白结合的氧气会杀伤细胞内部的细胞器,导致红细胞自身不能复制和繁殖,在人体内只能通过干细胞分化。而血红蛋白的大量合成只能通过无细胞的方式体外合成。康码生物的人造血红蛋白具有自我保护功能,有效防止氧自由基的氧化作用,同时消除了细胞膜的屏障,氧气交换效率远高于红细胞,可以极低剂量满足患者输血需求,且不受血型限制,无免疫原性,市场需求量巨大。
2022年10月,国家药监局在答复政协委员《关于进一步支持我国平战结合战略性人造血开发的提案》时表示,开发安全有效的血液替代品对于血液短缺情况下的紧急治疗有重要意义,如在申报时经评估符合规范要求,可适用相应加快通道。
目前,康码生物的人造血红蛋白已经完成了分子定型,即将进入临床前研究阶段。而这种全新的“人造血”如果能够研发成功,将广泛应用于急救、外科手术、ICU、战时等场景,具备极高的临床价值。
AI+无细胞合成
近年来,AI对蛋白质结构预测与功能设计领域正产生颠覆性的影响。从AlpahFold2到Progen(蛋白质工程的GPT),科研人员写出蛋白质底层代码(DNA序列)的速度已经发生了质变。
利用蛋白质大模型,科研人员可以用几天时间,完成过去数月的工作量。但无论AI多么强大,蛋白质依然需要合成验证的过程。而在这个过程当中,无细胞合成技术有着独到的优势。
康码生物在无细胞合成系统上的8年积累,结合AI技术的不断突破,蛋白质工程行业已经处在了“大变革时代”的前夜。
无细胞蛋白质合成技术作为合成生物学重要平台之一,具备合成步骤清晰可控,容易放大生产的特点,能够显著地降本增效。更值得关注的是,无细胞合成系统相比细胞生产,能实现更好的分离纯化,且更好预防可能的毒素残留。
基于独有的蛋白质智能算法设计平台与无细胞体外合成蛋白质技术平台,康码生物已经开发出一系列具有生物活性的新型蛋白质产品,涵盖生物医药、创新医疗器械、化妆品与医美、食品、动物与植物营养等多个领域。但公司的核心理念依然是不断提升人类生命质量与生存环境。
尾声
现代生命科学到现在已经经历了三次革命,从70年前DNA双螺旋结构的发现和中心法则的提出,到人类基因组计划的实施,再到现在合成生物学的崛起。合成生物学突破了传统生物学以发现描述与定性分析为主的所谓“格物致知”的传统研究范式,为生命科学提供了“造物致知”和“造物致用”的崭新研究思想。
合成生物学汇聚了“发现”、“建造”、“发明”和“创新”四个重要特性,被认为是理解生命的新钥匙、是能改变世界的颠覆性技术。而康码生物开发的无细胞体外合成蛋白质技术平台,正是未来合成生物学发展的核心技术和底层技术,特别是生物医药等高端制造产业的“光刻机”。
 返回搜狐,查看更多
返回搜狐,查看更多
责任编辑:






