麻醉指南与专家共识学习 day15冠心病患者非心脏手术麻醉及围术期管理的专家共识
冠心病患者非心脏手术麻醉及围术期管理的专家共识
马骏 王伟鹏(执笔人) 王晟 包睿 艾艳秋 张铁铮 夏中元 晏馥霞 徐军美(负责人)徐美英 缪长虹
随着外科手术技术的发展,临床上冠心病患者非心脏手术的适应证愈来愈广,手术种类以腹部、泌尿、骨科手术居多,而急症、失血多、高龄伴多系统疾病患者的麻醉风险更高,使围术期心血管事件的风险增加,如心肌梗死、心力衰竭和死亡。据《中国心血管病报告2016》报道,我国心血管病患者发病率和死亡率仍处于上升阶段,其中冠心病患者约有1100万人。冠心病患者需要行非心脏手术的也在逐年增加,近期患有心肌梗死或不稳定型心绞痛的患者如果需要行紧急或急诊手术,风险则更高。认识并理解围术期心血管风险因素,在麻醉前进行全面评估,对降低患者施行非心脏手术的并发症的发生和病死率具有重要意义。
本文将阐述择期、紧急或急诊非心脏手术的缺血性心脏病患者的麻醉前评估、麻醉治疗和术后即刻管理。
一、术前评估
(一)心血管事件风险评估
1.总则 所有接受择期非心脏手术的缺血性心脏病患者,应进行围术期心血管事件风险评估。该风险与外科手术类型(表1)和患者体能状态(图1)有关。在现有证据和专家意见基础上,参照美国及欧洲冠心病患者围术期心脏评估及处理流程(图2,表2),其基本原理概述在本共识中。该流程从临床医师的角度关心患者,提供知情同意,并帮助指导围术期管理,以尽量降低风险。这种相互合作的“围术期团队”是围术期评估的基石,它依赖于外科医师、麻醉科医师及主要照顾者等相关参与者的密切沟通。
表1. 美国心脏病学会/美国心脏协会(ACC / AHA)指南摘要:非心脏手术的心脏风险分级
高风险[主要心血管不良事件 (Major Adverse Cardiovascular Events,MACE )通常大于5%]
l 主动脉及主要大血管手术
l 外周血管手术
中度风险[(主要心血管不良事件 (MACE )一般为1%〜5%]
l 颈动脉内膜剥离术
l 头颈外科手术
l 腹腔内和胸腔内手术
l 矫形外科
l 前列腺手术
低风险*[(主要心血管不良事件 (MACE )一般小于1%]
l 门诊手术¶
l 内镜手术
l 浅表手术
l 白内障手术
l 乳腺手术
主要心血管不良事件 (major adverse cardiovascular events,MACE )(主要包括三个终点事件:心血管死亡、心肌梗死和卒中。*术前一般不需要进一步的心脏检测。¶门诊手术是指在手术当天入院并在同一天返回家的手术。
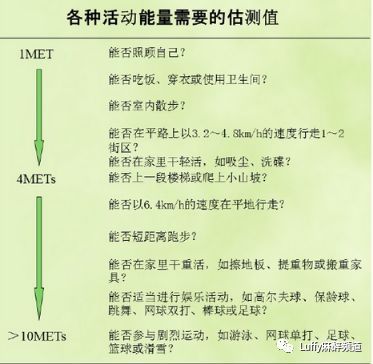
图1 欧洲心脏病学会(ESC)与欧洲麻醉学会(ESA)指南摘要:患者体能状态(functional capacity,FC)评估
ESC/ESA新指南明确提出评估患者FC是围术期心血管事件风险评估的重要一步,常借助代谢当量(metabolic equivalent,METs)进行FC的评估。
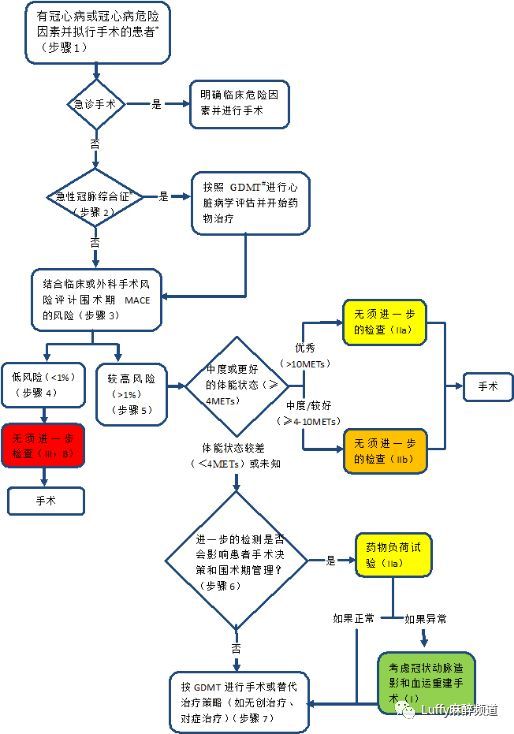
图2冠心病患者围术期心脏评估及处理流程(颜色对应于表2中的推荐等级)
步骤1:对于有冠心病或冠心病危险因素并拟行手术的患者,首先评估手术的紧急性。如果情况紧急,需先明确有可能影响围术期管理的临床危险因素,然后在合理的监测和治疗下进行手术。
步骤2:如果手术较紧急或为择期手术,首先需明确患者是否有急性冠脉综合征;如果有,则根据不稳定型心绞痛/非ST段抬高型心肌梗死和ST段抬高型心肌梗死的临床实践指南进行指南导向的药物治疗(guideline-directed medical therapy,GDMT)。
步骤3:如果患者有冠心病的危险因素,但病情稳定,则需结合非心脏手术的心脏风险分级评估围术期主要心血管不良事件 (MACE )(见表1)。比如,对于低风险的手术(眼科手术),即使合并多种危险因素,患者的MACE风险仍然较低;而对行大血管手术的患者,即使合并较少的危险因素也可能使MACE的风险升高。
步骤4:如果患者出现MACE 的风险较低(<1%)(见表1),无需进一步检测,患者可以开始手术。
步骤5:如果患者出现MACE 的风险较高(见表1),则需要评估患者体能状态(FC)(见图1),如果患者具有中度、较好或优秀的FC(≥4METs),无需进一步评估即可进行手术。
步骤6:如果患者FC较差(<4METs=或未知,临床医师应咨询患者和围术期团队,以明确进一步的检测是否会影响患者手术决策和围术期管理[如选择原来的手术或术前需要接受冠脉搭桥手术(coronary artery bypass graft,CAGB )或经皮冠脉介入手术(percutaneous coronary intervention,PCI )的治疗]。如果有影响,可行药物负荷试验。对于FC未知的患者,也可行运动负荷试验。如果负荷试验结果异常,可根据结果的异常程度,考虑冠状动脉造影和血运重建手术;之后患者可在GDMT 下进行手术,也可考虑替代治疗,如无创治疗(如癌症的射频治疗)或对症治疗。如果负荷试验结果正常,可根据GDMT 进行手术。
步骤7:如果检测不影响患者手术决策和围术期管理,可按GDMT 进行手术或考虑替代治疗,如无创治疗(如癌症的射频治疗)或对症治疗。
表2 美国心脏病学会/美国心脏协会(ACC / AHA)指南摘要:推荐分级与证据水平
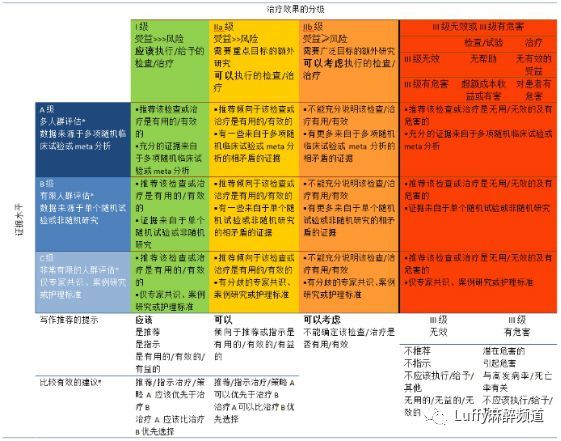
具有B或C级证据的建议并不意味着该建议权重较轻。指南中涉及的许多重要的临床问题并不适合开展临床试验。虽然随机试验不可行,但是可能存在一个非常明确的临床共识,认为某个特定的测试或治疗是有用的或有效的。
* 可从临床试验或登记处获得有关不同亚群的有用性/有效性的数据,如性别、年龄、糖尿病史、既往有心肌梗死史、心力衰竭史和先前服用阿司匹林史。
# 比较有效的建议(Ⅰ级和Ⅱ级;证据等级A和B),研究支持对治疗方法的直接比较。
2.高心脏风险 当患者处于围术期心血管事件的高风险状态(表1),建议请心脏病专家在术前和术后的医疗管理中紧急会诊。
3.紧急或急诊手术 无论冠状动脉疾病的严重程度如何,需要行紧急或急诊手术的缺血性心脏病患者与进行择期手术的患者相比,心血管不良事件的风险更高。
4.近期心肌梗死或不稳定型心绞痛 近期心肌梗死(MI)(过去四周)以及不稳定或严重心绞痛患者围术期心血管事件风险极高。如果手术不可避免(例如紧急或急诊手术),以预防、监测和治疗心肌缺血作为麻醉目标尤为重要(见后面的“麻醉目标”章节)。尽管尚无随机试验支持这项建议,ACC / AHA指南建议新发心肌梗死的患者需等待4到6周后行择期非心脏手术。对于某些不稳定或严重心绞痛的患者,心脏病专家推荐在非心脏手术之前完成冠脉血运重建(见图2)。
5.近期做过经皮冠状动脉介入治疗 有近期经皮冠状动脉支架植入治疗(PCI)史的患者如果在6周内进行非心脏手术,心血管不良事件风险增加(如心肌梗死、死亡、支架内血栓形成以及需要再次紧急血运重建手术)。这一风险主要与在手术诱发的高凝状态下过早停止双重抗血小板治疗有关(即阿司匹林加上P2Y12受体阻断剂,如氯吡格雷、普拉格雷或替卡格雷)。
(1)择期非心脏手术建议延迟至PCI术后至少6个月进行,最好一年,以便不间断双重抗血小板治疗(尤其是药物洗脱支架)。
(2)既往 PCI 患者行择期非心脏手术的时机
对球囊扩张及植入裸金属支架(BMS)的患者,择期非心脏手术应分别延迟 14 d和 30d;
对植入药物洗脱支架(DES)的患者,择期非心脏手术最好延迟至1年后。
对需要行非心脏手术的患者,临床医师需要共同决定及权衡停止或继续抗血小板治疗和手术的相对风险。如果药物涂层支架植入后手术延迟的风险大于预期缺血或支架内血栓形成的风险,择期非心脏手术可考虑延迟 180 d。
对于围术期需要停止双联抗血小板的患者,裸金属支架植入 30 d内、药物洗脱支架植入12个月之内不推荐行择期非心脏手术;对于围术期需要停止阿司匹林的患者,不推荐球囊扩张后14d内择期非心脏手术。
近期服用抗血小板药物的患者如需要非常紧急或急诊手术,如果在手术中或手术后发生大量出血,则可能需要输注血小板。但是,不建议基于预防目的而提前预定或输注血小板。
其他关于近期接受过PCI治疗的患者麻醉管理与稳定型缺血性心脏病患者的管理相似(见后面的“麻醉目标”)。
6.非心脏手术前冠脉血运重建
如果根据现有的临床实践指南有血运重建的适应证,非心脏手术前可行血运重建;如果仅为减少围术期心脏事件,不推荐非心脏手术前常规冠脉血运重建。
二、术前用药管理
1. β受体阻滞剂 术前已经服用β受体阻滞剂的缺血性心脏病患者应继续服用常规剂量,包括手术日晨和整个围术期,以尽量减少心动过速或局部缺血。不建议预防性使用β受体阻滞剂,除非心脏病专家会诊后认为有非常明显的指征。
2.他汀类药物 术前已服用他汀类药物的患者应在整个围术期内继续服用。需要他汀类治疗但未开始服用的患者,建议其术前开始他汀类药物治疗。
3.阿司匹林 对于大多数服用阿司匹林进行一级或二级心血管疾病预防的患者,剂量将维持到非心脏手术术前5d〜7d。在围术期大出血风险过去后重新开始治疗。
对特定类型的外科手术(如颈动脉、末梢血管或心脏手术)和PCI术后接受双重抗血小板治疗(阿司匹林+P2Y12 受体阻断剂,如氯吡格雷、普拉格雷、 替卡格雷)的患者,围术期阿司匹林治疗方案是不同的:
(1)颈动脉手术:来自美国神经病学学会(AAN)和美国胸科医师学会(ACCP)的指南共识推荐阿司匹林用于症状性和无症状的颈动脉内膜剥除术(CEA)患者。我们建议在CEA之前开始服用阿司匹林(81mg~325 mg),并在无禁忌证的情况下继续服用。虽然有其他药物可用,但阿司匹林是CEA后研究最多的抗血小板药物,颈动脉斑块去除后,阿司匹林通常被认为足以进行术后治疗。对阿司匹林过敏的患者,氯吡格雷可用作替代药物。
(2)外周血管手术: 对于其他部位动脉粥样硬化斑块(如下肢)的患者,任何使用抗血小板药物或添加其他抗血栓药物的决定,都需要基于双重抗血小板治疗或三重抗血栓治疗适应证的个体化决策。
(3)心脏手术:所有心血管疾病患者(CVD)均应终生接受阿司匹林预防缺血性心血管事件。因此,大多数CABG患者每天服用阿司匹林直至手术日。对于新诊断CVD(尚未服用阿司匹林)和需行CABG的患者,术前开始阿司匹林治疗应个体化,应权衡手术延迟时间、手术出血风险以及术前启动药物治疗的潜在风险。如果手术等待超过5d,多数情况会启用阿司匹林治疗。如果等待时间不到5d,开始使用阿司匹林的决定需要平衡过量出血的风险与潜在的益处。
(4)经皮冠状动脉介入治疗:
对于植入药物洗脱支架或裸金属支架后初始4周~6周但需要行紧急非心脏手术的患者,应继续双联抗血小板治疗,除非出血的相对风险超过预防支架内血栓形成的获益。
对于植入冠脉支架但必须停止P2Y12 受体阻断剂才可以手术的患者,在可能的情况下推荐继续使用阿司匹林,术后应尽快开始P2Y12 受体阻断剂治疗。
4.血管紧张素转换酶抑制剂和血管紧张素受体阻断剂 血管紧张素转换酶抑制剂(ACEI)和血管紧张素受体阻断剂(ARB)以往在围术期持续使用,尤其是合并心力衰竭的患者。ACEI与ARB可能引起围术期低血压,建议手术当天早晨暂停给药。如果患者血液动力学不稳定、血容量不足或肌酐急性升高,则需要暂停ACEI和ARB。
5.可乐定 长期服用可乐定的患者应继续服用,突然停药可能会诱发反弹性高血压。
6.其他心血管药物 围术期建议继续使用大多数其他长期服用的心血管药物,如钙通道阻滞剂、地高辛和利尿剂。
7.植入心脏电子设备患者的管理 对于围术期计划暂停心律治疗的植入型心律转复除颤器患者,暂停期间应持续心电监测,确保体外除颤装置随时可用,在停止心电监测和出院前,应保证植入型心律转复除颤器重新开始激活工作。
三、实验室检查
术前血液检测项目对于缺血性心脏病患者与其他非心脏病行非心脏手术的患者相同。长期使用利尿剂治疗的患者和肾功能不全患者,需要检测相应的代谢指标,包括钠、钾、氯、二氧化碳、葡萄糖、血尿素氮、肌酐。
1. 心电图
对已知的缺血性心脏病患者,尤其是心血管不良事件风险评级为中到高度的患者(表1),常规进行术前静息状态12导联心电图(ECG)检查。
2. 左室功能的评估
对于原因不明的呼吸困难患者,围术期应进行左室功能的评估;对于出现逐渐加重的呼吸困难或其它临床状态改变的心力衰竭患者,应进行围术期左室功能的评估。对于既往有左室功能障碍但临床情况稳定、1年内未进行过左室功能评估的患者,可考虑行左室功能评估;不推荐常规进行围术期左室功能评估。
3. 运动试验
对于心脏风险高危但患者体能状态极好(>10METs)的患者,无需进一步的运动试验和心脏影像学检查;对于心脏风险高危但患者体能状态未知的患者,如果评估结果会改变治疗方案,应进行运动试验评估心功能情况;对于患者体能状态未知、需进行高心脏风险手术的患者,可以考虑行心肺运动试验;对于心脏风险高危但体能状态中至好(4≤METs<10)的患者,可无需进一步的运动试验和心脏影像学检查,而进行手术。对于心脏风险高危且体能状态差(METs<4=或未知的患者,如果评估结果会改变治疗方案,可进行运动试验和心脏影像学检查来评估心肌缺血的情况;对于心脏风险低危患者,常规使用无创负荷试验筛查是无效的。
4. 非心脏手术前的无创药物负荷试验
对于非心脏手术心脏风险高危且体能状态差的患者(<4METs),如果试验结果会改变治疗方案,应进行无创药物负荷试验(多巴酚丁胺负荷超声心动图或药物负荷心肌灌注成像)。对于心脏风险低危的非心脏手术的患者,常规使用无创负荷试验筛查是无效的。
5. 围术期冠状动脉造影
不推荐常规的围术期冠状动脉造影。
四、麻醉目标
心肌缺血性疾病患者的麻醉目标为预防、监测及治疗心肌缺血。
(一)预防心肌缺血
在不考虑外科手术进程、麻醉技术及治疗药物的前提下,最大化的提高心肌氧供及降低心肌氧耗是血流动力学调整的目标(表3)。
1.降低心率
保持心率在较低及正常范围内(50bpm~80bpm),如若发生心动过速,也需平衡心肌细胞的氧供和氧耗。
由于70%~80%冠状动脉血流的灌注发生在心脏舒张期,心肌氧供主要受舒张期时间的影响。
当心率增加一倍时,心肌氧耗增加超过一倍。
心率与舒张期时间之间的关系是非线性的(图3)。
2.维持正常血压
血压维持在基础值±20%范围内可有效的维持冠状动脉的灌注[平均动脉压75mmHg~95mmHg,和(或)舒张压65mmHg~85mmHg)。
严重低血压降低心肌氧供,而严重高血压增加心肌氧耗。
低血压的快速治疗可有效避免氧供不足导致的心肌缺血。
高血压可通过增加收缩期室壁压力及左室舒张末期压力(LVEDP)增加心肌氧耗(表3)。
由于左室舒张末期压力对心内膜下冠状动脉的压迫作用,使该部位冠脉对心肌缺血极其敏感。
3.维持正常左室舒张末期容积
液体超负荷导致的左室过度扩张会增加收缩期室壁压力及心肌氧耗。中心静脉压力及肺动脉压力监测都可用来评估左室容积,但这些监测手段也有其局限性。
4.充足的动脉血氧含量
维持正常以上的血红蛋白氧饱和度(脉搏血氧仪监测)、动脉血氧分压(PaO2)(动脉血气监测)、血红蛋白含量(≥80g/L),将最大程度的提高冠状动脉血氧含量。
5.正常体温
围术期应避免低体温的发生,低体温促进组织释放氧。低体温的不良反应如寒颤将增加心肌氧耗,有导致心肌缺血的风险。
表3 影响心肌氧供及氧耗的因素
↓ 降低氧供的因素↑ 心率*↓ 动脉血氧含量↓ 血红蛋白含量↓ 血氧饱和度↓冠状动脉血流量↓ 冠状动脉灌注压(CPP) (CPP) = DBP - LVEDP↓ 舒张压(DBP)↑ 左室舒张末期压力(LVEDP)↑ 冠状动脉血管阻力
↑ 增加氧耗的因素↑心率*↑左室收缩期室壁压力(左室后负荷)↑收缩压 (SBP)↑左室容积 (↑左室舒张末期容积 [LVEDV])↓ 左室室壁厚度↑ 心肌收缩力
1. 许多临床结论可从此表推测而来。
首先,心率增加(心动过速)降低氧供,增加氧耗,将增加心肌缺血的风险。
其次,严重贫血及低氧血症将降低氧供。
再者,LVEDV及LVEDP的增加通常是同时发生的,通过降低氧供(冠状动脉灌注压)、增加氧耗(后负荷)产生不利影响。
最后,严重低血压降低氧供(DBP)的坏处大于降低氧耗(SBP)的益处。
相反,严重高血压增加氧耗(后负荷)所产生的坏处大于增加氧供带来的益处。
2. 左室后负荷通常定义为左室收缩期室壁压力。
根据拉普拉斯定律,左室收缩期室壁压力=(左室收缩期压力)/2左室室壁厚度。
因此,增加左室后负荷的因素包括增加收缩压、左室半径和左室舒张末期容积。
应对血流动力学改变的正常(慢性)代偿包括左室变厚,从而维持正常的收缩期室壁压力,但是这种改变需要数月至数年。
围术期常发生血流动力学紊乱,收缩期压力及左室舒张末期容积的增加可提高左室后负荷,因此是有害的。
3. *对氧耗及氧供均有影响
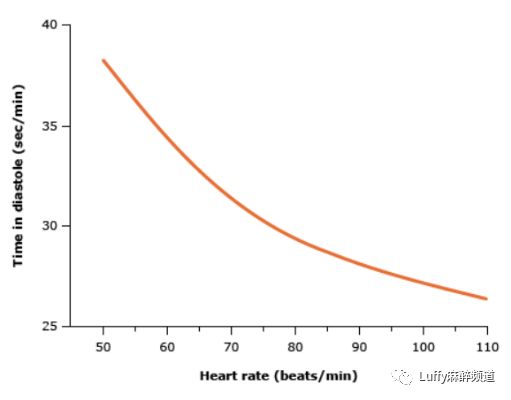
图3心率与舒张期时间之间的关系
每分钟舒张期总时间与每分钟心率之间的关系曲线。
随着心率增加,舒张期缩短,左室回心血量降低。
(二)心肌缺血的监测
在血流动力学平稳的情况下,仍有可能发生心肌缺血事件。对心肌氧供及氧耗之间的失衡以及对心肌缺血的监测应始终贯穿整个围术期。
1.心电图 所有患者均需持续监测心电图(ECG),监测心肌缺血及心律失常的发生。电脑自动对ST段的分析优于临床医师对ST段的解读,同时,多导联心电图监测比单导联心电图监测更为敏感。心电图监测对手术期间心肌缺血事件的发生并不非常敏感,但一项对12导联心电图监测的研究报道,Ⅱ及V5导联能够探测到80%心肌缺血事件的发生。虽然心电图监测存在敏感性低的缺点,但心肌缺血高风险的患者行非心脏手术时,围术期ST段的改变与心源性不良事件的发生关系密切。
2.有创动脉压力监测 有创动脉压力监测可有效监测实时血压。其适应证包括严重冠状动脉疾病、心肌病及血流动力学不稳定的患者,也适用于稳定型心肌缺血患者行大型并且可能存在大量失血及体液丢失的手术。在监测术中低血压事件上,直接动脉压力监测优于间接动脉压力监测技术,麻醉诱导前行直接动脉监测是最优策略。在围术期指导血管活性药物使用、抽取动脉血行动脉血气分析等方面,有创动脉压力监测均起到重要作用。
3.中心静脉压力监测 出血量大、需要大量输注液体或需要泵注血管活性药物等情况,决定患者是否需要中心静脉置管。中心静脉压(CVP)常被用于监测容量负荷,但不能有效的预测液体复苏效果。
4.肺动脉导管 不推荐肺动脉导管(PAC)用于监测心肌缺血。与心电图监测、经食道超声心动图相比,术中肺动脉压力尤其是肺动脉楔压并非有效的监测指标。在大多数性心脏或非心脏手术患者中,围术期PAC似乎没有益处甚至有害。在少数存在血流动力学障碍的严重心血管疾病患者中,PAC可以用于监测充盈压、计算心排血量及肺动脉压力及其变化趋势。是否使用PAC更多取决于患者心血管状况(严重的心肌病或瓣膜病变)及手术可能的风险(存在潜在大量体液转移及出血)。
5.经食管超声心动图 术中经食管超声心动图(TEE)是监测室壁运动异常高风险患者的有效手段,尤其是行重大手术的患者。在监测心肌缺血上,TEE比 ECG及PAC更敏感。然而,目前尚未有证据显示TEE监测能够降低围术期严重心血管不良事件。在超声工程师及TEE专家均在场的情况下,围术期TEE的紧急使用适用于不明原因的、持续性的或威胁生命的循环紊乱。TEE监测能够鉴别低血容量、左室和(或)右室功能异常、心包积液及心包压塞、瓣膜狭窄或反流、肺动脉栓塞及左室流出道梗阻。
(三)心肌缺血的治疗
术中ECG出现特征性的ST段改变,最为常见的是ST段的上移及下降,提示为需治疗的心肌缺血。在大部分患者,第一步为治疗心律失常。若缺血性ECG持续存在,硝酸甘油的治疗通常是有效的;还可采用硝酸甘油协同去氧肾上腺素维持正常的动脉血压。对于术中发生心肌缺血的患者,这些干预方法能够最大化提高心肌氧供,降低心肌氧耗。
1.治疗心动过速 全身麻醉术中由疼痛或麻醉深度不够导致的心动过速(HR超过100bpm)的治疗方案包括,单次静脉注射麻醉药物(例如丙泊酚、阿片类药物)及给予吸入麻醉药物。若已置入硬膜外导管,可单次追加局麻药来加深麻醉。如果上述措施无法有效降低心率可考虑静脉注射β受体阻滞剂(例如艾司洛尔、美托洛尔、拉贝洛尔)。
2.治疗高血压 由疼痛或麻醉深度不够导致的高血压治疗方案包括,单次经静脉给予麻醉药物(例如丙泊酚、阿片类药物)、给予吸入麻醉药物及硬膜外追加局麻药物。酌情使用β受体阻滞剂(例如艾司洛尔、美托洛尔、拉贝洛尔)或舒血管药物(例如拉贝洛尔、尼卡地平及硝酸甘油)。
高血压患者术中出现持续性的心肌缺血,可泵注硝酸甘油[10µg/min ~400µg/min或按照0.1µg/(kg·min)~4µg/(kg·min)]调控血压(表4)。硝酸甘油扩张心外膜内的冠状动脉,扩张外周静脉从而降低左室前负荷,但需要权衡硝酸甘油导致的低血压及剂量依赖性的心动过速所带来的风险。
麻醉药物及硝酸甘油扩张血管可导致低血压甚至加重心肌缺血。协同应用去氧肾上腺素[10µg/min~200µg/min或按照0.1µg/(kg·min)~2µg/(kg·min)]可有效维持血压(表4)。在硝酸甘油持续输注过程中,直接动脉穿刺持续监测动脉压力是有益的。在行非心脏手术的患者中不推荐预防性给予硝酸甘油来降低心肌缺血的发生。经皮给予硝酸甘油因吸收不均匀,应避免应用。
3.治疗低血压 低血压(平均动脉压<75mmHg或舒张压<65mmHg)的起始治疗方案包括减浅麻醉深度及加快液体输注。重复静脉给予1受体兴奋剂(静脉注射去氧肾上腺素40µg~100µg)、具有1及受体激动效应的直接或间接拟交感药物(例如麻黄碱5mg~10mg)可有效治疗严重低血压。如果低血压持续发生,可持续输注去氧肾上腺素[10µg/min~200µg/min或按照0.1µg/(kg·min)~2µg/(kg·min)]。外周血管收缩药血管加压素(1U/h~4U/h或0.01U/min~0.067U/min)及去甲肾上腺素[11µg/min~30µg/min或按照0.01µg/(kg·min)~0.3µg/(kg·min))可有效治疗血管麻痹(例如ACEI及脓毒症休克导致的外周血管低阻力、严重及难治性低血压)。与去氧肾上腺素及去甲肾上腺素相比,血管加压素由于其选择性的血管收缩效应,是肺动脉高压患者低血压治疗的较优选择(表4)。
强心治疗是左(右)室功能不全时低血压有效的治疗方法。常用的药物为肾上腺素[1µg/min~100 µg/min或按照0.01µg/(kg·min)~1µg/(kg·min)]、去甲肾上腺素[1µg/min~30 µg/min或按照0.01µg/(kg·min)~0.3µg/(kg·min)]、多巴胺[5µg/(kg·min)~20µg/(kg·min) ](表4)。在输注强心药物及缩血管药物时必须直接监测动脉血压。
4.维持血液携带氧的能力 给予足够的氧供以维持血红蛋白氧饱和度≥95%。为了维持氧携带能力,在稳定性心肌缺血患者血红蛋白含量≤80g/L时(或者近期发生心肌梗死、不稳定型心绞痛的患者血红蛋白含量≤90g/L),尤其当存在持续性出血、低血容量、心肌及其他器官缺血时,考虑输注红细胞。
5.防治低体温 液体应加温后输注。保温毯及空气加温设备应该用于预防患者低体温。
表4手术室内血管活性药物的参考剂量:成人剂量*
药物
分类
主要机制
输注剂量
血管加压素
血管收缩剂
血管加压素-1及血管加压素-2受体
1U/h~6U/h
或0.01U/min~0.1U/min¶
去氧肾上腺素
血管收缩剂
受体
10µg/min~200 µg/min
或0.1µg/(kg·min)~2µg/(kg·min)
去甲肾上腺素
强心/血管收缩剂
、受体
1µg/min~30µg/min
或0.01µg/(kg·min)~0.3µg/(kg·min)
多巴胺
强心/血管收缩剂
多巴胺受体(D)
<3µg/(kg·min)(D)
受体
3µg/(kg·min)~10µg/(kg·min) (β1及 β2)
受体
>10µg/(kg·min) (α)
多巴酚丁胺
强心/血管舒张剂
受体
1µg/(kg·min)~20µg/(kg·min)
肾上腺素
强心/血管收缩剂
受体
受体
1µg/min~100µg/min
或0.01µg/(kg·min)~1µg/(kg·min)
1µg/min~2µg/min (β2)Δ
2µg/min~10µg/min (β1, β2)
10µg/min~100µg/min (α)
米力农
强心/血管舒张剂
磷酸二酯酶抑制剂
[降低环腺苷酸(cAMP)降解速率]
负荷剂量50 µg/kg于10min以上输注,然后0.375µg/(kg·min)~0.75µg/(kg·min) 维持
异丙肾上腺素
强心/血管舒张剂
受体
5µg/min~20µg/min
或0.0µg/(kg·min)~0.2µg/(kg·min)
氯维地平
血管舒张剂
抑制钙离子内流;
选择性舒张动脉血管平滑肌
1mg/h~16mg/h
或0.02mg/min~0.27mg/min
尼卡地平
血管舒张剂
抑制钙离子内流;
选择性舒张动脉血管平滑肌
5mg/h~15mg/h
或0.08 mg/min~0.25 mg/min
硝酸甘油
血管舒张剂
增加环鸟苷酸 (cGMP)
10µg/min~400µg/min
或0.1µg/(kg·min)~4µg/(kg·min)
硝普钠
血管舒张剂
舒张平滑肌
10µg/min~400µg/min◊
或0.1µg/(kg·min)~4µg/(kg·min)
艾司洛尔
肾上腺素拮抗剂
抗心律失常剂
受体
单次静脉注射10mg~50mg,然后 25µg/(kg·min) ~300µg/(kg·min) 维持
拉贝洛尔
肾上腺素拮抗剂
1 受体受体
单次静脉注射5mg~20mg,然后0.5mg/min~2 mg/min维持
V: 血管加压素;D: 多巴胺能;α: α 肾上腺能;β: β肾上腺能
* 剂量范围设置按照成人标准体重
¶ 血管加压素输注剂量>0.04U/min主要用于挽救疗法(例如,在使用其他血管加压药物仍无法达到足够的平均动脉压的情况)
Δ 低剂量的肾上腺素具有舒张支气管、扩张动脉、降低血压的效应,剂量依赖性的药效范围需根据临床经验来确定
◊硝普钠输注剂量>400µg/min是不推荐的,因为可能降低带来的益处,同时有硫氰酸盐及氰化物中毒的风险
五、麻醉管理
(一)麻醉前用药
无论选择何种麻醉技术,术前疼痛或焦虑引起的心动过速和高血压是需要治疗的(见上文“预防缺血”)。若患者处于监护下,可在全麻诱导前30min~60min或全麻诱导期间给予咪达唑仑1mg~4mg以缓解焦虑,由于咪达唑仑可引起血压和心排出量的轻微下降,血容量不足的患者和老年患者要减量或避免使用。与之类似,可以对监护状态下的患者给予小剂量的阿片类药物(例如,芬太尼25µg~50µg)治疗术前疼痛,同时注意避免呼吸抑制。
(二)麻醉方式的选择
麻醉方法的选择主要取决于手术要求及外科医师和患者的偏好。对于胸腔或腹部行大切口手术的缺血性心脏病患者,我们建议采用椎管内麻醉技术联合或替代全身麻醉,以便为患者提供术后镇痛。采用椎管内麻醉和其他区域麻醉技术联合或替代全身麻醉,可以通过改善术后镇痛和阻断心脏交感神经纤维以减轻应激诱发的心率增快。目前,仅有间接证据支持这种方法。
考虑到硬膜外血肿的风险,我们不建议给目前接受抗凝药物或抗血小板治疗(除外单独使用阿司匹林)的患者进行椎管内穿刺或置管。在需要静脉注射肝素行术中抗凝治疗的患者(如腹主动脉瘤手术),可以行椎管内穿刺或置管。对于留置硬膜外导管的患者,在穿刺或置管至少1h后术中可以使用普通肝素。应在患者凝血功能恢复数小时后拔除硬膜外置管。
(三)局麻监护、强化麻醉
对于该类患者,关键问题是避免疼痛和(或)焦虑引起的心动过速和高血压,此类血液动力学改变可增加心肌氧耗和(或)减少心肌氧供(见上文“预防缺血”)。因此,可以给予小剂量短效药物(例如咪达唑仑、阿片类药物、丙泊酚或右美托咪定)以提供镇痛、抗焦虑和(或)镇静作用。更为重要的是,应连续监测,防止低血压、呼吸抑制及其所致的低氧血症的发生。
(四)椎管内麻醉
适用于没有接受抗血小板和抗凝药物并且同意实施椎管内麻醉的患者。椎管内麻醉的目标是,术中维持足够的麻醉效果,术后提供足够的镇痛而不引起低血压,避免危害心肌氧供需平衡。
椎管内麻醉由于产生交感神经阻滞从而降低心脏的前负荷,导致低血压,多见于血容量不足或有心力衰竭、心脏舒张功能障碍的患者(其血压依赖于足够的前负荷)。在这些患者中,我们采用改良的椎管内麻醉技术(例如,蛛网膜下腔给予小剂量局麻药复合或不复合鞘内应用阿片类药物,或缓慢滴定硬膜外局麻药物用量)。
椎管内麻醉需要适当补液以防止低血压,同时应注意避免过量输注(例如,补1000ml晶体液)和(或)给有症状的心力衰竭患者快速补充大量的液体。应该减少晶体液的用量并减缓补液速度(例如,根据需要以250ml的补液量逐步增加,同时严密监测患者对补液的血流动力学改变和临床反应)。
必要时可使用α1受体激动药,如去氧肾上腺素40至100µg和(或)兼有α和β受体激动作用的直接/间接拟交感胺(例如,麻黄碱5mg~10mg)快速纠正低血压,根据需要可重复使用(参见上文“心肌缺血的治疗”)。
(五)全身麻醉
1.诱导 全身麻醉诱导的目标包括无意识、减轻插管和手术刺激所致的血流动力学改变,同时避免血流动力学改变所致心肌氧供需失衡。
气管插管应选择速效、短效药物(如依托咪酯0.3mg/kg或缓慢给予小剂量丙泊酚约1mg/kg),复合小剂量的阿片类药物(如芬太尼1µg/kg~2µg/kg)或利多卡因50mg~100mg以减轻喉镜检查和插管时的交感神经反应。此外,应用肌肉松弛药物以助于喉镜置入。
依托咪酯对血流动力学影响小,通常作为严重心肌病、心源性休克或血流动力学不稳定患者首选的麻醉诱导药。使用依托咪酯的主要问题是其抑制皮质醇的生物合成,这种效应在单次给药后持续<24h,其临床意义尚不确定。丙泊酚是常用的麻醉诱导药。
与依托咪酯相比,丙泊酚可降低交感神经兴奋(如降低全身血管阻力)、增加静脉血管床(减少静脉回流)和(或)直接抑制心肌收缩力导致血压降低。因此,为尽可能减少低血压,可降低用量至1mg/kg或更低,对老年患者和其他容易发生低血压的患者(如,血容量不足、心脏舒张功能障碍依赖于足够的前负荷的患者)应缓慢给予或分次滴定使用。
必要时可以给予小剂量的α1受体激动剂(如去氧肾上腺素40µg至100µg)纠正低血压。
缺血性心脏病患者应避免使用氯胺酮,氯胺酮可产生拟交感神经兴奋作用,导致心率、平均动脉压升高。对于缺血性心脏病患者,心率增加是不合适的。
2.维持 全身麻醉的维持应根据手术需要和患者病情综合考虑,可采用吸入麻醉或全凭静脉麻醉。在大多数患者中,通常可选择以挥发性麻醉药(如七氟烷、异氟烷或地氟烷)为主,复合阿片类药物和(或)其他麻醉药物(如,丙泊酚、肌肉松弛药)以达到取长补短的最佳麻醉效果。
虽然挥发性麻醉药可能具有心脏保护作用,但对非心脏手术患者其临床意义尚不确定。
3.苏醒 全麻苏醒期间,兴奋和疼痛以及气管拔管操作可刺激交感神经,引起心动过速和高血压,导致心肌缺血。因此,在患者全麻苏醒前应优化镇痛(如,给予阿片类药物或经由已有的硬膜外导管使用局麻药);在苏醒和拔管过程中适时适量地应用β受体阻滞剂(例如艾司洛尔、拉贝洛尔或美托洛尔)、血管舒张剂(例如,拉贝洛尔、尼卡地平或硝酸甘油),维持患者血流动力学平稳。
(六)心律失常的治疗
心律失常在缺血性心脏病患者中并不少见。术前有心律失常病史的患者术中应进行心电监测,一般情况下进行对症处理可以控制,严重心律失常的术中管理总结如下:
1.室性早搏及心动过速 频发室性早搏及心动过速应查明原因,如电解质异常、低血压、心肌缺血等,立即给予纠正,同时给予利多卡因;无效时可考虑应用适量β受体阻滞剂,必要时可行电复律。
2.室颤
需要立即进行心脏电除颤及心肺复苏。纠正水、电解质失衡;如果复发,需使用抗心律失常药,立即给予胺碘酮150mg(或2.5mg/kg),以5%葡萄糖稀释,快速推注,然后再次除颤。
如仍无效可于10min~15min后重复追加胺碘酮150mg(或2.5mg/kg)。注意用药不应干扰心肺复苏和电除颤。
室颤转复后,胺碘酮可静脉滴注维持量。
在初始6h以内以0.5mg/min~1mg/min速度给药,可维持12h。
3.房颤
房颤是一种常见的心律失常,尤其多见于心脏病患者。
房颤的治疗应在心电血压监测下进行药物复律或电复律。药物复律常用胺碘酮75mg~150mg静脉缓慢注射;
控制心率药物如艾司洛尔、地尔硫卓可控制心室率。
然而,若房颤与低血压、心源性休克或肺水肿明显相关,则需要立即电复律以恢复窦性心律。
4.心动过缓
严重的心动过缓(例如,心率<40次/min)可能导致组织灌注不足(例如低血压、精神状态改变)的体征和症状,通常使用格隆溴铵、阿托品或麻黄碱治疗,同时准备好经皮起搏器和(或)强效的正性变时作用的药物(例如,肾上腺素)。
阿托品或肾上腺素的使用可引起心动过速,尽管不期望心动过速见于心肌缺血患者,但优于心脏停搏。
(七)血糖控制
缺血性心脏病患者围术期血糖应控制在<10mmol/L,并注意避免低血糖发作。
在血管和其他非心脏手术中,高血糖与心肌缺血事件的风险增加相关,但低血糖也有危害。危重患者的一项试验表明,与较宽松的血糖管理(<10mmol/L)相比,严格控制血糖(4.5mmol/L~6.0mmol/L)与更多的低血糖事件和更高的死亡率相关。
六、术后管理
(一)缺血监测
大多数非心脏手术患者的心血管事件发生在术后。缺血性心脏病患者高危手术后,建议加强监测,持续监测心电图及血压,及时发现并处理心肌缺血、心律失常和低血压,防止心肌梗死等严重并发症。必要时可连续记录12导联心电图及检测肌钙蛋白含量来筛查围术期心梗的发生。
(二)疼痛管理
围术期有效的疼痛管理可消除应激及其相关不良的血流动力学波动以及高糖状态。没有手术禁忌证的可合作患者,接受腹部大手术或胸科大手术时,推荐选用硬膜外麻醉进行超前镇痛,也可蛛网膜下腔予以长效阿片类药物(如吗啡或氢化吗啡)以提供12至24小时的术后镇痛。
特定的区域麻醉技术对于疼痛的管理也非常有效,具体选择主要取决于手术部位(如上肢手术的镇痛行臂丛神经阻滞,下肢手术的镇痛行股神经或坐骨神经阻滞,乳腺、胸科或上腹部手术行肋间或椎旁神经阻滞)。
围术期疼痛管理的其他技术还包括患者自控镇痛(PCA)。
对于心肌缺血的患者,要避免使用非甾体类消炎药物(NSAIDs)及环氧合酶-2(COX-2)抑制剂。
参考文献
1.Fleisher LA, Fleischmann KE, Auerbach AD, et al. 2014 ACC/AHA guideline on perioperative cardiovascular evaluation and management of patients undergoing noncardiac surgery: Executive summary: A report of the american college of cardiology/american heart association task force on practice guidelines. J Nucl Cardiol 2015;22:162-215.
2.Kristensen SD, Knuuti J. New ESC/ESA guidelines on non-cardiac surgery: Cardiovascular assessment and management. Eur Heart J 2014;35:2344-2345.
3.Fleisher LA, Beckman JA, Brown KA, et al. ACC/AHA 2007 guidelines on perioperative cardiovascular evaluation and care for noncardiac surgery: Executive summary: A report of the american college of cardiology/american heart association task force on practice guidelines . J Am Coll Cardiol 2007;50:1707-1732.
4.Levine GN, Bates ER, Bittl JA, et al. 2016 ACC/AHA guideline focused update on duration of dual antiplatelet therapy in patients with coronary artery disease: A report of the american college of cardiology/american heart association task force on clinical practice guidelines. J Thorac Cardiovasc Surg 2016;152:1243-1275.
5.Devereaux PJ, Mrkobrada M, Sessler DI, et al. Aspirin in patients undergoing noncardiac surgery. N Engl J Med 2014;370:1494-1503.
6.London MJ. Preoperative administration of angiotensin-converting enzyme inhibitors or angiotensin ii receptor blockers: Do we have enough "vision" to stop it? Anesthesiology 2017;126:1-3.
7.Roshanov PS, Rochwerg B, Patel A, et al. Withholding versus continuing angiotensin-converting enzyme inhibitors or angiotensin ii receptor blockers before noncardiac surgery: An analysis of the vascular events in noncardiac surgery patients cohort evaluation prospective cohort. Anesthesiology 2017;126:16-27.
8.Mark JB. Multimodal detection of perioperative myocardial ischemia. Tex Heart Inst J 2005;32:461-466.
9.Maile MD, Engoren MC, Tremper KK, et al. Variability of automated intraoperative st segment values predicts postoperative troponin elevation. Anesth Analg 2016;122:608-615.
10.Poldermans D, Bax JJ, Boersma E, et al. Guidelines for pre-operative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery: The task force for preoperative cardiac risk assessment and perioperative cardiac management in non-cardiac surgery of the european society of cardiology (ESC) and endorsed by the european society of anaesthesiology (ESA). Eur J Anaesthesiol 2010;27:92-137.
11.Carson JL, Brooks MM, Abbott JD, et al. Liberal versus restrictive transfusion thresholds for patients with symptomatic coronary artery disease. Am Heart J 2013;165:964-971 e961.
12.Guay J, Kopp S. Epidural pain relief versus systemic opioid-based pain relief for abdominal aortic surgery. Cochrane Database Syst Rev 2016:CD005059.
13.Uhlig C, Bluth T, Schwarz K, et al. Effects of volatile anesthetics on mortality and postoperative pulmonary and other complications in patients undergoing surgery: A systematic review and meta-analysis. Anesthesiology 2016;124:1230-1245.
14.Lurati Buse GA, Schumacher P, Seeberger E, et al. Randomized comparison of sevoflurane versus propofol to reduce perioperative myocardial ischemia in patients undergoing noncardiac surgery. Circulation 2012;126:2696-2704.
15.Sigmund AE, Fang Y, Chin M, et al. Postoperative tachycardia: Clinically meaningful or benign consequence of orthopedic surgery? Mayo Clin Proc 2017;92:98-105.
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
中国产科麻醉专家共识(2021版)
【指南·共识】剖宫产手术专家共识(2023)
【麻海新知】急性围手术期疼痛管理指导原则的多学会组织专家共识
围术期血糖管理专家共识(2021版)
北京协和医院麻醉科诊疗常规:专科手术麻醉之减肥手术麻醉(三)(四)
【麻醉热点】减肥手术的麻醉
减重代谢外科围术期处理专家共识
胸外科围手术期肺保护中国专家共识(2019 版)
减重代谢外科围术期处理专家共识(2019版)
【专家共识划重点】基于加速术后康复的胸外科手术预康复管理专家共识 ( 2022)
网址: 麻醉指南与专家共识学习 day15冠心病患者非心脏手术麻醉及围术期管理的专家共识 https://www.trfsz.com/newsview493876.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3880
- 2早上怎么喝水最健康? 3664
- 3习惯造就健康 影响健康的习惯 3311
- 4五大原因危害女性健康 如何保 3219
- 5连花清瘟、布洛芬等多款感冒药 2975
- 6男子喝水喉咙里像放了刀子一样 2469
- 710人混检核酸几天出结果?1 2233
- 8第二轮新冠疫情要来了?疾控中 2232
- 9转阴多久没有传染性?满足四个 2167
- 10补肾吃什么 补肾最佳食物推荐 2166






