肠道菌群利用膳食纤维及其与人体健康关系研究进展
摘 要:膳食纤维具有提供能量、增强机体免疫的功能,对于人体健康至关重要,被营养学界认定为与蛋白质、脂肪、碳水化合物、维生素、矿物质与水并列的第7类营养素。肠道菌群能激活和维持人的免疫系统和新陈代谢的稳定性,肠道菌群的稳态对人体的发育和成熟至关重要。肠道菌群能够消化膳食纤维,二者之间存在着复杂的相互作用,共同促进和维持肠道健康。近年来,膳食纤维与肠道菌群之间的相互作用受到了科学家广泛关注并取得很大进展。该文就膳食纤维、肠道菌群及其与人体健康关系的研究现状进行了回顾和展望,为深入了解膳食纤维对人体的作用,合理调整膳食结构,促进肠道健康提供参考。
膳食纤维是指食物中含有3个或更多单体单位的一类碳水化合物聚合物,该类聚合物一般不被人体胃和小肠消化、吸收,但能被肠道菌群发酵的具有重要生理功能的一大类碳水化合物的总和。膳食纤维按其溶解度分类可分为可溶性膳食纤维(树胶、果胶、藻胶、豆胶等)和不溶性膳食纤维(纤维素、木质素等),二者的化学结构和生理功能迥异[1]。近年来,膳食纤维、肠道菌群及其与人体健康关系的研究受到了科学家广泛关注,大量研究从多个研究角度对膳食纤维的健康功效进行了挖掘与探索并取得很大进展[2]。
膳食纤维对维持肠道菌群稳态、肠道黏液的生成和降解平衡、保护肠壁结构等肠道健康的良性循环具有重要作用[3]。不同种属的肠道菌对膳食纤维的利用方式、其发酵产物生理功能等都存在较大差别,通过研究膳食纤维对肠道菌群的组成及其与代谢产物发酵的关系以及对机体健康的影响,可为临床上调整膳食结构、修复肠道功能、增强机体免疫力、预防疾病提供科学依据,同时也可为新型健康食品的开发、粮食深加工及其应用提供借鉴[4-5]。
本文就膳食纤维、肠道菌群及其与人体健康关系的研究现状进行了回顾和展望,以期为深入了解膳食纤维对人体的作用,合理调整膳食结构,促进肠道健康提供参考。
1 膳食纤维对肠道菌群组成及短链脂肪酸代谢的影响
人胃肠道中约有500~1 000种细菌,总数约10万亿个,和人体细胞总数相当[6],肠道菌群在人体健康中起着重要的作用,食用可被肠道菌群代谢的膳食纤维和益生元可以调节肠道菌群组成和代谢功能,以改善健康、预防或治疗疾病。
1.1 肠道菌群与短链脂肪酸合成关系
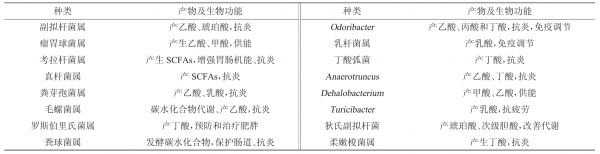
大多数由复杂的碳水化合物和植物多糖构成的膳食纤维不能为人体分泌的消化酶所代谢,但能被肠道菌群发酵产生包括乙酸盐、丙酸盐和丁酸盐等在内的短链脂肪酸(short-chain fatty acids,SCFAs)。肠道菌群组成十分复杂且易受宿主的饮食习惯、年龄、性别、体型等影响,不同的肠道菌群在宿主体内发挥着不同的作用,因此,对利用膳食纤维产生SCFAs菌进行归类[7-10](见表1)。
表1 主要肠道膳食纤维代谢菌及其产物和功能
Table 1 Main intestinal dietary fiber metabolites microbes and their products and functions
1.2 膳食纤维对肠道菌群及代谢产物的影响
有研究表明,膳食纤维和全谷类食物的摄入增多可诱导肠道菌群多样性增加,而膳食纤维摄入量过低可导致肠道菌群枯竭并诱发肥胖、心血管疾病、糖尿病和结肠癌等慢性非传染性疾病的发生或增加[11-12]。膳食纤维的来源、化学成分、物理化学性质、聚合程度以及用量对肠道菌群的组成及发酵产物都会产生不同的影响[1,13](见表2),这与肠道菌群中不同类型的菌株的基因组中编码的催化多糖降解的酶类种类和数量密切相关(见图1)[14]。
表2 膳食纤维对肠道菌群及代谢产物的影响
Table 2 Effects of dietary fiber on intestinal flora and metabolites


图1 膳食纤维组成及剂量对肠道菌群及其发酵产物影响
Fig.1 Effects of dietary fiber composition and dosage on intestinal flora and fermentation products
2 肠道菌群对膳食纤维的利用机制
2.1 肠道菌群利用膳食纤维相关的酶
人类消化系统不能直接利用食物中的膳食纤维,而肠道菌群在膳食纤维的转化和利用中发挥重要作用。肠道菌群借助其自身编码的一大类能够水解各种复杂聚糖的碳水化合物活性酶(carbohydrate-active enzymes,CAZymes)对膳食纤维进行相应的催化或转化,产生能被机体利用的SCFAs等代谢产物[15]。CAZymes在将纤维素、聚糖、淀粉和糖原等复杂碳水化合物分解成可被肠上皮细胞吸收的成分中起着至关重要的作用[16]。这类酶主要有参与催化糖苷键的水解和/或重排的糖苷水解酶(glycoside hydrolases,GHs)、参与多糖糖苷键的非水解裂解的多糖裂解酶(polysaccharide lyases,PLs)、参与糖苷键的形成的糖基转移酶(glycosyltransferases,GTs)、催化碳水化合物酯的水解的碳水化合物酯酶(carbohydrate esterases,CEs)、碳水化合物结合模块(carbohydrate-binding modules,CMBs)以及与胞浆酶共同作用,具有氧化还原酶活性的辅助酶类(auxiliary activities,AAs)[17]。目前已在细菌(17 054种)、古菌(367种)、病毒(411种)以及真核微生物(278种)基因组中发现了上万种CAZymes酶类编码基因,分别编码300多种参与膳食纤维代谢的酶[15]。
2.2 肠道菌群利用膳食纤维相关代谢途径
肠道菌群将膳食纤维分解成不同类型的单糖,然后经由Wood-Ljungdahl途径、琥珀酸途径、丙烯酸途径和丙二醇途径(图2)等将单糖进一步降解成SCFAs(主要产品)或长链脂肪酸(少量)等产物[18-19]。其中乙酸为SCFAs主要成分,由肠道菌群通过乙酰辅酶A或Wood-Ljungdahl途径代谢丙酮酸产生。丙酸盐则主要通过琥珀酸途径将琥珀酸转化为甲基丙二酰辅酶A产生,或者丙烯酸与乳酸作为前体通过丙烯酸酯途径合成丙酸,也可以脱氧己糖(如海藻糖和鼠李糖)为底物、通过丙二醇途径合成。丁酸盐则通过两分子乙酰辅酶A缩合、还原为丁酰辅酶A,然后通过磷酸丁酰转移酶和丁酸激酶转化为丁酸(经典途径),丁酰辅酶A也可以通过丁酰辅酶A:乙酸辅酶A转移酶途径转化为丁酸。肠道中的某些微生物可以利用乳酸和乙酸合成丁酸,这可以防止乳酸的蓄积以稳固肠道环境。宏基因组数据分析还表明,丁酸盐可以通过赖氨酸途径从蛋白质中合成,进一步表明肠道菌群能够适应营养转换以维持必需代谢物如SCFAs的合成[20]。

图2 膳食纤维体内转化的主要代谢途径
Fig.2 Main metabolic pathways of dietary fiber transformation in vivo
膳食纤维的降解主产物是SCFAs,在肠道的不同部位,对膳食纤维的发酵利用的程度和发酵产物的组成及浓度也不一样[21]。在盲肠以前的肠段对膳食纤维几乎没有分解代谢能力,而进入盲肠和结肠以后,由该区域微生物群将膳食纤维发酵代谢产生以乙酸盐、丙酸盐和丁酸盐为主的SCFAs并被肠道上皮细胞吸收、转运和利用,故SCFAs在盲肠和近端结肠中浓度最高、远端结肠SCFAs浓度下降[22]。从体内代谢和分布来看,丁酸盐是结肠细胞的主要能量来源并主要在结肠部位消耗,丙酸则经门脉系统在肝脏代谢,二者在外周血中保持低浓度,二乙酸盐则是外周循环中最丰富的SCFAs,通过中枢稳态机制穿过血脑屏障而发挥生理作用[23]。
3 肠道菌群发酵膳食纤维对人体的影响
肠道菌群在结肠中发酵膳食纤维可产生SCFAs被结肠细胞迅速吸收、被动扩散或与碳酸氢盐(HCO3-)交换,然后部分氧化为CO2,以三磷酸腺苷(adenosine triphosphate,ATP)的形式为细胞产生能量。未经结肠细胞代谢的SCFAs通过基底外侧膜进入肝门静脉循环,通过氧化作用为肝细胞提供能量底物。在葡萄糖、胆固醇和脂肪酸的生物合成过程中,短链脂肪酸进入肝细胞中,只有少量的结肠产生的SCFAs到达系统循环。进入循环的SCFAs经由免疫系统、肝胰门脉系统、脂肪组织等转化成激素、白介素、5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)、胰高血糖素样肽-1(glucagon like peptide-1,GLP-1)和肽酪氨酸酪氨酸(peptide YY,PYY)等具有调节活性测代谢小分子,突破血脑屏障进入中枢神进系统,通过影响肠-脑轴而对机体发挥广泛的调节作用(图3)[24-25]。

图3 膳食纤维与-肠-脑轴的关系
Fig.3 Relationship of dietary fiber and its gut-brain axis
肠道菌群发酵膳食纤维产生的SCFAs是体内重要的能量来源和信号分子,可通过激活激素和神经系统间接影响外周器官,在调节宿主代谢、免疫系统和细胞增殖方面发挥作用[26]。如丁酸可作为组蛋白去乙酰酶(histone deacetylase,HDACs)的抑制剂、通过抑制HDACs改变多种功能基因表达来调节细胞增殖、凋亡和分化从而抑制结肠直肠癌和炎症。有研究表明丙酸也可在一定程度上抑制HDACs的活性,此外丙酸盐还具有抗炎或免疫抑制功能[26]。
膳食纤维饮食诱导的乙酸、丙酸和丁酸等SCFAs可激活上皮细胞GPR43等GPCRs受体进而激活NLRP3炎症小体以维持肠内稳态[27]。越来越多研究表明膳食纤维在肠道菌群作用下产生的SCFAs不仅作用于肠道,还可以作用于大脑等身体的远端部位,调节大脑皮层细胞膜通透性、诱导神经冲动发生和宿主行为改变。此外,它们还可以独立于中枢神经系统而调节自主神经功能[28]。如丁酸盐可通过激活过氧化物酶体增殖物激活受体-γ(peroxisome proliferatoractivated receptor-γ,PPAR-γ)通路抑制包括免疫细胞在内的肠道细胞的一氧化氮合酶2(nitric oxide synthase,NOS2)表达,减少钙调素激活的一氧化氮合酶,(inducible nitric oxide synthase,iNOS)和硝酸盐的产生,从而抑制肠杆菌科细菌利用硝酸盐进行的有氧呼吸而不能大量繁殖,进而维持了肠道菌群稳态[29]。
作为大肠细胞的主要能量来源,SCFAs调控着肠道内多种营养物质的吸收及激素产生,广泛参与能量代谢。如动物实验证明循环SCFAs可以通过血脑屏障,作为肠-脑轴(gut-brain axis)的信号分子,直接为神经细胞提供能量[30]。SCFAs也可以直接调控胰岛β细胞的数量和功能,增加单糖吸收和转移至肝门静脉循环,调节宿主的能量平衡和代谢。有研究显示,服用产生丁酸或乙酸的益生菌可有效预防、控制糖尿病[31]。SCFAs能够直接调控小鼠结肠调节性T细胞(cTreg)的数目与功能,从而调节免疫系统[32]。
4 结论与展望
得益于基因组、代谢组及微生物组技术的巨大进步,人们对肠道菌群降解膳食纤维的代谢过程及其代谢产物对机体的功能研究取得了较大进展。人体摄入膳食纤维不仅能改善肠道菌群组成,更可以促进大量内源性SCFAs的形成,参与体内能量代谢,对于调节机体能量平衡和改善结肠炎、糖尿病、肥胖等慢性病都大有裨益。已有研究报道服用产丁酸或乙酸的益生菌制剂的临床试验,发现SCFAs可以有效促进空腹脂肪氧化、降低空腹血糖、控制体重、改善糖脂代谢紊乱、增加静息能量消耗,可有效控制或预防糖尿病[33-35]。这些都表明将来可以通过调整膳食纤维的摄入的种类和数量可以对肠道菌群进行调控以达到治疗慢性疾病或提高机体免疫力的目的,因而在医疗保健等领域有着广泛和重大的应用价值。然而也有研究表明膳食纤维引起的乙酸摄入增加会刺激实验动物的副交感神经系统进而触发胰岛素分泌,促进胃饥饿素(ghrelin)和胃泌素(gastrin)分泌和释放,增进食欲,导致动物采食增加,引起甘油三酯升高、肝脏和肌肉脂肪堆积以及恶化肥胖相关的代谢性疾病[36]。这表明膳食纤维对机体的作用不仅与其经肠道菌群代谢产生的SCFAs总量、种类及比例有关,还可能与个体的身体机能状态、饮食结构、年龄、性别等生理因素密切相关[37]。这些表明膳食纤维用于人肠道功能的调节所经由的能量代谢以及肠-脑轴的调控模式还有待于进一步解析,膳食纤维用于临床或日常生活还需要投入更多研究。总之,膳食纤维作为人体的一种重要的营养要素,经肠道菌群降解后的SCFAs等产物具备重要的生物功能,具有极大的推广价值和应用前景。
参考文献:
[1]HOLSCHER H D.Dietary fiber and prebiotics and the gastrointestinal microbiota[J].Gut Microb,2017,8(2):172-184.
[2]SIMPSON H L,CAMPBELL B J.Review article:dietary fibre-microbiota interactions[J].Aliment Pharmacol Therapeut,2015,42(2):158-179.
[3]VAN DER KAMP J W,HARRIS P J.Editorial for the special issue"dietary Fibre:New Insights on biochemistry and health benefits"[J].Int J Mol Sci,2018,19(11):3556.
[4]BOCTOR D.The role of dietary fibre and prebiotics in the paediatric diet[J].Paediatr Child Health,2020,25(4):263-264.
[5]MYHRSTAD M C W,TUNSJØ H,CHARNOCK C,et al.Dietary fiber,gut microbiota,and metabolic regulation-current status in human randomized trials[J].Nutrients,2020,12(3):859.
[6]SENDER R,FUCHS S,MILO R.Are we really vastly outnumbered?revisiting the ratio of bacterial to host cells in humans[J].Cell,2016,164(3):337-340.
[7]WILSON A S,KOLLER K R,RAMABOLI M C,et al.Diet and the human gut microbiome:an international review[J]. Digest Dis Sci,2020,65(3):723-740.
[8]YADAV M,VERMA M K,CHAUHAN N S.A review of metabolic potential of human gut microbiome in human nutrition[J].Arch Microbiol,2018,200(2):203-217.
[9]SHEFLIN A M,MELBY C L,CARBONERO F,et al.Linking dietary patterns with gut microbial composition and function[J].Gut Microbes,2017,8(2):113-129.
[10]JÄGER R,MOHR A E,CARPENTER K C,et al.International society of sports nutrition position stand:probiotics[J].J Int Soc Sports Nutr,2019,16(1):62.
[11]HIEL S,BINDELS L B,PACHIKIAN B D,et al.Effects of a diet based on inulin-rich vegetables on gut health and nutritional behavior in healthy humans[J].Am J Clin Nutr,2019,109(6):1683-1695.
[12]JOHNSON A J,VANGAY P,AL-GHALITH G A,et al.Daily sampling reveals personalized diet-microbiome associations in humans[J].Cell Host Microbe,2019,25(6):789-802.
[13]董吉林,王雷.膳食纤维对肠道微生物及机体健康影响的研究进展[J].粮食与饲料工业,2019(1):36-40.
[14]DEEHAN E C,YANG C,PEREZ-MUÑOZ M E,et al.Precision microbiome modulation with discrete dietary fiber structures directs short-chain fatty acid production[J].Cell Host Microbe,2020,27(3):389-404.
[15]LOMBARD V,GOLACONDA RAMULU H,et al.The carbohydrate-active enzymes database(CAZy)in 2013[J].Nucleic Acids Res,2014,42:D490-D495.
[16]BARRETT K,HUNT C J,LANGE L,et al.Conserved unique peptide patterns(CUPP)online platform:peptide-based functional annotation of carbohydrate active enzymes[J].Nucl Acid Res,2020,48(W1):W110-W115.
[17]YE L,DAS P,LI P,et al.Carbohydrate active enzymes are affected by diet transition from milk to solid food in infant gut microbiota[J].FEMS Microbiol Ecol,2019,95(11):fiz159.
[18]MAKKI K,DEEHAN E C,WALTER J,et al.The impact of dietary fiber on gut microbiota in host health and disease[J].Cell Host Microbe,2018,23(6):705-715.
[19]KOH A,DE VADDER F,KOVATCHEVA-DATCHARYP,et al.From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J].Cell,2016,165(6):1332-1345.
[20]WANG K,LIAO M,ZHOU N,et al.Parabacteroides distasonis alleviates obesity and metabolic dysfunctions via production of succinate and secondary bile acids[J].Cell Rep,2019,26(1):222-235.
[21]VAN DE WOUW M,BOEHME M,LYTE J M,et al.Short-chain fatty acids:microbial metabolites that alleviate stress-induced brain-gut axis alterations[J].J Appl Physiol,2018,596:4923-4944.
[22]WANG S Z,YU Y J,ADELI K.Role of gut microbiota in neuroendocrine regulation of carbohydrate and lipid metabolism via the microbiota-gutbrain-liver axis[J].Microorganisms,2020,8(4):527.
[23]XIAO S,JIANG S,QIAN D,et al.Modulation of microbially derived shortchain fatty acids on intestinal homeostasis,metabolism,and neuropsychiatric disorder[J].Appl Microbiol Biotechnol,2020,104(2):589-601.
[24]SILVA Y P,BERNARDI A,FROZZA R L.The role of short-chain fatty acids from gut microbiota in gut-brain communication[J]. Front Endocrinol,2020,11:25.
[25]DALILE B,VAN OUDENHOVE L,VERVLIET B,et al.The role of short-chain fatty acids in microbiota-gut-brain communication[J].Nat Rev Gastroenterol Hepatol,2019,16(8):461-478.
[26]LUU M,MONNING H,VISEKRUNA A.Exploring the molecular mechanisms underlying the protective effects of microbial scfas on intestinal tolerance and food allergy[J].Front Immunol,2020,11:1225.
[27]LI Y J,CHEN X,KWAN T K,et al.dietary fiber protects against diabetic nephropathy through short-chain fatty acid-mediated activation of g proteincoupled receptors GPR43 and GPR109A[J].J Am Soc Nephrol,2020,31(6):1267-1281.
[28]DALILE B,VERVLIET B,BERGONZELLI G,et al.Colon-delivered short-chain fatty acids attenuate the cortisol response to psychosocial stress in healthy men:a randomized,placebo-controlled trial[J]. Neuropsychopharmacol,2020.https://doi.org/10.1038/s41386-020-0732-x.
[29]BYNDLOSS M X,OLSAN E E,RIVERA-CHÁVEZ F,et al.Microbiotaactivated PPAR-γ signaling inhibits dysbiotic Enterobacteriaceae expansion[J].Science,2017,357(6351):570-575.
[30]HU J,LIN S,ZHENG B,CHEUNG P C K.Short-chain fatty acids in control of energymetabolism[J].Crit Rev Food Sci Nutr,2018,58(8):1243-1249.
[31]NISHITSUJI K,XIAO J,NAGATOMO R,et al.Analysis of the gut microbiome and plasma short-chain fatty acid profiles in a spontaneous mouse model of metabolic syndrome[J].Sci Rep,2017,7(1):15876.
[32]JING Y,LI A,LIU Z,et al.Absorption of codonopsis pilosula saponins by coexisting polysaccharides alleviates gut microbial dysbiosis with dextran sulfate sodium-induced colitis in model mice[J].Biomed Res Int,2018,2018:1781036.
[33]SHARMA S,TRIPATHI P.Gut microbiome and type 2 diabetes:where we are and where to go?[J]J Nutr Biochem,2019,63:101-108.
[34]PASCALE A,MARCHESI N,GOVONI S,et al.The role of gut microbiota in obesity,diabetes mellitus,and effect of metformin:new insights into old diseases[J].Curr Opin Pharmacol,2019,49:1-5.
[35]BELIZÁRIO J E,FAINTUCH J,GARAY-MALPARTIDA M.Gut microbiome dysbiosis and immunometabolism:new frontiers for treatment of metabolic diseases[J].Med Inflamm,2018,2018:2037838.
[36]PERRY R J,PENG L,BARRY N A,et al.Acetate mediates a microbiomebrain-β-cell axis to promote metabolic syndrome[J].Nature,2016,534(7606):213-217.
[37]CRYAN J F,O'RIORDAN K J,COWAN C S M,et al.The microbiota-gutbrain axis[J].Physiol Rev,2019,99(4):1877-2013.
相关知识
肠道菌群及其代谢产物与妊娠期糖尿病相关性的研究进展
健康卫士—膳立方膳食纤维水适合哪些人群?
人肠道产甲烷菌与肠道健康
个体肠道菌群是精准营养干预代谢健康成功的基础
猫狗肠道菌群—“主子们”的健康新领域
Nature子刊:移植瘦子的肠道菌群,能够改善肥胖患者健康
必看!有关膳食纤维的5大传言
母亲肠道菌群和饮食习惯对新生儿生长发育的影响
Nature首次证实:节食会改变肠道菌群组成,增加致病菌
电磁辐射对人体健康影响的多组学研究进展
网址: 肠道菌群利用膳食纤维及其与人体健康关系研究进展 https://www.trfsz.com/newsview50714.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






