靶向代谢治疗,推动免疫治疗革命
 免疫检查点阻断 (immune-checkpoint blockade)和嵌合抗原受体 (chimeric antigen receptor, CAR) T细胞疗法的成功说明免疫系统具有卓越的抗肿瘤能力。在过去的几年中,人们已经越来越清楚地认识到,免疫细胞对肿瘤的反应主要依赖于其特有的代谢程序,这与免疫细胞类型和功能相关。肿瘤细胞和肿瘤微环境的代谢特征可限制免疫细胞代谢,使其转化为免疫抑制表型并阻断抗肿瘤反应。亚临床研究和临床研究的新进展都表明,代谢干预可以显著提高肿瘤免疫治疗的功效。2021年3月约翰霍普金斯医学院的Jonathan D. Powell和同事在《CANCER IMMUNOLOGY RESEARCH》上发表了题为《Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy》的综述,介绍了免疫代谢和免疫治疗的诸多方面,揭示了代谢靶向治疗在促进抗肿瘤免疫治疗方面的潜在功效。
免疫检查点阻断 (immune-checkpoint blockade)和嵌合抗原受体 (chimeric antigen receptor, CAR) T细胞疗法的成功说明免疫系统具有卓越的抗肿瘤能力。在过去的几年中,人们已经越来越清楚地认识到,免疫细胞对肿瘤的反应主要依赖于其特有的代谢程序,这与免疫细胞类型和功能相关。肿瘤细胞和肿瘤微环境的代谢特征可限制免疫细胞代谢,使其转化为免疫抑制表型并阻断抗肿瘤反应。亚临床研究和临床研究的新进展都表明,代谢干预可以显著提高肿瘤免疫治疗的功效。2021年3月约翰霍普金斯医学院的Jonathan D. Powell和同事在《CANCER IMMUNOLOGY RESEARCH》上发表了题为《Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy》的综述,介绍了免疫代谢和免疫治疗的诸多方面,揭示了代谢靶向治疗在促进抗肿瘤免疫治疗方面的潜在功效。  为了促使瘤体生长,肿瘤细胞启动了特有的代谢程序。这不仅有利于肿瘤细胞无限增殖,还可增强其免疫逃逸能力。肿瘤特有的代谢程序会形成缺氧、酸性、营养贫乏的肿瘤微环境 (tumor microenvironment, TME),这成为机体抗肿瘤免疫的巨大障碍。能够抑制免疫功能并促进肿瘤逃逸的免疫细胞非常适合在TME中生存。因此,靶向代谢治疗不仅可以抑制肿瘤生长,又可以改变TME,从而增强免疫治疗的效果。同时,它还提供增强抗肿瘤免疫反应的额外获益。
为了促使瘤体生长,肿瘤细胞启动了特有的代谢程序。这不仅有利于肿瘤细胞无限增殖,还可增强其免疫逃逸能力。肿瘤特有的代谢程序会形成缺氧、酸性、营养贫乏的肿瘤微环境 (tumor microenvironment, TME),这成为机体抗肿瘤免疫的巨大障碍。能够抑制免疫功能并促进肿瘤逃逸的免疫细胞非常适合在TME中生存。因此,靶向代谢治疗不仅可以抑制肿瘤生长,又可以改变TME,从而增强免疫治疗的效果。同时,它还提供增强抗肿瘤免疫反应的额外获益。 靶向肿瘤生长
在许多不同类型的肿瘤中,检查点阻断已被证明可通过内源性抗肿瘤免疫反应治疗肿瘤。也就是说,仅阻断一条抑制性通路 (阻断PD-1传递给T细胞的负信号),患者自身的抗肿瘤特异性T细胞就可以清除肿瘤细胞。但这种单剂药物治疗只在数量有限的患者中有效。部分原因是因为肿瘤的生长速度总是超过免疫反应的速度。因此,减缓肿瘤生长和缩小肿瘤体积可提高免疫治疗的有效性。
有鉴于此,肿瘤代谢靶向治疗是抑制肿瘤生长的有力手段。肿瘤细胞重新调整其代谢状态以促进合成和生长。为了迅速增殖,肿瘤细胞分别利用蛋白质、脂质、核酸来生长、形成细胞膜和转录翻译。在体细胞中,线粒体主要通过三羧酸循环 (tricarboxylic acid cycle, TCA) 氧化营养物质 (葡萄糖、氨基酸和脂肪酸),产生充足的ATP。然而,肿瘤细胞则通过上调糖酵解反应 (该反应产生乳酸,被称为Warburg physiology) 使其处于高合成代谢状态。也就是说即使在不缺氧的情况下,肿瘤细胞也可通过糖酵解来产生ATP,这样葡萄糖代谢更快,NAD+再生也更快。同时,糖酵解中间产物还可进入其他重要的代谢途径,如磷酸戊糖途径、单碳途径和己糖胺生物合成途径。这些代谢途径都有利于肿瘤细胞处于高水平的生长和增殖状态,但它们很容易被药物抑制。另外有研究表明,某些肿瘤可能会使用替代能源来产生能量,比如乳酸和支链氨基酸。有趣的是,许多传统的化疗药物,如甲氨蝶呤、6-硫嘌呤 (6-mercaptopurine, 6-MP ) 和5氟尿嘧啶 (5-fluorouracil, 5-Fu) 其实也是代谢抑制剂。目前,卡铂和培美曲塞联合抗PD-1已被证明治疗肺癌有效。虽然这些试验中药物的抗肿瘤功效被理解为是化疗药物和免疫疗法的协同作用,但更具指导意义的是,培美曲塞从根本上讲其实是一种抑制叶酸代谢和嘌呤嘧啶合成的代谢抑制剂。
改变肿瘤微环境
以代谢为靶向可以直接抑制肿瘤细胞的生长和增殖,从而提高免疫治疗的疗效。但肿瘤的代谢也对TME具有深远的影响。肿瘤细胞的高代谢活性,加上组织紊乱且功能失调的脉管系统,会导致TME内缺氧和营养消耗,使其中的肿瘤细胞和免疫细胞争夺氧气和营养。例如,肿瘤细胞的糖摄取和糖酵解可促进具有免疫抑制功能的髓系来源抑制细胞 (myeloid-derived suppressor cells, MDSC) 的浸润,并抑制肿瘤浸润淋巴细胞 (tumor-infiltrating lymphocytes, TIL)的抗肿瘤免疫应答。靶向肿瘤细胞糖酵解已被证明可以保护抗肿瘤T细胞的功能,并促进免疫检查点治疗应答。肿瘤基因组图谱数据显示,在己糖激酶2 (一种糖酵解限速酶)高表达的肿瘤中,免疫反应水平是降低的。另外,氨基酸也可以是肿瘤细胞和免疫细胞间代谢竞争的主要物质。有报告表明,肿瘤细胞高蛋氨酸摄取可导致抗肿瘤T细胞的表观遗传学改变和抗肿瘤功能受损。同时,有报道称卵巢肿瘤可以通过micro-RNA介导抑制甲基转移酶EZH2来影响T细胞的糖酵解和效应功能。另一项研究表明,TME缺氧可以诱导T细胞衰竭,因为它可以促使T细胞受体 (T-cell receptor, TCR)和PD-1信号背景下的线粒体动力学异常。除了剥夺免疫细胞必需的营养,肿瘤代谢还促进产生抑制免疫的代谢产物,如乳酸、活性氧 (reactive oxygen species, ROS)、鸟氨酸、聚胺、腺苷和胆固醇,它们均可抑制抗肿瘤免疫。因此,靶向肿瘤代谢可以通过创建一种更适合于抗肿瘤免疫反应的TME来增强免疫治疗。为此,目前一些试验正试图通过阻断外核酸酶CD73产生腺苷,同时阻断腺苷受体A2aR来强化免疫治疗。虽然初期试验失败,但人们仍然对通过抑制IDO1来阻止色氨酸的消耗和色尿氨酸的产生感兴趣。有研究证实,IL4I1 (interleukin-4-induced-1)可通过不依赖IDO1的内苷代谢物和犬尿喹啉酸的生成成为AHR (aryl hydrocarbon receptor)活性的关键激活因子。这可以解释IDO1特异性免疫治疗抑制剂临床试验失败的原因。
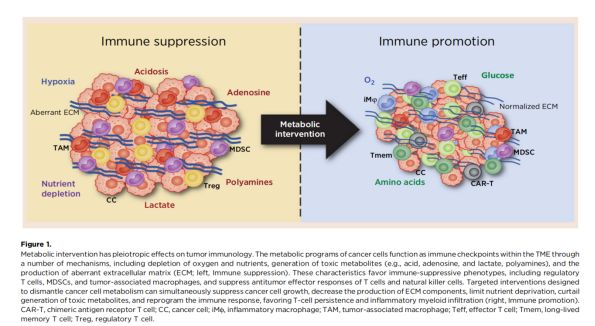
强化抗肿瘤T细胞
效应CD4+和CD8+T细胞是抗肿瘤免疫反应的关键执行者。在协同刺激下,这些细胞一旦被激活就会重新编程其代谢反应,支持细胞急速的生长和合成代谢。早期研究认为活化T细胞和处于增殖状态的T细胞与肿瘤细胞之间具有相似的代谢形式,被称为Warburg physiology。但必须注意,TCA和OXPHOS增加也很重要。肿瘤细胞和活化T细胞代谢间的相似性曾让人们担忧,靶向肿瘤代谢是否可能也抑制抗肿瘤T细胞。然而事实证明靶向肿瘤细胞代谢可强化抗肿瘤T细胞。事实上,虽然肿瘤细胞的代谢方式比较固定,但T细胞代谢是可塑的。研究表明,醋酸代谢可以消除CD8+效应T细胞的葡萄糖抵抗。例如,阻断谷氨酰胺代谢可以抑制肿瘤生长,但T细胞不受影响,因为它可以通过醋酸代谢获得碳。
有替代途径,靶向T细胞代谢仍可抑制其增殖和克隆扩张。使用糖酵解抑制剂2-脱氧葡萄糖 (2-deoxyglucose, 2-DG)、谷氨酰胺抑制剂DON和线粒体抑制剂二甲双胍的“三联疗法”可以抑制活化T细胞增殖和细胞因子产生,已被证明能有效防止排异反应。其实对任何单一途径的靶向抑制都很关键,例如效应器对再激发的反应以及对激活诱导的细胞死亡的抵抗力。使用糖酵解抑制剂2-DG可减少T细胞克隆性扩增。但它也使T细胞转化为较强大的长寿命记忆细胞。同样,抑制mTOR或AKT信号通路 (两者均能抑制肿瘤生长),可以强化抗肿瘤T细胞反应。
肿瘤的免疫逃逸也可呈现慢性非增殖性的抗原特异性激活形式。TME中的CD8+T细胞可处于功能低下状态,不能有效扩增并对肿瘤细胞产生足够的细胞毒性。有趣的是,T细胞的这种状态是由代谢失调决定的,其特点是PD-1上调、细胞因子产生失能以及mTOR信号传导缺乏糖酵解产能和合成代谢下降。其中PD-1信号通路可抑制PGC1α ( peroxisome proliferator activated receptor-γ coactivator 1α) 的表达,与正常效应T细胞相比,这种T细胞线粒体功能下降,氧化能力降低。以代谢为靶向可部分逆转这种表型并恢复细胞功能。
T细胞的一个重要亚型是调节T细胞 (regulatory T cells, Treg),它依赖于特殊的代谢程序,并且在抑制抗肿瘤免疫方面起着关键作用。这种抑制亚型是由FoxP3转录因子决定的,它可以通过抑制MYC重新编程代谢方式,使之转化为线粒体呼吸状态,即氧化磷酸化OXPHOS。与抗肿瘤效应T细胞不同,免疫抑制Tregs能适应TME内的代谢困境,抵抗乳酸诱导的功能和增殖抑制。有趣的是,以肿瘤内Tregs细胞CD36介导的脂质代谢为靶向可以破坏其在乳酸环境中的功能,并促进其抗肿瘤免疫反应。
强化ACT
目前,免疫检查点阻断和嵌合抗原受体(CAR)T细胞是临床批准的两大抗肿瘤免疫疗法。CAR-T细胞被批准用于治疗多种血液恶性肿瘤,在白血病和淋巴瘤患者中疗效显著。但这种方法受到两个方面的制约。首先,虽然最初反应较敏感,但被转染的细胞缺乏持久性,可导致肿瘤复发。其次,其在实体肿瘤中还没有表现出令人振奋的持久的反应。这两个问题都有待通过代谢治疗来解决。
经设计,CAR-T细胞可通过体外激活和扩张而产生,有助于代谢干预。例如,在糖酵解抑制剂作用下扩增的T细胞可以促进记忆细胞的产生,从而增强载瘤小鼠过继转移细胞的持久性和功能。同样,在体外呈递过程中抑制AKT信号可以促进与具有增强记忆相关的转录和代谢特征的T细胞的生成。在培养基中增加精氨酸或钾也可以促进长记忆细胞的生成。其他策略,如抑制乳酸脱氢酶 (lactate dehydrogenase, LDH)、有氧糖酵解中的关键酶、基于低线粒体膜电位的T细胞分选以及限制T细胞ROS代谢,都可以促进长寿命或类干细胞抗肿瘤T细胞的产生。
CAR-T是被基因修饰过的细胞,这使通过基因手段重新编程代谢成为可能。首先,随着线粒体和氧化代谢的增加,4-1BB信号结构域在促进中枢记忆T细胞 (central memory T, Tcm) 扩增方面,优于CD28信号结构域。因此,CAR本身的设计即可以重新编程细胞代谢方式。然而,进一步对T细胞进行基因修饰的策略也已被使用。例如,PCK1 (phosphoenolpyruvate carboxykinase 1) 可将草酰乙酸 (oxaloacetate, OAA) 转化为醇式丙酮酸 (phosphoenolpyruvate, PEP),过表达PCK1可提高过继转移T细胞的疗效。同样,在供体T细胞中强制过度表达PGC1α可使线粒体适应性增强,防止过继转移细胞的耗竭。使用药理学手段促进线粒体融合和抑制线粒体分裂,可增加线粒体质量、OXPHOS和备用呼吸容量,促进记忆细胞增殖,从而更好地控制过继转移T细胞。
虽然体外代谢干预很给力,但在ACT前或期间治疗患者也是一种有效的策略。即使过继转移细胞的疗效很强大,但不能与肿瘤细胞接触也无法发挥作用。当TME不友好时,抗肿瘤T细胞无法正常发挥效力。为此,在CAR-T治疗中加入代谢疗法会提高其治疗实体瘤的成功率。事实上,代谢治疗可抑制肿瘤生长并调控TME,使其在细胞呈递期间更有利于抗肿瘤免疫反应。ACT后用代谢治疗对过继转移细胞有强化作用。抑制某些代谢靶点,如谷氨酰胺代谢、糖酵解、mTOR和AKT,可以促进长寿命T细胞记忆。因此,即使在接受ACT治疗后,继续使用谷氨酰胺代谢抑制剂,也能既抑制肿瘤生长,又促进过继转移细胞的长寿命记忆。
“论肿道麻”述评
免疫检查点阻断 和 CAR- T 治疗的成功已经彻底 颠覆了肿瘤 治疗 的方式 。 肿瘤患者 可通过内源性 ( 免疫检查点阻断 ) 和外源性 ( ACT ) 抗肿瘤免疫反应 得以 治愈。尽管这些 治疗疗法的 成功 很振奋人心 , 但 未来 仍有待对 敏感患者 深入 免疫治疗, 并在不敏感 的肿瘤 类型中进一步拓展其应用 。 以 肿瘤 和 免疫代谢 为靶点的代谢疗法将有望快速实现 这些目标。 事实上, 培美曲塞在非小细胞肺癌 ( non–small cell lung cancer , NSCLC ) 免疫治疗中的应用 已经 开始。具体而言,靶向代谢 有潜力 增强 NSCLC 、 黑色素瘤 、 肾细胞肿瘤和其他 肿瘤免疫 检查点 阻断 疗法 的有效性 。 而 对于前列腺肿瘤、乳腺肿瘤、胰腺肿瘤 这些 免疫治疗 效果不显著 的肿瘤,靶向代谢 有望 改变 TME 并促进 免疫 细胞 浸润,将这些耐药性肿瘤转化为 敏感型 肿瘤。 同时 ,代谢疗法有 望 促进 CAR-T 疗法 在 实体肿瘤 中的 应用 ,并通过 增强过继转移 细胞的持久性, 提高 这种方法的整体有效性。编译:盖晓冬;述评:翁梅琳
审校:张军,缪长虹
参考文献: Leone RD, Powell JD. Fueling the Revolution: Targeting Metabolism to Enhance Immunotherapy. Cancer Immunol Res. 2021 Mar;9(3):255-260. doi: 10.1158/2326-6066.CIR-20-0791. PMID: 33648947; PMCID: PMC8240594. 声明:古麻今醉公众号为舒医汇旗下,古麻今醉公众号所发表内容之知识产权为舒医汇及主办方、原作者等相关权利人所有。未经许可,禁止进行转载、摘编、复制、裁切、录制等。经许可授权使用,亦须注明来源。欢迎转发、分享。本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
银屑病治疗新突破!生物制剂与小分子靶向药最新梳理
治疗癌症的CAR-T疗法,是否对免疫疾病也有效果?
mRNA疗法:肿瘤免疫治疗的新曙光?
阿尔茨海默病新兴疗法——靶向 Aβ 疾病修饰治疗
免疫细胞疗法全攻略:解锁12大常见疑问,一次讲透!
国内百万人或将摆脱秃顶困境,治疗重度斑秃创新靶向药获批
智能医疗革命:智慧医疗行动方案揭秘
CAR不止于肿瘤治疗,CAR在感染性疾病和自身免疫疾病的新发展
精准狙击你的脂肪!打一针,即可有效减重,肥胖靶向治疗将迎来“纳米时代”
阿尔茨海默病治疗又一新靶点被发现,未来将有全新治疗策略
网址: 靶向代谢治疗,推动免疫治疗革命 https://www.trfsz.com/newsview58083.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3880
- 2早上怎么喝水最健康? 3664
- 3习惯造就健康 影响健康的习惯 3311
- 4五大原因危害女性健康 如何保 3219
- 5连花清瘟、布洛芬等多款感冒药 2975
- 6男子喝水喉咙里像放了刀子一样 2469
- 710人混检核酸几天出结果?1 2233
- 8第二轮新冠疫情要来了?疾控中 2232
- 9转阴多久没有传染性?满足四个 2167
- 10补肾吃什么 补肾最佳食物推荐 2166






