综述丨吉林农大: 益生菌对饮食诱导的脂质代谢紊乱的改善作用(国人佳作)
编译:微科盟噗噗,编辑:微科盟居居、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
高脂饮食引起的脂质代谢紊乱已成为严重的公共卫生问题之一,并在世界范围内造成了严重的经济和社会负担。从自然界分离的安全益生菌被认为是预防和改善饮食诱导的脂质代谢紊乱和相关慢性疾病的一种新的补充策略。本文综述了益生菌在高脂饮食诱导的脂质代谢紊乱中的最新研究进展,旨在为益生菌的调节功能研究提供参考。此外,还概述了降脂益生菌的筛选标准和一般来源,以迅速扩大微生物物种资源库,促进天然降脂菌功能性食品的开发。通过对益生菌在体外、体内甚至人体临床数据的回顾,我们提出了益生菌激活AMPK信号通路,调节脂肪合成和分解,并积极影响肠道菌群结构、肠道屏障功能和全身炎症反应,这些有益作用沿肠-肝轴放大。通过HMGCR/FXR/SHP信号通路调节肠道菌群代谢物(如SCFAs和BAs),从而有效改善高脂饮食引起的脂质代谢紊乱。
论文ID
原名:The ameliorative effect of probiotics on diet-induced lipid metabolism disorders: A review
译名:益生菌对饮食诱导的脂质代谢紊乱的改善作用
期刊:Critical Reviews in Food Science and Nutrition
IF:11.208
发表时间:2022.10
通讯作者:王玉华,刘景圣
通讯作者单位:吉林农业大学食品科学与工程学院
DOI号:10.1080/10408398.2022.2132377
综述目录
1 前言 2 具有降脂能力的益生菌 3 益生菌调节HFD导致的脂质代谢紊乱的机制 3.1 益生菌对脂质代谢相关信号通路的调节作用 3.2 益生菌调节肠道菌群及其代谢产物改善脂质代谢紊乱 3.3 益生菌通过调节肠-肝轴改善脂质代谢紊乱 4 结语
主要内容
1 前言
长期高脂饮食(HFD)由于摄入过量饱和脂肪酸导致脂质代谢紊乱,其特征是血浆高密度脂蛋白胆固醇(HDL-C)水平降低,体内甘油三酯(TG)、总胆固醇(TC)和低密度脂蛋白胆固醇(LDL-C)浓度升高。近年来,有研究报道表明,脂质代谢紊乱的发生常伴有高脂血症、肥胖症、2型糖尿病、高血压和心血管疾病(CVDs)。根据世界卫生组织发布的最新统计报告,随着人口老龄化,慢性疾病成为越来越多人的主要健康风险。2000-2019年期间,全球所有年龄组的四种主要慢性病包括糖尿病、心血管疾病、癌症和慢性呼吸道疾病。从全球来看,自2000年以来,心血管疾病和糖尿病导致的死亡人数分别增加了25%和72%,2019年迅速达到1700万和200万。报告还指出,2000-2016年,年龄标准化的成年人肥胖患病率(BMI > 30 kg/m2)从8.7%上升至13.1%,2016年有6.5亿肥胖人群,27.5%的成年人运动不足。与此同时,全球高血压年龄标准化患病率(上压>140 mmHg或下压>90 mmHg)为22.1%(世卫组织2021年)。由此可见,由脂质代谢紊乱引起的亚健康人群比例日益增加,给世界带来了巨大的经济和社会压力,成为当代健康领域面临的重大挑战。 临床上,他汀类药物、胆汁酸结合树脂、烟酸、贝特类药物和ω-3多不饱和脂肪酸等化学合成药物被广泛用于预防血脂异常,但由于昂贵的治疗成本和严重的副作用,如患者出现腹泻、恶心、肌炎和肝功能异常,无法达到预期效果。因此,人们越来越需要科学的营养策略来调节脂类代谢紊乱。世界卫生组织将益生菌定义为适量给予宿主有益于健康的活微生物。近年来,益生菌在肠道健康、免疫系统、高血压、高脂血症、肥胖和糖尿病等方面的有益作用被广泛报道。相应地,消费者开始敏锐地意识到饮食对健康的有利影响,这导致益生菌成为增长最快的功能性食品领域,预计到2022年市场上的销售额将达到640.2亿美元。益生菌作为一种低成本、高安全性的功能性食品,在慢性病医疗费用不断上涨的特殊背景下,已发展成为一种预防或改善饮食引起的脂质代谢紊乱的创新策略,因此有必要阐明益生菌调节饮食诱导的脂质代谢紊乱的机制。
本文就益生菌对脂质代谢紊乱的潜在作用机制的研究现状进行了综述。同时,也为利用天然降脂菌株开发功能食品提供理论依据。
2 具有降脂能力的益生菌 益生菌作为一种活菌类型,因其对宿主具有多种促进健康的功能而受到越来越多的关注,因此,世界各国都在努力从当地天然和传统产品中分离益生菌菌株。益生菌的特性鉴定可采用各种各样的试验,根据联合国粮食及农业组织(FAO)/世卫组织工作组的意见,主要有以下试验:(i)对胃肠酸的耐受性;(ii)胆汁酸抗性;(iii)胆盐水解酶(BSH)活性;(iv)对粘液或上皮细胞系的粘附;(v)抗菌活性;(vi)抑制病原体的能力。除上述基本试验外,分离降脂益生菌还有特殊要求。通常情况下,当个体中胆固醇和脂肪酸浓度较高时,脂肪就会积聚,因此,清除胆固醇的能力被认为是体外分离降脂益生菌的必要测试。另一方面,3T3-L1前脂肪细胞和HepG2细胞是从细胞和分子水平进一步研究益生菌调节脂质代谢紊乱机制的适用细胞系。还值得注意的是,粮农组织/世卫组织联合工作组应先使用动物模型,然后进行人体试验,以证实益生菌对人类使用的有效性。
最近,一些益生菌包括Lactobacillus plantarum、L. sakei、L. fermentum、L. rhamnosus、L. acidophilus、L. paracasei、L. sakei、Pediococcus pentosaceus和Bifidobacterium被证实可以通过改善脂质和糖代谢、抑制代谢性炎症、调节肠道菌群的内稳态和代谢物来缓解饮食引起的脂质代谢紊乱(表1)。脂肪组织过度积累已被证明与代谢健康效应相关,因此,抑制脂肪细胞增殖和分化有助于预防哺乳动物的食欲、体重增加、高脂血症、肥胖和2型糖尿病。在3-异丁基-1-甲基黄嘌呤、地塞米松和胰岛素(MDI)的刺激下,3T3-L1前脂肪细胞分化为含有脂滴的成熟脂肪细胞,而L. fermentum MG4231、L. fermentum MG4244和L. plantarum(LP、LSL14)菌株处理后,3T3-L1脂肪细胞内甘油三酯的产生减少了50%以上。同时,MG4231和MG4244菌株对上皮细胞具有良好的粘附性,与HT-29细胞的结合率分别为3.35±0.33%和4.00±1.40%。此外,L. acidophilus NX2-6可以降低油酸诱导的HepG2细胞脂肪变性中高水平的TG、LDL-C、LDH和MDA。在油酸和胆固醇诱导的HepG2细胞模型中,L. casei LC2W和L. plantarum AR113已被证实能降低3-羟基-3-甲基戊二酰-辅酶A还原酶(HMGCR) mRNA的表达。值得注意的是,L. plantarum AR113和L. casei LC2W似乎都能在体外以BSH依赖性方式改善脂肪变性。
表1 益生菌菌株对脂质代谢紊乱及相关疾病的影响。
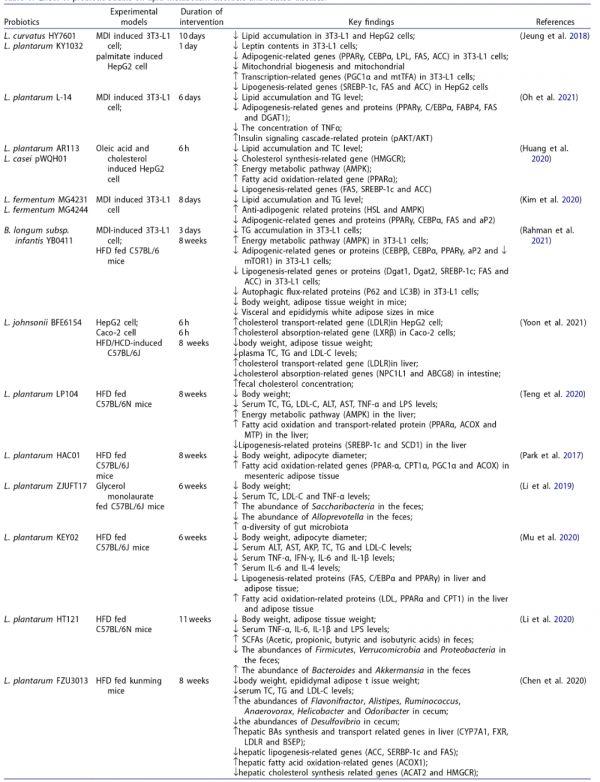

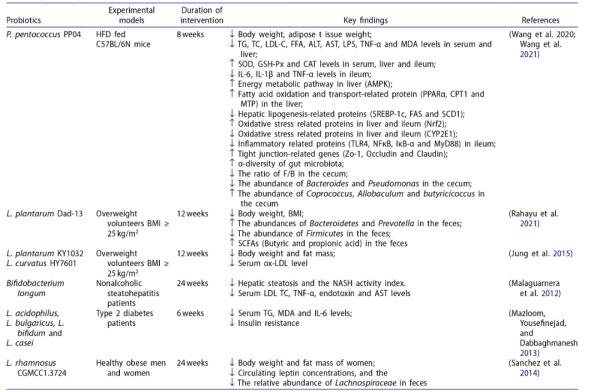
此外,许多益生菌,包括L. plantarum LC27、Bifidobacterium longum LC67、L. rhamnosus BFE5264、P. pentosaceus KID7和L. plantarum YS5通过调节小鼠血清和肝脏中的脂质分布(包括TC、TG、LDL-C和HDL-C)来抑制饮食诱导的脂质代谢紊乱。其中,从小米发酵中分离得到的P. pentosaceus KID7具有去结合牛磺酸脱氧胆酸(TDCA)、甘氨胆酸(GCA)和牛磺胆酸(TCA)的BSH活性,并在添加500 µg/ml胆固醇的Man-Rogosa-Sharpe培养基中观察到胆固醇浓度下降了40%。从自制酸奶中分离到的L. plantarum YS5具有较强的耐酸和胆汁胁迫能力、抗菌活性和生长细胞对胆固醇的高去除能力(84%)。同样,从发酵乳饮料中筛选出Enterococcus faecium WEFA23和L. fermentum SM-7,它们的胆固醇去除能力可以降低HFD诱导小鼠的体重、胰岛素抵抗和动脉粥样硬化指数。这些结果表明,BSH活性和降胆固醇能力对于筛选具有降脂能力的益生菌是必不可少的,这在与脂质代谢紊乱相关的细胞和动物模型中得到了广泛的验证。 不仅有越来越多的证据表明益生菌在细胞和动物试验中对脂质代谢紊乱具有调节作用,而且现有的人体数据也显示益生菌对与肥胖脂肪生成相关的代谢性疾病具有改善作用。在一项随机、双盲和安慰剂对照研究中,60名BMI ≥ 25 kg/m2 的超重志愿者服用L. plantarum Dad-13(2×109 CFU/克/小袋) 90天,其中L. Plantarum Dad-13导致平均体重分别从84.54±17.64 kg下降至83.14±14.71 kg和33.10±6.15 kg/m2下降至32.57±5.01 kg/m2。有趣的是,粪便菌群分析表明,在L. plantarum Dad-13处理组中,拟杆菌,特别是Prevotella的相对数量显著增加,而厚壁菌门的相对数量则大幅减少。另一个可比较的发现是,L. rhamnosus CGMCC1.3724可显著降低脂肪量、循环瘦素水平和粪便中毛螺菌科(Lachnospiraceae)的相对丰度,从而诱导女性体重减轻。多项研究也证实,在血脂代谢障碍志愿者的不同临床试验中,L. plantarum KY1032、L. curvatus HY7601、L. acidophilus、L. bulgaricus、L. bifidum和L. casei抑制体重、脂肪量和血脂的增加。 然而,自然界中降脂益生菌的一般来源在哪里?在过去十年中,花卉、生蔬菜和水果作为具有促进健康特性的益生菌物种的来源吸引了更多的关注。此外,如图1所示,值得注意的是,自然发酵食品已被探索为分离有益于调节脂类代谢紊乱的益生菌菌株的有利来源,其中一些选定菌株可表现出与微生物群调节、低胆固醇血症、高血脂、低血糖和肥胖相关的重要健康影响。然而,这些降脂益生菌对脂质代谢紊乱的具体调节机制尚未完全总结,我们就此进行详细的综述。
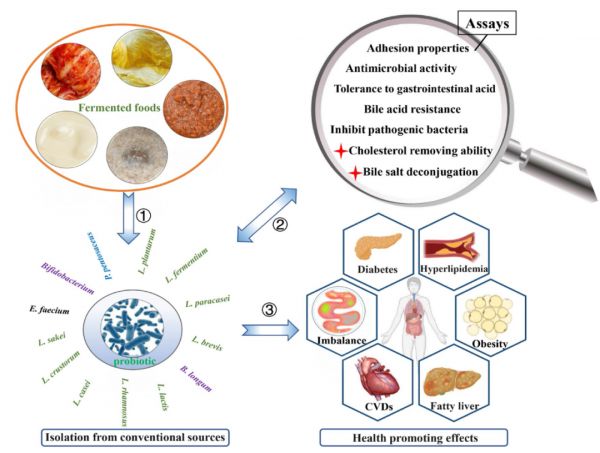
图1 从常规来源中分离具有降脂能力的益生菌。①从天然发酵食品(泡菜、东北酸菜、虾酱、黄酒、酸奶等)中分离出具有降脂能力的益生菌;②通过包括降胆固醇、降胆盐等必不可少的筛选试验,筛选出具有降脂能力的益生菌。③以往研究报道中具有降脂能力的益生菌对饮食诱导的脂质代谢紊乱有改善作用。
3 益生菌调节HFD导致的脂质代谢紊乱的机制
3.1 益生菌对脂质代谢相关信号通路的调节作用 脂肪生成和分解在正常生理条件下维持相对的动态平衡,而过度的HFD是导致这种平衡失调的主要原因,这可能会导致脂代谢紊乱。研究表明,肝脏作为调节脂代谢的中枢器官,与HFD引起的血脂水平、脂质合成和分解密切相关。5´-腺苷单磷酸活化蛋白激酶(AMPK)作为参与脂质代谢的细胞内能量感受器,在肝脏中大量表达,可以监测细胞的能量状态,调节脂肪酸的合成和氧化,合成和转化胆固醇。然而,HFD可以通过靶向各种产脂和脂解相关基因来使AMPK失活,从而导致脂肪在体内过度积累。 近年来,AMPK信号通路在益生菌调节HFD诱导的脂质代谢紊乱方面做出了突出贡献。例如,从东北酸菜中分离的P. pentococcus PP04和L. plantarum LP104可以通过激活AMPK信号通路显著抑制乙酰CoA羧化酶(ACC)活性,下调固醇调节元件结合蛋白-1(SREBP-1)、脂肪酸合成酶(FAS)和硬脂酰辅酶A去饱和酶(SCD)的表达,从而直接抑制脂类合成。此外,TG从肝脏延迟转运也会导致脂质沉积,PP04显著增加微粒体甘油三酯转移蛋白(MTP)的表达。同时,AMPK激活后可触发过氧化物酶体增殖物激活受体α(PPARα),通过增强下游的肉碱棕榈酰转移酶-1(Cpt1)和酰基辅酶A氧化酶(Acox)的表达来促进线粒体脂肪酸β氧化,而L. plantarum HAC01通过增加CPT1和ACOX的表达来改善肥胖。 来自大米发酵饮料的MKK4,其主要通过上调脂质转录因子(包括PPARα和PPARδ)发挥抗肥胖作用。GPR43是参与脂肪细胞脂质代谢的G蛋白偶联受体(GPRs)的重要成员,在3T3-L1细胞和HFD喂养的小鼠中,GPR43蛋白水平在B. animalis subsp. lactis A6给药后均显著升高。GPR43的激活可能通过Ca2+/CAMKK途径调节AMPK活性,BAA6通过靶向GPR43/AMPK信号通路产生丰富的乙酸激活PPARα,促进脂肪酸氧化。 HFD诱导的大量甘油三酯在肝脏中合成,分泌到血液中,并运输到包括脂肪组织在内的外周器官。同时,HFD通过促进脂肪细胞的增殖和分化,破坏能量摄入和消耗的失衡,导致脂肪组织过度沉积。CCAAT/增强子结合蛋白β和δ(C/EBPβ和C/EBPδ)基因在分化的早期阶段被激活,然后C/EBPα和PPARγ在脂肪形成的后期被介导表达。脂蛋白脂肪酶(LPL)、脂肪细胞特异性脂肪酸结合蛋白(aP2)、FAS和ACC等下游靶基因通过激活C/EBPα和PPARγ来调节脂质积累。因此,抑制脂肪细胞分化可以预防肥胖及其相关疾病。有趣的是,一些研究表明,益生菌直接调节脂肪细胞的积累。L. curvatus HY7601和L. plantarum KY1032的混合物通过降低3T3-L1细胞中PPARγ、C/EBPα、LPL和FAS的表达来抑制瘦素的分泌,表明益生菌通过抑制脂肪生成对肥胖和相关代谢疾病有效。脂肪细胞特异性分泌瘦素,瘦素是一种激素,通过对中枢神经系统靶点的作用调节食物摄入和能量消耗之间的平衡。值得注意的是,高循环浓度的瘦素会抑制AMPK信号的激活。最近的一项研究表明,B. longum subsp.infantis YB0411通过激活AMPK、抑制mTOR1信号转导途径,降低C/EBPβ、C/EBPδ和aP2的表达,从而有效地抑制小鼠脂肪形成和高脂诱导的肥胖。据报道,AMPK的磷酸化抑制mTOR1功能,通过直接抑制PPARγ的表达水平来限制mTOR1介导的脂肪生成。L. fermentum MG4231和MG4244对脂质积聚的抑制作用是通过增强3T3-L1前脂肪细胞中AMPK信号通路介导的激素敏感脂肪酶(HSL)活性的磷酸化来调节的。HSL和脂肪甘油三酯脂肪酶(ATGL)是主要的限速酶,ATGL催化甘油三酯水解主要生成二酰甘油,HSL具有DG脂肪酶的功能,但HSL和ATGL都可以被AMPK修饰。L. paracasei 1 F-20、L. fermentum F40-4和B. animalis subsp.lactis F1-7下调了SREBP-1c和PNPLA3基因的表达,从而改善了HepG2细胞2型糖尿病。PNPLA3是马铃薯糖蛋白磷脂酶家族的重要成员,可直接通过易感基因SREBP-1介导。相对于HFD喂养的小鼠,L. plantarum MTCC5690和L. fermentum MTCC5689处理通过增加空腹诱导脂肪细胞因子(FIAF)基因的表达,降低了系统TG水平,并且FIAF已被证明可以拮抗LPL,LPL通过阻止TG以脂肪形式储存在调节脂质代谢中发挥重要作用。在另一项研究中,B. longum通过增加细胞内和肠道内FIAF的水平(分别为47.16±20.23%和83.15±17.51%)来改善肥胖,从而抑制LPL活性(10.01±5.14%)和TG储存(30.68±9.80%)。 此外,值得注意的是,除了活菌外,还有几种热杀菌对饮食诱导的脂质代谢紊乱具有潜在的抑制作用。L. reuteri GMNL-263活菌和死菌通过显著降低血糖、胰岛素、低密度脂蛋白胆固醇/高密度脂蛋白胆固醇、甘油三酯和总胆固醇,对高脂血症小鼠的代谢综合征有相似的改善作用,其机制可能是通过显著降低肝脏中促脂基因SREBP-1c、FAS和碳水化合物反应元件结合蛋白(ChREBP)的表达来抑制肝脏脂质堆积。此外,将热灭活的S. thermophilus口服给药于喂食HFD的糖尿病大鼠模型,其通过降低空腹血糖水平、改善葡萄糖耐受不良和血清总胆固醇显示出缓解作用。图2总结了一些观察结果,强调了一些降脂益生菌在脂肪酸氧化和脂肪生成过程中的调节作用。
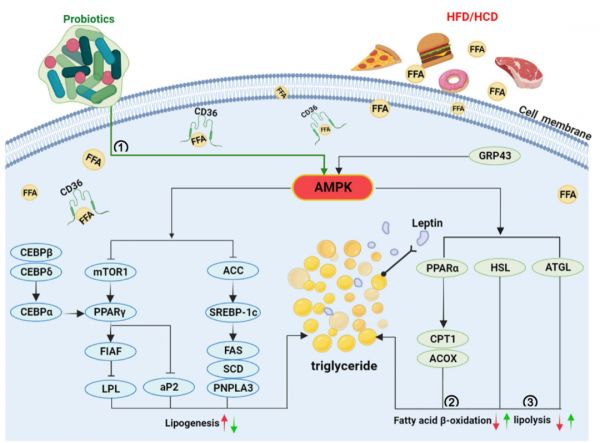
图2 益生菌通过调节脂肪生成/脂肪分解相关的信号通路改善饮食诱导的脂代谢紊乱的机制。i 益生菌激活AMPK,继而触发ACC、SREBP-1、FAS和SCD1抑制脂肪生成。C/EBPβ和C/EBPδ基因控制成脂分化的早期阶段,C/EBPα和PPARγ参与成脂分化的晚期阶段,AMPK的磷酸化抑制了mTOR1,mTOR1通过抑制PPARγ的表达水平来限制脂肪形成。FIAF作为PPARγ的下游靶基因,通过抑制LPL活性降低甘油三酯的积累。ii 激活AMPK可增强PPARα的表达,从而增加CPT1和ACOX的表达,促进脂肪酸β氧化。iii HSL和ATGL被认为是经典的脂解调节因子,通过使用益生菌来抑制脂肪堆积。红色箭头:高脂饮食或高胆固醇饮食促进或抑制这些活动。绿色箭头:益生菌促进或抑制的活动。
3.2 益生菌调节肠道菌群及其代谢产物改善脂质代谢紊乱
3.2.1 益生菌对肠道菌群的调节作用
人类肠道菌群是一个复杂的生态系统,由大约1-2 kg的微生物组成,其中包括至少数千种不同的细菌种类,这些细菌与健康和疾病的各个方面密切相关。HFD作为一种不均衡的饮食,会导致多种代谢紊乱,包括胰岛素抵抗、2型糖尿病、高脂血症和肥胖,这些都与肠道菌群失调密切相关。这是由于肠道菌群失衡可能促进膳食能量提取、脂肪合成和脂肪组织分化。肠道中存在的细菌种类大多属于厚壁菌门、拟杆菌门、变形菌门和放线菌门;优势种属于肠杆菌科(Enterobacteriaceae)、Bacillaceae、Bacteroidaceae和Corynebacteriaceae。以往的研究表明,肥胖和相关的代谢性疾病与厚壁菌门相对丰度的增加有关,而拟杆菌门的减少则导致了人类和动物模型中厚壁菌门/拟杆菌门比值的升高。然而,在细菌种水平上观察到的个体间微生物群落组成的变化比在门水平上大得多。Parabacteroides、脱硫弧菌属(Desulfovibrio)、Blautia、卟啉单胞菌属(Porphyromonas)、Staphylococcus Alloprevotella和梭菌属(Clostridium)的相对丰度在脂质代谢紊乱的个体中普遍存在。此外,与肥胖个体相比,属水平上乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)、丁酸弧菌属(Butyrivibrio)、粪球菌属(Coprococcus)、阿克曼菌属(Akkermansia)、瘤胃球菌属(Ruminococcus)、粪杆菌属(Faecalibacterium)、Methanobrevibacter和Vampirovibrio的相对丰度在瘦人表型中大量存在。 研究证实,益生菌、益生元和粪便菌群移植都能对肠道菌群失调起到有益的调节作用,其中益生菌因其对健康的调节作用,作为功能食品或膳食补充剂而受到越来越多的关注。与单月桂酸甘油诱导的C57BL/6J小鼠相比,食用L. plantarum ZJUFT17可显著提高肠道菌群α多样性,抑制小鼠的体重增长和血脂水平,而且Alloprevotella丰度的升高和Vampirovibrio丰度的降低表明L. plantarum ZJUFT17能有效地改善肠道菌群失调。其中,α-多样性指数主要包括Chao1、Observed species、Shannon和Simpson,用于反映单个宿主中微生物物种的丰富度,而细菌丰富度的衰减与饮食诱导的脂质代谢紊乱有关。相应地,从传统红曲米酒中分离出一株名为L. paracasei FZU103的益生菌,它增加了HFD诱导小鼠中Pseudoflavonifractor、Ruminococcus和Helicobacter的相对丰度,但显著降低了葡萄球菌属(Staphylococcos)、Blautia和Tannerella的水平。在HFD诱导的实验模型中,L. fermentum CECT5716的减肥作用与改善高脂饲料诱导的小鼠肠道菌群失调有关,它不仅恢复了拟杆菌属(Bacteroides)和阿克曼菌属(Akkermansia)的丰度,而且还降低了Erysipelotrichi和Clostridium的比例,因此与正常饲料喂养的小鼠相比,L. fermentum CECT5716显著提高了α-多样性指数。 大量益生菌被证明可以抑制条件致病菌的生长,并增强有益共生菌的增殖,以平衡肥胖个体的肠道菌群组成。如上所述,粘附能力是益生菌菌株最关键的筛选标准,已经提出益生菌粘附在上皮细胞或粘液上以保护宿主免受病原体损害。例如,益生菌可以与包括大肠杆菌(Escherichia coli)、艰难梭菌(Clostridium difficile)、Listeria monocytogenes、Salmonella Choleraesuis、Clostridium histolyticum和金黄色葡萄球菌(Staphylococcus aureus)在内的致病菌竞争上皮连接位置,以减少这些细菌的肠道丰度。此外,P. pentosaceus PP04对Caco-2细胞具有79.06 ± 0.39%的高粘附能力,通过在盲肠定殖后正向改变包括拟杆菌属、假单胞菌属(Pseudomonas)、粪球菌属(Coprococcus)、Allobaculum和Butyriccoccus在内的肠道菌群组成来改善HFD诱导的高脂血症。这些结果强调了益生菌可以通过调节肠道菌群的组成和多样性来改善饮食引起的脂代谢紊乱。
3.2.2 益生菌对短链脂肪酸的调节作用
总体而言,短链脂肪酸(SCFAs)是肠道菌群通过消化膳食纤维、抗性淀粉等难以消化的碳水化合物而产生的最丰富的代谢物,在健康人肠道中主要由乙酸、丙酸和丁酸组成,摩尔比为3:1:1,占肠道中SCFAs总含量的>95%。结肠近端SCFAs总浓度约为70-140 mmol/L,向远端逐渐降低。大量生理和临床研究表明,SCFAs对健康有广泛的益处,包括改善体重、葡萄糖稳态和血脂状况。然而,HFD通过抑制专门产生SCFAs的肠道菌群(Faecalibacterium、Butyrivibrio、Akkermansia muciniphila、Bifidobacterium、Eubacterium和Lactobacillus)的生长,显著降低了SCFAs水平。同时,SCFAs对肠道内分泌细胞释放的胰高血糖素样肽1和肽2(GLP-1和2)、 胃饥饿素、胃泌酸调节素(OXM)、肽YY(PYY)和胆囊收缩素(CCK)等一系列激素具有调节作用,可以控制食欲和机体能量稳态。因此,益生菌干预是改善肥胖及其相关代谢共病的另一种途径,通过调节HFD引起的肠道菌群失衡,从而增强SCFAs的分泌,抑制食欲。 有趣的是,L. crustorum MN047和L. rhamnosus LS-8降低了脱硫弧菌属和拟杆菌属的丰度,并增加了乳杆菌(Lactobacillus)和双歧杆菌(Bifidobacterium)的丰度,以刺激丙酸、丁酸和异丁酸的产生。VSL#3益生菌混合物通过减少厚壁菌门和增加拟杆菌门与双歧杆菌的丰度来调节肠道菌群组成,以促进大量丁酸盐的产生,从而促进肠道内分泌细胞分泌GLP-1,预防肥胖和糖尿病。同样,补充B. breve BR03和B632菌株可以增加乳杆菌的丰度,促进GLP-1的分泌,改善肥胖青少年的胰岛素敏感性。同样,L. mali APS1干预改变了肥胖相关细菌的丰度,导致丙酸和丁酸浓度升高,促进PYY和胰腺多肽的分泌,增加能量消耗,抑制食欲。此外,B. BlaG、L. plantarum HT121、L. fermentium MTCC5689、L. crustorum MN047、L. rhamnosus LS-8和BFE5264还通过调节Bifidobacterium、Lactobacillus或Akkermansia的丰度,显著提高乙酸、丙酸、丁酸或异丁酸等SCFAs浓度,有效调节HFD诱导的小鼠脂质代谢紊乱。但这些研究尚未进一步研究上述益生菌对肠道衍生激素的影响。 SCFAs通过GPRs(称为GPR43和GPR41)产生一些生物学效应,SCFAs和GPRs的组合刺激下游肠道激素(主要是GLP-1和PYY)的分泌。与上述结果一致,Lactobacillus G15和Q14通过激活SCFAs显著增加GPR43的表达,通过有效促进GLP-1和PYY的分泌来减轻体重。因此,SCFAs在调节脂质和葡萄糖代谢中起关键作用,这对能量稳态具有重要意义,通常,GPR43对乙酸盐和丙酸盐比对丁酸盐更敏感,而GPR41同样被丙酸盐和丁酸盐激活。先前的一项研究表明,血浆乙酸盐浓度因B. animalis subsp. lactis GCL2505激活GPR43调节胰岛素信号传导而增加,从而增强宿主能量消耗并抑制体内脂肪积累。 HFD的消化伴随着胰岛素抵抗,从而扰乱能量和葡萄糖代谢。抑制肠道α-葡萄糖苷酶的活性可以防止复杂的碳水化合物水解成葡萄糖,从而降低体内的葡萄糖水平。L. plantarum LRCC5314、L. plantarum ZF06-1和L. brevis IF2-17具有抑制猪肠道α-葡萄糖苷酶活性的能力,这可能是调节葡萄糖稳态的潜在益生菌。L. plantarum HAC01通过AMPK/AKT信号通路显著降低包括PEPCK和G6Pase在内的与糖异生相关的肝脏基因的表达水平,从而改善糖尿病,这可能是由升高的血清丁酸水平激活的。因此,SCFAs作为可被肠道直接吸收的能量,是益生菌调节HFD引起的脂质代谢紊乱的重要靶点。
3.2.3 益生菌对胆汁酸代谢的调节作用
胆汁酸(BAs)作为肠道微生物的初级代谢产物,通过调节糖脂代谢、能量消耗和胃肠道对脂肪的吸收,在HFD诱导的脂质代谢紊乱的发病机制中发挥重要作用。BAs的合成是以肝脏中的胆固醇为原料,因此,在肠道菌群及其代谢物与此类饮食引起的脂代谢紊乱之间的复杂相互作用中,胆固醇稳态受到越来越多的重视。人体内的胆固醇分为两部分,其中约三分之一是“外源性”胆固醇,主要来自饮食中的蛋类、红肉等动物产品,其余三分之二是人体内合成的内源性胆固醇。然而,过量消化富含饱和脂肪酸和胆固醇的饮食会导致高脂血症,从而加速心血管疾病的发展。 一般情况下,当摄入过量HFD时,转录因子SREBP-2被激活并与固醇调节元件结合,促进HMG-CoA还原酶(HMGCR)的表达,而HMGCR是胆固醇重新生物合成的主要限速酶。在正常生理条件下,肝脏X受体(LXR)作为一种胆固醇受体,可以抑制调节肠道胆固醇重吸收的NPC1L1,LXR还可促进下游靶基因包括ATP结合盒转运体G5(ABCG5)、G8(ABCG8)等异二聚体的表达,有效加速粪便中胆固醇的排出。但HFD破坏了肠道胆固醇吸收和排泄调节的不平衡。同时,HFD导致肝脏中胆固醇过剩,需要更多的低密度脂蛋白(LDL)的表达,它可以将胆固醇运输到其他组织。此外,各种组织通过LDL受体(LDLR)吸收LDL,LDL受体在细胞表面广泛表达,形成复杂的LDLR/LDL结合物。结合物通过内吞作用内化到缺乏合成胆固醇能力的所需细胞中,然后LDL颗粒进入溶酶体进行降解,而受体被循环回到细胞表面再次与脂质结合。 益生菌介导的胆固醇和BAs的合成和代谢途径如图3所示,肝细胞利用胆固醇主要通过经典途径胆固醇7α-羟化酶(CYP7A1)产生胆酸(CA)和鹅脱氧胆酸(CDCA),替代途径甾醇27-羟化酶(CYP27A1)主要产生CDCA,其中CA和CDCA是人体主要的初级BAs。然而,CDCA在小鼠体内通过一种啮齿动物特异性酶甾醇-6β-羟化酶进一步转化为α-鼠胆酸(α-MCA)和β-鼠胆酸(β-MCA)。这些BAs与甘氨酸或牛磺酸结合生成相应的组合型BAs,然后作为胆汁的重要成分储存在胆囊中。肠道菌群通过去共轭、脱氢和双羟基化反应将结合型BAs转化为脱氧胆酸(DCA)和石胆酸(LCA),从而在肠腔内产生两种主要的次级BAs。此外,α-MCA和β-MCA发生类似的脱羟酶反应,在小鼠体内生成ωΜCA、HCA、HDCA和MDCA。最后,90%-95%的次级BAs通过回肠末端门静脉主动转运和被动扩散回到肝脏,以每天6-8次的速度完成BAs在肝脏和小肠之间的肠肝循环,只有5%的BAs随粪便排出。 重要的是,最近的研究表明,HFD诱导的脂质代谢紊乱患者BAs浓度升高。核内包括法尼醇X受体(FXR)主要存在于肝脏和回肠中,可通过调节BAs的合成和转运正向调节饮食诱导的脂质代谢紊乱。肝脏BAs水平升高激活FXR(CDCA是FXR最强的刺激物,其次是CA、DCA和LCA),进一步抑制CYP7A1,CYP7A1通过激活下游小异二聚体伴侣(SHP)减少BAs的产生。激活的FXR-SHP信号通路可抑制SREBP-1c的转录,上调PPARα的表达,从而改善脂质代谢紊乱。此外,FXR内分泌激素成纤维细胞生长因子15/19信号通路(小鼠FGF15和人FGF19)将肠道与肝脏紧密连接,肠道菌群产生的次级BAs可通过与FXR结合诱导FGF15/19的表达,进而下调CYP7A1的转录,抑制肝细胞中BAs的产生。L. delbrueckii可以通过良好的肠道定殖和BSH能力调节胆固醇和BAs代谢,从而降低GCDCA和GLCA浓度,但通过在回肠定殖增加非结合型BAs的水平。有趣的是,非结合型BAs由于其不溶性,可以降低血清TC水平,从而促进BAs的重新合成,补充那些未进入肠肝循环的BAs。L. delbrueckii不影响HMGCR mRNA的表达,但增强了肝脏SREBP2、LDLR和HDLR的表达以消除肝脏胆固醇。另一方面,该菌株还通过抑制肝脏FXR/SHP/FGF15信号通路增加CYP7A1活性,促进胆固醇向BAs的转化,ASBT和IBABP mRNA表达明显降低,表明摄入L. delbrueckii后BAs的重吸收明显受到抑制。ASBT可以将腔内BAs运输到肠细胞,在肠细胞中BAs与IBABP结合,然后在MRP2和OSTα/OSTβ转运蛋白的调控下将结合物转移到门静脉。同样,我们筛选了一株具有高胆固醇降解能力和BSH活性的L. plantarum H6菌株,在C57BL/6小鼠中研究抗高胆固醇血症的作用,这符合上述筛选降脂益生菌的指南。L. plantarum H6通过抑制FXR/SHP信号通路改善高胆固醇血症,这导致CYP7A1的大量激活,以增强BAs的合成,并通过降低体内HMGCA和上调体内ABCG5/8基因表达来降低胆固醇水平。有报道称,在HDF喂养的小鼠中添加L. paracasei FZU103后,肝脏和粪便中总BAs水平出现了相反的趋势,这是由于处理后肝脏中CYP7A1和BSEP mRNA表达明显上调所致。BSEP是一种与ATP结合的胆盐转运蛋白,参与体内胆盐的分泌。此外,L. paracasei FZU103不仅增加了LDLR基因的表达,而且有效降低了HMGCR的相对mRNA水平。因此,L. paracasei FZU103通过增强BAs合成、通过粪便排泄BAs和抑制胆固醇合成来改善脂质代谢异常。LXR和LDLR基因在肝脏中的表达量增加,表明L. plantarum AR113可以抑制胆固醇吸收,促进胆固醇转运。所有这些数据表明,各种益生菌菌株积极调节BAs和胆固醇代谢,以改善饮食诱导的脂质代谢紊乱(图3)。
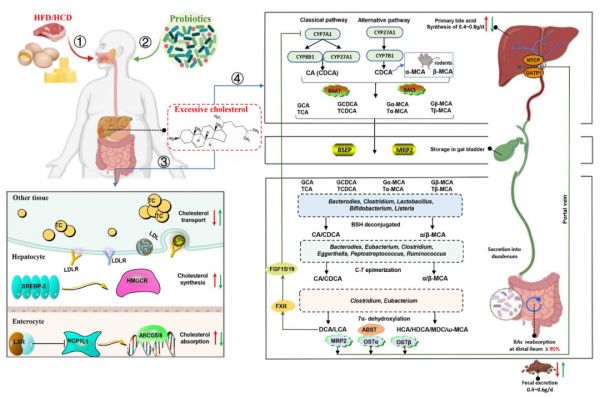
图3 益生菌通过调节胆固醇和胆汁酸代谢改善饮食诱导的脂质代谢紊乱的机制。①过量摄入高脂或高胆固醇饮食会导致高脂血症、非酒精性脂肪肝损伤、肥胖和相关代谢性疾病,其特征是体内胆固醇和甘油三酯过多。②摄入益生菌可③增加LDLR和LDR的表达,促进胆固醇向其他组织的转运,激活SREBP-2,抑制HMGCR的表达,阻止肝脏胆固醇的合成;并通过激活LXR信号通路抑制肠细胞对胆固醇的吸收,从而显著降低肝脏和血清中的胆固醇浓度。经典途径和替代途径利用胆固醇在肝脏合成初级BAs(CA和CDCA),而在啮齿类动物中,大部分CDCA被转化为α-MCA和β-MCA,BAs在BAAT和BACS的作用下与牛磺酸或甘氨酸结合,然后在BSEP和MRP2的作用下分泌到胆汁中,经肠道菌群去共轭、C-7异构化和7α-脱羟基化形成次级BAs(在人中为DCA和LCA,在啮齿动物中为HCA、HDCA、MDC和ω-Mca)。最后,大部分非结合型BAs被ASBT重新吸收进入肠细胞,并通过基底外侧BAs转运体OSTα、OSTβ和MRP2分泌到门静脉,然后在NTCP和OATP1的作用下被吸收到肝脏。④益生菌通过调节原生共生菌的组成或直接定殖来增加具有BSH能力的肠道微生物群的丰度,从而增加非结合型BAs的浓度。总体而言,益生菌通过抑制FXR/SHP/FGF15/19信号通路促进CYP7A1和CYP27A1的表达来增加BAs的合成,另一方面也通过下调肠道ASBT、OSTα和OSTβ的表达来抑制BAs的重吸收。红色箭头:高脂饮食或高胆固醇饮食促进或抑制这些活动。绿色箭头:益生菌促进或抑制的活动。
3.3 益生菌通过调节肠-肝轴改善脂质代谢紊乱
通过高通量测序分析研究了HFD对肠道微生物多样性的影响,HFD破坏了肠道中促炎菌和有益菌的比例。HFD诱导的肠道菌群失衡可增加肠道通透性,代谢性内毒素血症是由于革兰氏阴性菌过度生长导致内毒素通过肠道并经门静脉进入血流。血液中内毒素浓度的增加会促进慢性炎症反应,从而导致肥胖、胰岛素抵抗和脂质代谢紊乱等相关疾病。相反,如表1所示,多项研究表明,益生菌在重新平衡肠道微生物组成方面发挥着至关重要的作用,通过改善炎症反应来调节脂质代谢紊乱。肠上皮细胞构成肠物理屏障,在肠屏障结构中占据中心位置,其作为抵御外界环境的第一道防线。肠上皮细胞之间的蛋白质复合物旨在维持肠道屏障的完整性,包括紧密连接蛋白(TJs)、粘附连接蛋白、间隙连接蛋白和细胞桥粒。相应地,分泌性免疫球蛋白A(sIgA)通过防止致病性易位在维持肠道屏障功能方面也发挥着重要作用。然而,长期摄入过量的HFD会抑制TJs的表达,减少粘液的产生,从而增加肠道通透性。随后,受损的肠屏障会导致高浓度的循环脂多糖(LPS),同时会发生炎症反应并促使脂质代谢紊乱。LPS通过与其受体CD14形成复合物触发炎症,该复合物被免疫细胞表面的toll样受体4(TLR4)特异性识别,然后启动下游NF-κB信号通路。NF-κB在细胞质中与抑制蛋白IκB结合。活化的IκB激酶(IKK)可通过磷酸化IκB,破坏IκB-复合体并释放NF-κB p50和p65。随后,磷酸化p50和p65进入细胞核刺激促炎细胞因子(IL-6、IL-1β和TNF-α)的产生。因此,改善HFD引起的受损肠屏障功能和炎症反应是益生菌对抗脂质代谢紊乱的靶点。 近年来,益生菌在研究抑制肥胖相关炎症反应上具有较大前景。首先,益生菌处理会抑制大量的促炎细菌,从而增强了TJs、粘蛋白和sIgA的表达,增强肠道屏障功能。研究证明,L. paracasei SD1可以刺激sIgA的产生,有效维持肠道屏障的完整性。P. pentosaceus PP04在喂食HFD的小鼠盲肠中不仅减少了变形菌、拟杆菌属和Pseudomonasin等促炎细菌的数量,还显著增加了抗炎细菌的丰度,如Coprococcus、Allobaculum、Faecalibacterium和Butyricicoccus。因此,L. plantarum LC27和Bifidobacterium longum LC67抑制了HFD诱导的C57BL/6小鼠粪便中变形菌门、拟杆菌门和Deferribacteres的丰度。此外,高循环水平的LPS会通过“肠-肝轴”恶化非酒精性脂肪肝损伤(NAFLD),包括脂肪变性、肝炎和肝纤维化,以此加速脂质代谢紊乱的发展。相反,P . pentosaceus PP04、B. longum LC67和L. plantarum LC27能够在HFD诱导的动物模型中改善肝损伤,该模型通过抑制TLR4/NFκB/IκB信号通路降低循环LPS浓度。同时,其他研究报告表明,包括L. fermentiumCECT5716、L. sakei OK67和L. rhamnosus L12在内的益生菌通过降低LPS水平以及炎症因子(IL-6、IL-1β和TNF-α)来改善HFD诱导的脂质代谢紊乱。此外,有报道称乳杆菌能够通过增加小肠中MUC2和MUC3的表达来促进粘液的产生。P. pentosaceus、L. plantarum、L. acidophilus和L. casei也促进MUC2基因的表达,从而上调粘蛋白的产生。L. fermentium通过增加TJs(包括Occludin和ZO-1)的表达来修复肠道通透性,从而降低血清中炎性细胞因子MCP-1的水平。 此外,过量的游离脂肪酸和LPS浓度已被证明会影响巨噬细胞的极化,导致M1巨噬细胞比M2表型更具炎症反应。有趣的是,流式细胞仪分析表明,混合益生菌可降低小鼠的CD4+T细胞、总巨噬细胞和M1巨噬细胞浸润,从而抑制小鼠炎症因子(TNF-α和IFN-γ)的浓度,并上调抗炎因子(IL-10和TGF-β)的分泌。类似地,在饮食诱导的肥胖小鼠中,摄入L. gasseri SBT2055会抑制巨噬细胞向脂肪组织的浸润,并降低促炎M1巨噬细胞的比例。另一方面,初级BAs和SCFAs作为益生菌的特异性代谢物,有利于改善免疫系统和抑制代谢性炎症。例如,L. plantarum KLDS 1.0344和L. rhamnosus通过增强肝脏CYP7A1的表达来消耗过多的胆固醇,从而导致上述初级BAs的产生增加。然而,初级BAs可通过作用于巨噬细胞和树突状细胞减少促炎细胞因子的分泌。同样,SCFAs可以抑制NF-κB信号通路,刺激B细胞sIgA的产生,增强粘蛋白的产生,从而显著改善肠屏障功能。因此,免疫应答与脂质代谢紊乱是机体在肠道菌群失衡状态下的不利相互作用,而益生菌及其代谢产物可以通过抑制NF-κB信号通路和M1巨噬细胞浸润来抑制代谢性炎症,有助于改善HFD引起的脂质代谢紊乱(图4)。
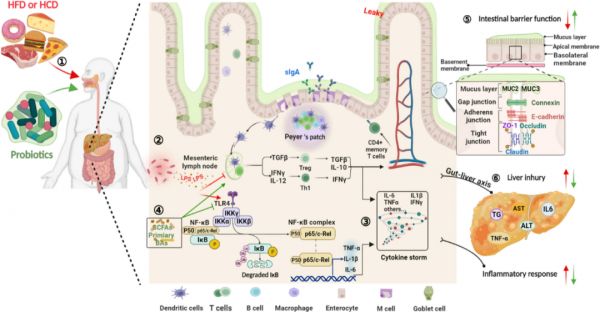
图4 益生菌通过抑制炎症反应改善饮食诱导的脂质代谢紊乱的机制。① HFD改变了肠道菌群的组成,降低有益菌的丰度,增加了促炎细菌数量,导致循环中高浓度LPS破坏肠道屏障功能,诱发全身炎症反应,从而加速脂质代谢紊乱的发展。②过高浓度的LPS可使M2表型转变为炎性M1巨噬细胞和激活的NF-KB信号通路,③从而导致炎症爆发,其特征是IL-6、IL-1β、TNF-α和IFN-γ 等炎性因子水平上调,IL-10和TGF-B等抗炎因子水平下调。同时,“肠-肝”轴为这些炎性细胞因子通过门静脉进入血液循环系统提供了途径,这可能通过全身炎症反应导致严重的肝脂肪变性。④然而,益生菌可刺激B细胞分泌slgA,产生初级BAs和SCFAs在内的代谢物,从而有效逆转上述炎症反应。⑤另一方面,益生菌能够提高紧密连接蛋白(ZO-1、Occludin和Claudin)和粘蛋白的表达,通过重新平衡肠道菌群来改善受损的肠道屏障功能,从而降低循环LPS水平,抑制炎症反应。⑥综上所述,益生菌及其代谢产物能够通过抑制代谢性炎症来改善饮食诱导的肝脏脂肪变性,从而显著减缓脂质代谢紊乱的过程。
结语
近年来,关于益生菌预防饮食引起的脂质代谢紊乱的研究较多,但大多是在啮齿动物模型上进行的,但该模型不足以反映人类脂质代谢紊乱发展过程中病理变化的复杂异质性。由于大型动物模型在生物化学、代谢、遗传和生理方面与人类有显著的相似之处,因此可以弥补基础研究与临床应用之间的差距。因此,未来迫切需要进一步的临床试验来探索和比较不同益生菌菌株及剂量的机制数据。此外,尽管很少有研究报道益生菌的不良影响,但评估益生菌的安全性是十分有必要的。在体外筛选益生菌时,应充分开展一系列实验,包括有害毒素和代谢酶、粘蛋白降解活性、溶血活性和抗生素耐药性的评估。因此,考虑到潜在的致病毒性可能与真实宿主相互作用,应通过动物模型的毒性实验充分评估益生菌的安全性。 当然,益生菌的活性是在制备过程中调节脂质代谢的重要因素。微胶囊技术在生产和胃肠道条件下具有保存和提高细胞活力的潜质,然而,优化壁材和干燥工艺参数对于开发具有降脂作用益生菌的高细胞活力是十分必要的。另一方面,厌氧益生菌加工成本高,难以在食品工业中应用,而几种死亡益生菌也具有抗肥胖的能力,这拓展了益生菌在食品工业中的应用。因此,研究死亡功能性益生菌的活性物质对制定预防脂质代谢疾病的新膳食策略具有重要意义。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
8大坏习惯让你的新陈代谢紊乱
肠道菌群及其代谢产物与妊娠期糖尿病相关性的研究进展
节后综合症的最佳饮食调理
Nature子刊:节食+禁食或是减肥和降血压的更有效策略
怀孕和哺乳期间补充益生菌对母婴健康有什么好处?
十大生物技术将改善人类健康
肝病学丨“瘦人脂肪肝”如何诊治?
个体肠道菌群是精准营养干预代谢健康成功的基础
消瘦体质如何有效改善
重磅综述
网址: 综述丨吉林农大: 益生菌对饮食诱导的脂质代谢紊乱的改善作用(国人佳作) https://www.trfsz.com/newsview58266.html
推荐资讯
- 1从出汗看健康 出汗透露你的健 3946
- 2早上怎么喝水最健康? 3723
- 3习惯造就健康 影响健康的习惯 3369
- 4五大原因危害女性健康 如何保 3271
- 5连花清瘟、布洛芬等多款感冒药 3003
- 6男子喝水喉咙里像放了刀子一样 2500
- 7补肾吃什么 补肾最佳食物推荐 2442
- 810人混检核酸几天出结果?1 2263
- 9第二轮新冠疫情要来了?疾控中 2256
- 10转阴多久没有传染性?满足四个 2196






