一种乌梅提取物的制备方法及其质量检测方法与流程
本发明属于中药制备技术领域,具体涉及一种乌梅提取物的制备方法及其质量检测方法。
背景技术:
乌梅为蔷薇科植物梅prunusmume(sieb.)sieb.etzucc.的干燥近成熟果实。味酸、涩,性平。归肝、脾、肺、大肠经。具有敛肺,涩肠,生津,安蛔之功效。常用于肺虚久咳,久泻久痢,虚热消渴,蛔厥呕吐腹痛。现代研究表明,乌梅含有丰富的有机酸成分,以枸橼酸为主,还包括苹果酸、绿原酸、延胡索酸、酒石酸、草酸、琥珀酸等。除此之外还含有黄酮类、挥发性成分、糖类等物质,具有抗菌、消炎、抗疲劳等药理作用。但是,目前制备的乌梅饮品质量残差不齐,因没有国家统一的质量标准,也没有一致的行业标准,导致质量标准差异很大,有的有含量测定,有的无含量测定,含量测定的指标成分和含量测定的方法不尽相同,即使含量的指标成分和含量测定方法相同,但含量测定限度的表述不一致,有的按百分比计,有的以每克计,有的以每袋计,所测的指标绝对量更是不同的,这样难以界定含量测定的统一限度。根据2010年药典编制大纲提出中成药及中药材应“逐步由单一指标性成分定性定量测定,向活性、有效成分及生物测定的综合检测过渡,向多成分和指纹或特征图谱整体质量控制模式转化”。其中,在对鉴定的技术要求中指出,所采用的色谱特征图谱,“应至少指认其中3个以上的有效成分、特征成分或主成分并对其比例作出规定,而指认峰的峰面积之和应大于总峰面积的50%。”(参见2010年版《中华人民共和国药典》一部提取物质量标准起草技术要求)。
为此,有必要建立一种稳定、精密度高的多成分和特征峰图谱,用以科学、有效地检测中药复方制剂乌梅汤剂的质量。该特征峰图谱应具有以下几个特点:1、至少应指认出特征峰图谱中3个以上的色谱峰,指认色谱峰的峰面积之和应大于总峰面积的50%;2、指认的色谱峰应能覆盖复方中的组成中药;3、指认的色谱峰应当覆盖与组方(复方)功效大体相应的活性成分。
因此,为严格控制乌梅颗粒的质量,为乌梅提取物或颗粒的生产工艺提供更全面的质量控制参数,对乌梅提取物特征图谱的特征峰相对峰面积设定限量标准,是非常必要的。
技术实现要素:
为了解决上述技术问题,本发明提供一种乌梅提取物的制备方法及其质量检测方法。
为实现上述目的,本发明采用以下的技术方案为:
一种乌梅提取物的制备方法,其包括将乌梅饮片加水煎煮1~3次,合并滤液,滤液水浴冷却后浓缩;滤液减压浓缩至适量,置于进行冷冻干燥,即得乌梅提取物。
优选地,加水量为使水浸过乌梅饮片药面的2~5cm。
如上所述的制备方法,优选地,所述乌梅饮片加入6~10倍水浸泡20~30min,每次煎煮20~30min,选择200目~300目标准筛趁热过滤,合并滤液;所述水浴冷却至60℃~70℃后浓缩。
如上所述的制备方法,优选地,所述减压浓缩的温度为60℃~70℃,浓缩真空度为-0.085~-0.09mpa,浓缩后相对密度为1.04~1.07g/ml。
如上所述的制备方法,优选地,所述冷冻干燥包括:所述冷冻干燥包括:预冻温度为-45℃,预冻时间6h,升华干燥温度为-35℃~0℃,时间为24h;解析干燥温度为0℃~15℃,时间为9h,真空度为0~0.2mbar。
本发明的制备方法中采用低温浓缩和冷冻干燥,最大限度保留中药有效成分群,制成乌梅提取物的冻干粉。
一种乌梅提取物的质量检测方法,为采用超高效液相色谱法对乌梅提取物的特征峰图谱的测定,包括以下步骤:
s1、制备乌梅提取物的样品溶液;
s4、制备枸橼酸对照品溶液:
s3、采用超高效液相色谱仪进行色谱分析,记录色谱图,与参照物相应的峰为s峰。
如上所述的质量检测方法,优选地,所述特征峰图谱的测定的色谱柱为岛津2.1×150mm2μm色谱柱,柱长为150mm,内径2.1mm,粒径为2μm;以乙腈为流动相a,以0.5%ph值为2.9的磷酸二氢铵水溶液为流动相b,进行梯度洗脱;柱温为30℃;流速为每分钟0.2ml;检测波长为210nm,理论板数按枸橼酸计算应不低于5000。
如上所述的质量检测方法,优选地,所述乌梅提取物的样品溶液的制备为取乌梅提取物样品约0.23g,精密称定,置具50ml容量瓶中,加水溶解定容,摇匀后,滤过,取续滤液,即为乌梅提取物样品液。
如上所述的质量检测方法,优选地,所述梯度洗脱为:0~3min,1%→2%流动相a;3~9min,2%→8%流动相a;9~30min,8%→8%流动相a;30~40min,8%→10%流动相a;40~41min,10%→1%流动相a;41~46min,1%→1%流动相a。
进一步地,特征峰图谱中应有6个较为明显的共有峰,各峰的相对保留时间规定,规定范围,相对峰面积规定范围,及各峰对应的化合物为:
如上所述的检测方法,优选地,所述枸橼酸含量的测定方法包括样品溶液制备和枸橼酸对照品制备,用液相色谱仪进行测定。
进一步地,所述液相色谱仪的条件为分别精密吸取对照品溶液10μl与供试品溶液各5μl,以乙腈-0.5%磷酸二氢按溶液按体积比为3:97,并用磷酸调ph值至3.0为流动相为流动相;检测波长为210nm;理论板数按枸橼酸计算应不低于7000。
如上所述的质量标准化测定方法,优选地,所述样品溶液制备方法为取乌梅提取物约0.1g,精密称定,置于锥形瓶中,精密加入50ml水,摇匀,溶解,滤过,取滤液作为供试品溶液;枸橼酸对照品为含枸橼酸0.5mg/ml的水溶液。
本发明的有益效果在于:
本发明提供的一种乌梅提取物的制备方法,有效提取出乌梅中有效成分,其制备工艺稳定,使得工艺标准化,并可用于乌梅药材、颗粒剂配方颗粒等,通过乌梅提取物进行对质量标准化测定方法的研究,使得获得的乌梅提取物的质量能稳定控制。本发明提供的乌梅提取物色谱特征图谱用于中药的质量控制,能够提供较为丰富的信息,为产品提供质量控制手段。
本发明还提供了对乌梅提取物或乌梅冻干粉的特征峰图谱在检测乌梅提取物的质量中的应用,可用于鉴定乌梅提取物或乌梅冻干粉的质量。
附图说明
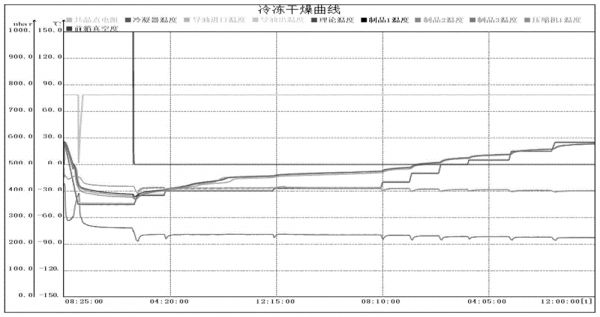
图1为实施例1中乌梅提取物冻干曲线;
图2为实施例2中乌梅提取物制备工艺流程图;
图3为不同提取溶剂的提取效率对比图;
图4为不同提取方式的提取效率对比图;
图5为枸橼酸对照品的紫外吸收图;
图6为乌梅标提取物样品的dad-3d图;
图7为赛默飞色谱柱、流速为0.4ml/min下的色谱图;
图8为赛默飞色谱柱、流速为0.5ml/min下的色谱图;
图9为安捷伦色谱柱的色谱图;
图10为岛津色谱柱的色谱图;
图11为有机酸优化的色谱图,其中,图11(a)为0.1%磷酸的色谱图,图11(b)为0.1%甲酸的色谱图;
图12为ph的优的色谱图,其中,图12(a)为ph2.8的色谱图,图12(b)为ph2.9的色谱图;图12(c)为ph3.0的色谱图,图13为乌梅提取物对照特征图谱;
图14为乌梅提取物lc-ms质谱图;其中图14(a)为负离子模式tic质谱图;图14(b)为负离子模式bpi质谱图;图14(c)为210nm紫外色谱图;
图15为乌梅提取物专属性考察结果,其中,图15(a)为空白溶剂,图15(b)为乌梅提取物;
图16为乌梅提取物整体性考察结果,其中,图16(a)为46min,图16(b)为90min。
具体实施方式
以下实施例用于进一步说明本发明,但不应理解为对本发明的限制。在不背离本发明精神和实质的前提下,对本发明所作的修饰或者替换,均属于本发明的范畴。
若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段。
实施例1
乌梅提取物的制备方法:s1、取乌梅100g,称定,置砂锅中,一煎药液是加水量6倍量,加入煎药壶,煎煮30min,300目标准筛趁热过滤,滤液水浴冷却;药渣再加水10倍量进行二煎20min,标准筛200目趁热过滤,合并两次滤液,滤液水浴冷却至65℃后浓缩;滤液减压浓缩至适量,置于冷冻干燥机中,冷冻干燥,即得乌梅提取物。
优选地,浓缩采用旋转蒸发仪进行真空减压浓缩(真空度:-0.085~-0.090mpa),浓缩温度为65℃,浓缩1~2小时至适宜体积,浓缩液比重为1.04~1.07(温度65℃),含固率为10.0~20.0%。
优选地,取上述乌梅浓缩液,加水稀释至含固量约为10.0-15.0%,真空冷冻干燥机共晶点测试结果为-28℃,故乌梅浓缩液预冻温度可考虑为-45℃,升华干燥温度为-35℃-0℃,解析干燥温度为10℃-30℃,各阶段冻干工艺参数如表1所示,冻干曲线如图1所示。
表1乌梅冷冻干燥参数设置
优选地,乌梅浓缩液含固量至10%-15%,量取约1ml均匀分装至10ml西林瓶中,放入真空冷冻干燥机中进行冷冻干燥,乌梅浓缩液预冻温度可考虑为-45℃,预冻时间为6小时,升华干燥温度为-35℃-0℃,升华干燥时间为24小时,真空度为0.2mbar;解析干燥温度为0℃-15℃,解析干燥时间为9小时,真空度为0.2mbar。最后,获得质地疏松的棕褐色絮状固体。
实施例2
乌梅提取物制备工艺,按图2的工艺流程图进行:(1)分别称取3份乌梅,每份约100g,第一煎加8倍水,第二煎加6倍水,浸泡30分钟后开始煎煮。第一煎开武火(500w),待煮沸后,调为文火煎煮30分钟。趁热分别200目滤布。第二煎(200w),待煮沸后,调为文火分别煎煮25分钟。趁热分别200目滤布。合并相同目数下的煎液,将煎液在65℃下浓缩后取样测定收膏率和枸橼酸的转移率。结果如表:取乌梅100g,称定,置砂锅中,加入8倍水浸泡30min后开始煎煮。先武火(500w)煮沸,再文火(200w)煎煮30min,选择100目标准筛趁热过滤,滤液水浴冷却;
(2)药渣再加6倍水,武火(500w)煮沸后,再文火(200w)煎煮25min,300目标准筛趁热过滤,滤液水浴冷却;
(3)合并滤液65℃减压浓缩,取浓缩液测定收膏率。浓缩液出膏率的计算公式:出膏率%=浓缩液重量×浓缩液含固率/乌梅量×100%。提取物浓缩液出膏率值即为提取物出膏率。结果如表2所示。其中,乌梅浓缩液含固率测定方法:精密称取浓缩液10g,置已恒重的蒸发皿中,在水浴上蒸干后,于105℃干燥3小时,置干燥器中冷却30分钟,迅速精密称定重量,计算得到浓缩液含固率。本实施例中所用的样品选择为乌梅201802(含量29.29%)、乌梅201803(含量27.70%)、乌梅201804(含量25.88%)。
表2
(4)冻干前,加水调节浓缩液的固含量至10.0-15.0%左右,后进行冷冻干燥,即得乌梅提取物,提取物的收率见表3。提取物样品指标成分转移率计算方法:提取物样品中指标成分转移率(%)=提取物冻干粉含量/饮片含量×提取物出膏率(%)。
表3
经上述3批分别平行3次的验证结果表明乌梅提取物的制备工艺稳定。
实施例3枸橼酸含量测定分析方法的建立
(1)对照品来源及纯度检查
枸橼酸对照品(编号:100396-201603),购于中国食品药品检定研究院,供含量测定用,含量以100%计,使用前105℃干燥2h。实验对枸橼酸全波长扫描,记录其紫外吸收图,结果由图可知:枸橼酸为末端吸收,选择检测波长为210nm。
(2)色谱条件
以十八烷基硅烷键合硅胶为填充剂;以乙腈-0.5%磷酸二氢按溶液(3:97)(用磷酸调ph值至3.0)为流动相。理论板数按枸橼酸计算应不低于7000。
(3)供试品溶液的制备
a不同提取试剂的优化
取乌梅提取物(批号:bt201801)1.0g,研细,精密称定0.1g,平行2份,置具塞锥形瓶中,精密加入水、稀乙醇、75%乙醇、乙醇、50%甲醇、75%甲醇、甲醇各50ml,密塞,称定重量,分别超声(功率250w,频率50khz)处理30分钟,放冷,再称定重量,用相应的溶剂补足减失的重量,摇匀、滤过,取续滤液,即得。分别精密吸取各供试液5μl,注入液相色谱仪,按上述色谱条件测定,得枸橼酸含量。
表4不同提取溶剂的比较
由上表可以看出:采用水作为提取溶剂时,乌梅中枸橼酸含量较高,且以水作为溶剂,有较好的溶解度和分离度,因此以水作溶剂效果最好。
b不同提取方法的优化
取乌梅提取物(批号:bt201801)1.0g,研细,精密称定0.1g,平行三份,置具塞锥形瓶中,精密加入水50ml,密塞,称定重量,分别超声(功率250w,频率50khz)处理30分钟、加热回流30分钟、直接溶解,放冷,再称定重量,用水补足减失的重量,摇匀、滤过,取续滤液,即得。分别精密吸取各供试液5μl,注入液相色谱仪,按上述色谱条件测定,得枸橼酸总含量,结果如见表5所示。
表5不同提取方法的比较
结果表明:超声提取方式所得枸橼酸含量最低,回流提取与直接溶解方式所得枸橼酸含量相近,在考虑到操作时间及效率的条件下,直接溶解是最佳方式。
(4)含量测定分析方法的方法学验证
1).重复性试验:取乌梅提取物(批号:bt201801)约0.1g,平行6份,精密称定,制备样品供试液,分别进样5μl,测定样品中枸橼酸峰面积值,计算其总量及rsd,结果表明重复性(rsd%=0.11%)良好。
2).耐用性试验
取样品1份(批号:bt201801),按上述制备供试品溶液供试液,考察0.9ml/min、1.0ml/min、1.1ml/min三个流速。结果表明:三种流速下色谱峰分离效果均较好。流速为1.0ml/min时分析所需时间适中,优选流速为1.0ml/min。
取样品1份(批号:bt201803-1),按上述制备供试品溶液供试液,考察25℃、30℃、35℃三个温度。结果表明三种柱温下色谱峰分离效果均较好。考虑到色谱柱的耐受性及分析所需时间,因此选择柱温为30℃。
取样品1份(批号:bt201803-1),按上述前处理方法2制备供试品溶液供试液,分别采用1-diamonsil-c18(dimka,250×4.6mm,5μm)、2-inertsilods-hl(glsciences,250×4.6mm,5μm)、3-uitimatexb-c18(welch,250×4.6mm,5μm)三种色谱柱,对乌梅提取物样品进行分析。结果显示,三种色谱柱的分离均较好,保留时间适中,说明色谱柱对样品的测定结果影响较小。
3).稳定性试验
取样品1份(批号:bt201801),按上述方法制备供试品溶液供试液,每隔2个小时进样10μl,测定峰面积值,计算其rsd,共测定10小时。结果表明:样品供试液在10小时内稳定性良好(枸橼酸的rsd%=0.28%。)
4).回收率
分别取已知高含量的样品(批号:bt201801,含量:66.29%)约0.05g,精密称定,加入枸橼酸对照品32.05mg,共6份,按供试品溶液制备方法制成供试品溶液,分别进样5μl,测定枸橼酸峰面积,计算其含量,以下列公式计算回收率,rsd,结果见表7。
表7
实验结果显示枸橼酸回收率为99.07%,根据《中国药典》2015版四部“药品质量标准分析方法验证指导原则”规定样品中待测成分含量为10%时,回收率限度为95%~102%,表明回收率良好。取已知含量的样品(批号:bt201815,含量:49.04%)0.050g,精密称定,分别加入枸橼酸对照品24.26mg,共6份,按供试品溶液制备方法制成供试品溶液,分别进样5μl,测定枸橼酸峰面积,计算其含量,并按以下列公式计算回收率及rsd,结果见表8。
表8
实施例5乌梅提取物的特征图谱分析方法
1.超高效液相色谱条件的确定
检测波长的确定:取乌梅提取物(批号:bt201801)适量,研细。精密称取0.23g,加25%乙醇50ml,超声处理30分钟,滤过,取续滤液作为供试液,记录210~400nm范围内的吸收光谱。结果表明,在210nm左右,乌梅提取物样品溶液可以检测到的色谱峰最多,且各色谱峰的峰面积较大,因此选择210nm为检测波长。
流动相的优化:采用赛默飞(hypesilgold2.1*100mm,1.9μm)色谱柱;以乙腈为流动相a,以0.5%ph值为3.0的磷酸二氢铵水溶液为流动相b,按0-20min,3%→97%流动相a,97%→3%流动相b,20-21min,97%→3%流动相a,3%→97%流动相b,21~23min,3%流动相a,97%流动相b进行梯度洗脱;柱温为30℃;流速为每分钟0.40ml/min;检测波长为210nm。结果表明,乌梅提取物主要含大极性成分。通过对流速为0.5ml/min,调整梯度后试验表明10cm柱长的短柱比较难达到理想的分离效果,因此决定换成15cm柱长的柱子,同时梯度结果也表明乌梅提取物在乙腈比例不到20%时就洗脱完全。
通过用安捷伦(zorbaxsb-c182.1×150mm,1.8μm);以乙腈为流动相a,以0.5%ph值为3.0的磷酸二氢铵水溶液为流动相b,按不同梯度洗脱;柱温为30℃;流速为每分钟0.20ml/min;检测波长为210nm。结果表明,梯度中乙腈比例可以继续降低,而且发现这跟安捷伦柱子的分离效果还需优化,考虑换根柱子。
用岛津(inertsilods-3,2.1×150mm,2μm)色谱柱;以乙腈为流动相a,以0.5%ph值为2.9的磷酸二氢铵水溶液为流动相b,按下表9中的规定进行梯度洗脱;柱温为30℃;流速为每分钟0.20ml;检测波长为210nm。
表9洗脱梯度
结果表明有较好的分离效果。用岛津(inertsilods-32.1×150mm2μm)色谱柱,采用上述色谱条件,取乌梅冻干粉的供试品溶液,先后比较使用0.1%磷酸与0.1%甲酸的情况。结果表明,使用0.1%磷酸与0.1%甲酸都没有很好的分离情况,因此不考虑使用这两种有机酸。
用岛津(inertsilods-32.1×150mm2μm)色谱柱,采用上述色谱条件,取乌梅冻干粉的供试品溶液,先后比较使用ph2.8,ph2.9,ph3.0磷酸二氢铵水溶液-乙腈为流动相的出峰情况。结果表明,ph值为2.9为时基线更平稳,分离效果最好。
色谱条件的确定:最终确定了如下色谱条件:岛津(inertsilods-32.1×150mm2μm)色谱柱(柱长为150mm,内径2.1mm,粒径为2μm);以乙腈为流动相a,以0.5%ph值为2.9的磷酸二氢铵水溶液为流动相b,按表9中的规定进行梯度洗脱;柱温为30℃;流速为每分钟0.20ml;检测波长为210nm。理论板数按枸橼酸计算应不低于5000。
2.供试品溶液的制备
提取溶剂优化:取乌梅提取物(批号:bt201801)适量,研细。取约0.23g,精密称定,精密加入25%甲醇、50%甲醇、75%甲醇、甲醇、25%乙醇、稀乙醇、75%乙醇、乙醇、和水各50ml,密塞,称定重量,超声处理30分钟,放冷,再称定重量,用不同的溶剂补足减失的重量,摇匀,滤过,取续滤液,按最终确定的色谱条件进行液相色谱。结果如图3所示,结果表明:25%甲醇和水的提取效果最好,而用含有乙醇的溶剂提取,枸橼酸峰位的情况比较差,初步怀疑是溶剂效应所引起。
为了验证以上的推测,进行一下试验:精密量取25%乙醇、稀乙醇、75%乙醇、乙醇提取的样品10ml于蒸发皿中,待溶剂挥干后加水复溶,转移至10ml容量瓶中,用水定容,过滤,取续滤液进样,同时取枸橼酸对照溶液分别用稀乙醇、乙醇、水稀释进样,比较样品出峰情况,试验结果如下:结果表明,用含乙醇的溶液提取乌梅提取物样品,其进样结果会出现严重的溶剂效应,综合考虑选水作为提取溶液。
提取方式优化:取乌梅提取物(批号:bt201801)适量,研细。取约0.23g,精密称定,加入水溶液50ml,称定重量,分别加热回流、振摇提取、超声处理30分钟,放冷,再称定重量,用水补足减失的重量,摇匀,滤过,取过滤液,进行液相色谱。结果如图4所示,结果表明这几种提取方式差别不大,综合考虑,选择加水直接溶解的提取方式。
最后确定供试品溶液的制备:取本品约0.23g,精密称定,置具50ml容量瓶中,加水溶解定容,摇匀后,滤过,取过滤液,按上述确定的色谱条件进行液相色谱仪,分别精密吸取对照品溶液10μl与供试品溶液5μl,注入液相色谱仪,测定。
结果表明乌梅提取物的特征图谱中由6个较为明显的共有峰。积分参数:峰宽为0.1;最小峰面积为0.1;基线噪音范围:自动。
验证方法的重复性:取同一批号样品(批号:bt201801)共6份,按供试品溶液制备方法制备成供试液,进样1μl分析,考察特征峰相对保留时间和相对峰面积的一致性,结果见表10、表11。
表10重复性实验结果(相对保留时间)
表11重复性实验结果(相对峰面积)
结果表明:各特征峰的相对保留时间及相对峰面积值的rsd均小于3%,该方法的重复性良好。
验证方法的精密度:取同一批号样品(批号:bt201801),按供试品溶液制备方法制备成供试液,进样6次,每次1μl,考察特征峰相对保留时间和相对峰面积的一致性。结果表明:各特征峰相对保留时间及相对峰面积值rsd均小于3%,仪器精密度良好。
验证方法的稳定性:取同一批号样品(批号:bt201801),按供试品溶液制备方法制备成供试液,每隔2小时进样一次,共测定12小时,分别进样1μl,考察特征峰相对保留时间和相对峰面积的一致性。结果表明:各特征峰的相对保留时间及相对峰面积的rsd均小于3%,供试液在12小时内稳定性良好。
实施例6特征图谱分析方法的优化条件及结果
为了控制乌梅配方颗粒的质量并为其生产工艺提供较全面的质量控制参数,建立的乌梅提取物特征图谱,并对其特征峰的相对峰面积设定限量标准。具体方法如下:
参照物溶液的制备:取枸橼酸对照品对照品适量,精密称定,加水制成每1ml含枸橼酸0.5mg即得。
1.色谱条件的确定
检测波长的确定,取枸橼酸对照品的水溶液,进样1μl进行分析,记录其紫外吸收图。结果如图5所示,结果表明,枸橼酸为末端吸收。
取乌梅标准汤剂(批号:bt201801)适量,研细。精密称取0.23g,加25%乙醇50ml,超声处理30分钟,滤过,取续滤液作为供试液,记录210~400nm范围内的吸收光谱。结果如图6所示,结果表明,在210nm左右,乌梅标准汤剂样品溶液可以检测到的色谱峰最多,且各色谱峰的峰面积较大,因此选择210nm为检测波长。
流动相梯度考察:采用赛默飞(hypesilgold2.1*100mm,1.9μm)色谱柱;以乙腈为流动相a,以0.5%ph3.0的磷酸二氢铵水溶液为流动相b,按下表12中的规定进行梯度洗脱;柱温为30℃;流速为每分钟0.40ml/min;检测波长为210nm。
表12
结果见图7,结果表明,乌梅提取物主要含大极性成分。
同样的色谱条件,流速为0.5ml/min,调整梯度并按下表13中的规定进行梯度洗脱。
表13
试验结果见图8所示,结果表明10cm柱长的短柱比较难达到理想的分离效果,因此决定换成15cm柱长的柱子,同时梯度结果也表明乌梅提取物在乙腈比例不到20%时就洗脱完全。
用安捷伦(zorbaxsb-c182.1*150mm,1.8μm);以乙腈为流动相a,以0.5%ph3.0的磷酸二氢铵水溶液为流动相b,按下表14中的规定进行梯度洗脱;柱温为30℃;流速为每分钟0.20ml/min;检测波长为210nm。
表14
结果如图9所示,结果表明,梯度中乙腈比例可以继续降低,而且发现这跟安捷伦柱子的分离效果还需优化,考虑换根柱子。
用岛津(inertsilods-3,2.1×150mm,2μm)色谱柱;以乙腈为流动相a,以0.5%ph2.9的磷酸二氢铵水溶液为流动相b,按下表15中的规定进行梯度洗脱;柱温为30℃;流速为每分钟0.20ml;检测波长为210nm。
表15
结果如图10所示。结果表明能很好的分离。
2.有机酸的确定
用岛津(inertsilods-32.1×150mm2μm)色谱柱,采用上述色谱条件,取乌梅冻干粉的供试品溶液,先后比较使用0.1%磷酸与0.1%甲酸的情况。
结果如图11所示,其中图11(a)为0.1%磷酸的色谱图,图11(b)为0.1%甲酸的色谱图,结果表明,使用0.1%磷酸与0.1%甲酸都没有很好的分离情况,因此不考虑使用这两只有机酸。
3.ph的优化
用岛津(inertsilods-32.1×150mm2μm)色谱柱,采用上述色谱条件,取乌梅冻干粉的供试品溶液,先后比较使用ph2.8,ph2.9,ph3.0磷酸二氢铵水溶液-乙腈为流动相的出峰情况。结果如图12所示,其中,图12(a)为ph2.8的色谱图,图12(b)为ph2.9的色谱图;图12(c)为ph3.0的色谱图,结果表明,ph为2.9为时基线更平稳,分离效果最好。
色谱条件的确定:
供试品溶液的制备:取本品约0.23g,精密称定,置具50ml容量瓶中,加水溶解定容,摇匀后,滤过,取过滤液进样。
最终确定了如下色谱条件:岛津(inertsilods-32.1×150mm2μm)色谱柱(柱长为150mm,内径2.1mm,粒径为2μm);以乙腈为流动相a,以0.5%ph2.9的磷酸二氢铵水溶液为流动相b,按如下梯度洗脱:0~3min,1%→2%流动相a;3~9min,2%→8%流动相a;9~30min,8%→8%流动相a;30~40min,8%→10%流动相a;40~41min,10%→1%流动相a;41~46min,1%→1%流动相a;
柱温为30℃;流速为每分钟0.20ml;检测波长为210nm。理论板数按枸橼酸计算应不低于5000。
参照物溶液的制备取枸橼酸对照品适量,精密称定,加水制成每1ml含枸橼酸0.5mg即得。
对于乌梅取样地点为福建龙岩、云南玉溪、云南大理、云南保山、四川成都、四川雅安、四川达州实地取样,每个产区选择不同的乡镇、村分别取样3批以上,确保各地区样品的代表性,累计取样18批。按照实施例2中乌梅提取物制备方法进行,最终确定了乌梅提取物中出膏率上、下限范围为15.7%~29.2%。基于对18批次乌梅提取物按照上述供试品溶液制备方法进行,分别精密吸取对照品溶液与供试品溶液各1μl,注入液上述条件液相色谱仪,测定,结果共得到6个共有峰。
枸橼酸(峰1)为乌梅中的活性成分,且色谱峰分离度好,周围没有其它色谱峰干扰,因此选为参照峰。同时,枸橼酸为含量测定的指标成分之一,以枸橼酸峰作为参照峰并规定其他各特征峰的相对峰面积范围,使得各特征峰相对峰面积范围具有的定量意义。基于18批次乌梅提取物的测定结果,每个特征峰取其18批次中的最小值和最大值,作为峰面积范围的下限和上限,兼顾了乌梅的品种特性,能避免大生产部分合格批次的误判,又能对大生产工艺提供重要质量控制参数,从而提高了产品质量及质量控制水平。
结果表明,供试品特征图谱中应有6个特征峰,与参照物相应的峰为s峰,如图13所示为例。计算各特征峰与s峰的相对保留时间,其相对保留时间应在规定值的±5%之内;计算各特征峰与s峰的相对峰面积,结果如表16所示。积分参数:峰宽为0.1;最小峰面积为0.1;基线噪音范围:自动。
表16乌梅提取物特征图谱相对峰面积
实施例7特征峰的指认
采用lc-ms技术,取乌梅标准汤冻干粉,约50mg,精密加入去离子水50ml,超声处理(功率100w,频率30khz)30分钟,使溶解,摇匀,过滤(0.22μm)。
uplc条件:
watersacquityuplc色谱仪;
色谱柱:watershsst3uplc色谱柱(2.1*100mm,1.8μm);
流动相系统:0.1%甲酸水(a):甲醇(b);按照下表17梯度程序洗脱;
流速:0.4ml/min;
检测波长270,254,210nm;柱温:30℃;进样量:3μl;0.8μl(对照品)
表17.梯度提取程序
质谱条件:watersxevog2-xsqtof质谱仪,esi离子源正负离子检测;源电压:2.5kv,n2流速:800l/h,碰撞气体为氮气;毛细管温度400℃;锥孔气体流速:100l/h;气源温度:120℃;采用全扫描方式,分子量扫描范围50~1500;碰撞诱导解离电压:6v(低能量)、30~60v(高能量)。同时对标准品:苦杏仁苷;绿原酸;枸橼酸做为对照做超高效液相图谱。
乌梅标准汤lc-ms质谱图结果表明,如图14所示,其中(a:负离子模式tic质谱图;b:负离子模式bpi质谱图;c:210nm紫外色谱图)。通过针对下图中的6个特征峰进行鉴定,从各峰的紫外吸收和质谱分子量来看,峰1即为枸橼酸,峰5为绿原酸;此外,标准汤中含有微量的苦杏仁苷。峰2(5.96min):dad图谱显示最大紫外吸收在254nm,提示结构中含有苯环;质谱:329.08722(m-h);167.03393(m-glu);152.01033(m-glu-ch3);123.04430(m-glu-coo),提示结构中含有羧基,葡萄糖单元。初步推测结构如下所示。
峰3(7.53min):dad显示最大紫外吸收为323nm;从紫外扫描图可推测该成分具有咖啡酸类似结构;质谱:707.18261(2m-h);353.08674(m-h);191.05502碎片提示具有奎尼酸单元;135.04392碎片进一步证实具有咖啡酸单元;因此色谱峰3初步鉴定为绿原酸的同分异构体,新绿原酸(c16h18o9,cas:906-33-2)。峰4(11.60min):dad图谱显示最大吸收在308nm处;质谱:487.14524(m-h)。峰a(14.15min):dad显示最大紫外吸收为327nm;从紫外扫描图可推测该成分具有咖啡酸类似结构;质谱:707.18252(2m-h);353.08709(m-h);191.05495碎片提示具有奎尼酸单元;135.04402碎片进一步证实具有咖啡酸单元;因此色谱峰4初步鉴定为绿原酸和新绿原酸的同分异构体,隐绿原酸(c16h18o9,cas:905-99-7)。峰6(15.77min):dad显示峰6具有紫外末端吸收;质谱:447.15033(m+hcoo),401.14462(m-h)。
通过对对照品a.绿原酸;b.隐绿原酸;c.新绿原酸的指认,鉴定色谱峰1、3、5和a分为1.枸橼酸;3.新绿原酸;5.绿原酸;4.隐绿原酸。
实施例8特征图谱分析方法的方法学验证
1、专属性
对乌梅提取物和空白溶剂分别采用实施例6中确定的图谱条件进行高效液相色谱特征图谱的测定,结果见图15,图15(a)为空白溶剂,图15(b)为乌梅提取物,由结果可知,溶剂对乌梅标准汤剂图谱中的特征峰没有干扰。
2、整体性
对乌梅提取物进行特征峰图谱的测定46min和90min,结果如图16所示,图16(a)为46min,图16(b)为92min。结果表明,乌梅标准汤剂在40min后无明显的色谱峰,整体性较好。
3、精密度
取同一批号样品(批号:bt201801),按供试品溶液制备方法制备成供试液,进样6次,每次1μl,考察特征峰相对保留时间和相对峰面积的一致性。结果如表18和19所示。
表18精密度实验结果(相对保留时间)
表19精密度实验结果(相对峰面积)
结果表明:各特征峰相对保留时间及相对峰面积值rsd均小于3%,仪器精密度良好。
4、重复性
取同一批号样品(批号:bt201801)共6份,按供试品溶液制备方法制备成供试液,进样1μl分析,考察特征峰相对保留时间和相对峰面积的一致性。结果见表20、表21。
表20重复性实验结果(相对保留时间)
表21重复性实验结果(相对峰面积)
结果表明:各特征峰的相对保留时间及相对峰面积值的rsd均小于3%,该方法的重复性良好。
5、耐用性
(1)柱温的考察:用岛津(inertsilods-3,2.1×150mm,2μm)色谱柱,取乌梅冻干粉的供试品溶液,分别考察了柱温为25℃、30℃、35℃时的样品分离效果。结果表明,柱温对乌梅提取物的出峰情况影响比较明显,其中柱温为30℃时的分离效果最好。
(2)流速的考察:用岛津(inertsilods-32.1×150mm2μm)色谱柱,取乌梅冻干粉的供试品溶液,分别考察了流速为0.25ml/min、0.20ml/min、0.15ml/min时的样品分离效果。结果表明,流速对乌梅提取物物质的出峰时间影响较大,但对分离效果影响较小,综合考虑选择0.20ml/min。
(3)色谱柱的考察:取乌梅冻干粉的供试品溶液,先后比较三种不同填料的色谱柱的分离效果,3支色谱柱分别为:1-安捷伦(zorbaxsb-c182.1*150mm,1.8μm)、2-迪马(endeavorsil2.1×150mm,1.8μm)、3-岛津(inertsilods-32.1×150mm2μm)。结果表明,使用岛津(inertsilods-32.1×150mm2μm)的分离度最好,因此选择岛津(inertsilods-32.1×150mm2μm)进行。
相关知识
一种茶提取液及其制备方法与流程
一种青梅精的制备方法与流程
一种绿茶提取物的提取方法与流程
一种高蛋白瘦身代餐粉及其制备方法与流程
一种罗布麻保健茶及其制备方法与流程
减肥片及其制备方法与流程
一种检测贝那鲁肽的分析方法及其血浆样品处理方法与流程
健康检测方法、装置、终端设备及存储介质与流程
一种含有青梅的抗氧化保健食品组合物及其制备方法
一种黑木耳冰淇淋及其制备方法与流程
网址: 一种乌梅提取物的制备方法及其质量检测方法与流程 https://www.trfsz.com/newsview700546.html
推荐资讯
- 1男女激情后不宜做哪些事 4181
- 2从出汗看健康 出汗透露你的健 3839
- 3早上怎么喝水最健康? 3633
- 4习惯造就健康 影响健康的习惯 3283
- 5五大原因危害女性健康 如何保 3187
- 6连花清瘟、布洛芬等多款感冒药 2957
- 7男子喝水喉咙里像放了刀子一样 2455
- 810人混检核酸几天出结果?1 2225
- 9第二轮新冠疫情要来了?疾控中 2219
- 10转阴多久没有传染性?满足四个 2163






