表没食子儿茶素没食子酸酯对健康小鼠肠道菌群及代谢组学的影响
摘 要 表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)被认为是绿茶发挥诸多生理功能的主要成分,其生物利用率低,能到达肠道与菌群发生相互作用。采用健康C57BL/6J小鼠,探究摄入4周EGCG后肠道菌群结构组成和代谢产物的变化。结果显示,EGCG显著增加了Akkermansia等菌属的丰度,显著降低了Mucispirillum菌属的丰度。对Akkermansia菌的促进作用与过往研究中EGCG在肥胖和结肠炎小鼠中的结果一致,证明了EGCG对Akkermansia菌的促进作用与疾病状态无关。EGCG显著提高了短链脂肪酸中乙酸、丙酸和丁酸的含量。粪便非靶向代谢组分析显示,胸腺嘧啶脱氧核苷、2′-脱氧鸟苷、鸟嘌呤、脱氧腺苷等有益于发挥抗病毒和抗癌生理功能的代谢产物含量提高。此外,根据富集的菌属和代谢通路,EGCG被证明具有改善血糖代谢的能力。研究结果表明,健康小鼠摄入4周EGCG能显著影响肠道菌群及代谢物组成,且具有益生功能。
绿茶的食用已被证明具有许多健康益处,这主要归功于绿茶中的主体成分儿茶素。在绿茶中已经确定了5种主要的儿茶素,其中含量最丰富的是表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG),占儿茶素的50%~70%[1]。EGCG是一种黄酮-3-醇多酚类化合物,具有酚类抗氧化性,结构中的6个邻位酚羟基使其具有优于其他儿茶素的许多性质[2]。现有研究多集中于EGCG具有的功能上,例如预防龋病、缓解酒精性脂肪性肝病、抗氧化、抗病毒、诱导肿瘤细胞凋亡等,或者是分析主要成分以及研究药物代谢等,而探究EGCG对肠道菌群影响的研究较少[3]。
肠道菌群参与机体营养物质的消化与吸收,与肠黏膜一起构成的肠道生物屏障能阻止病原体的入侵。肠道菌群与许多代谢疾病如肥胖、Ⅱ型糖尿病等联系密切[4]。肠道菌群受到多种因素的调节,其中膳食成分是影响菌群结构组成最直接且较快速的一种[5]。与其他酚类化合物一样,EGCG的生物利用度很低,消化吸收主要发生在小肠部位,EGCG能与肠道微生物发生相互作用从而影响菌群及代谢物的组成[6]。而肠道微生物与宿主的相互作用是物质发挥生理功能的重要途径之一[7]。
少有的一些关于EGCG与肠道微生物的研究都是基于小鼠疾病模型,还没有研究关注健康小鼠的变化。现有研究发现补充EGCG能在缓解结肠炎[8]和肥胖[9]疾病症状的同时提高肠道中阿克曼氏菌(Akkermansia)的丰度。但这种提高是由于EGCG缓解疾病导致的还是EGCG本身能促进Akkermansia的丰度尚未见报道。因此本研究选用SPF级C57BL/6J健康小鼠,进行为期4周的EGCG补充实验。利用16S rRNA测序、短链脂肪酸(short-chain fatty acids,SCFAs)测定、非靶向代谢物分析、血浆生化分析等分析手段,探究摄入EGCG后,健康小鼠肠道菌群及粪便代谢物的变化。
1 材料与方法
1.1 材料、动物与试剂
EGCG(纯度≥98%),上海创赛科技有限公司。
20只6周龄无特定病原体(specific pathogen free,SPF)级C57BL/6J雄性小鼠,购自北京维通利华实验动物技术有限公司。实验动物饲养于江南大学实验动物中心SPF级屏障中。期间,环境室温控制在23~25 ℃,相对湿度控制在40%~60%,照明制度为标准的12 h光-暗周期循环。
粪便DNA提取试剂盒(Fast DNA SPIN Kit for Feces),美国MP Biomedicals;胶回收试剂盒,德国Qiagen;血浆生化指标所有试剂盒,深圳迈瑞。
葡萄糖、NaCl、H2SO4、无水乙醚、Na2SO4、甲醇、乙腈等其他常见试剂,国药集团化学试剂有限公司。
1.2 仪器与设备
5417离心机,德国Eppendorf;高通量组织破碎仪,宁波新芝;PCR仪,美国Bio-Rad;2000C超微量分光光度计,美国Nano Drop;GC-MS系统、UltiMate 3000 HPLC系统、Q-Exactie质谱仪、真空离心浓缩仪,美国Thermo Fisher Scientific;振荡器,德国IKA;Acc-Check血糖仪,德国罗氏;BS-480生化分析仪,深圳迈瑞。
1.3 实验方法
1.3.1 动物实验
所有操作均按照《江南大学实验动物管理办法》进行,实验经江南大学实验动物福利伦理委员会批准(伦理批准编号:JN.No20201130c0880125[350])。实验动物在进行自由饮食7 d后,随机分为2组,每组10只。制备1 mmol/L的EGCG水溶液,用无菌滤膜(0.22 μm)过滤以保证无菌。实验组(EGCG)每天灌胃0.2 mL/只EGCG水溶液,空白组(Control)灌胃同体积无菌水。灌胃4周后,隔夜禁食,进行口服葡萄糖耐量(oral glucose tolerance test, OGTT)试验。实验结束后,对每只小鼠进行异氟烷麻醉并处死。收集小鼠血液于EDTA抗凝管中,静置30 min后4 ℃、2500×g离心15 min,将上层血浆小心收集到干净的PCR管中。解剖小鼠后,小心取出组织放入液氮中猝灭,随后转移至-80 ℃保存。
1.3.2 粪便DNA提取与16S rRNA测序
按照试剂盒说明书进行粪便DNA的提取,然后以其为模板对细菌的3~4片段进行聚合酶链式反应扩增。正向引物341F(5′-CCT AYG GGR BGC ASC AG-3′),反向引物806R(5′-GGA CTA CNN GGG TAT CTA AT-3′)。利用12%琼脂糖凝胶回收PCR产物,具体步骤按照胶回收试剂盒说明书进行。在Illumina MiSeq PE300平台上进行上机检测,下机数据采用QIIME Ⅱ软件进行分析,参考WANG等[10]的方法进行下机数据的质量控制。
1.3.3 结肠内容物SCFAs含量的测定
小鼠结肠内容物预先冷冻干燥,称取30~50 mg冻干样本,加入500 μL饱和NaCl溶液,均质后加入20 μL 10% H2SO4溶液,用漩涡振荡仪振荡30 s。在通风橱中加入800 μL无水乙醚以萃取SCFAs,振荡均匀后静置30 min提高萃取率。14 000 r/min离心15 min,将上清液转移至装有0.25 g Na2SO4的2 mL离心管中,再以同样的条件离心,取上清液置于气相瓶中待测。采用配备Rtx-WAX毛细管柱的GC-MS系统进行检测,载气He,流速0.89 mL/min。将样品注入GC中,柱温以7.5 ℃/min从100 ℃升至140 ℃,随后以60 ℃/min升温至200 ℃,保持3 min。GC-MS条件:柱头压力62.7 kPa, 分流比10∶1, 离子源温度220 ℃,界面温度250 ℃,扫描范围设置m/z 2~100。
1.3.4 粪便非靶向代谢物的测定
样品前处理:称取20 mg样品转移至1.5 mL离心管中,加入200 μL H2O匀浆,再加入800 μL (甲醇)∶(乙腈)=1∶1(提前-20 ℃预冷)沉淀蛋白,涡旋30 s后超声波处理10 min。放置样本于-20 ℃冰箱孵育1 h,提高蛋白沉淀率(二次沉淀去除蛋白)。4 ℃下,15 000 r/min高速离心20 min,取上清液用旋转蒸发仪蒸干。上机前,加入200 μL (甲醇)∶(水)=4∶1后涡旋30 s复溶,4 ℃下,15 000 r/min高速离心15 min,用0.22 μm滤膜过滤上清液,移取适当体积装入进样小瓶上机检测。质量控制样本制备:从待测样品中移取等量体积至新的进样瓶中。空白样本制备:1 mL (甲醇)∶(水)=4∶1至上样瓶混合均匀。具体的测定过程与参数参考FAN等[11]的方法。
1.3.5 OGTT测定
干预4周后,小鼠禁食不禁水12 h保证空腹状态下进行OGTT。称量体重后,按照2 g/kg的剂量灌胃400 mg/mL的葡萄糖溶液,体重20 g的小鼠灌胃剂量为100 μL。由尾部静脉取血,用Accu-Chck活力型血糖试纸测定空腹血糖值及灌胃后15、30、60、90、120 min的血糖值。根据6个时间点的血糖值计算OGTT的曲线下面积。
1.3.6 血浆生化指标测定
将1.3.1得到的血浆在全自动生化分析仪上检测分析。
1.3.7 数据统计与分析
本文实验数据均以“平均值±标准差”表示,两组间差异用非配对t检验方法进行统计学分析,P<0.05表示具有显著性差异,利用Graph pad Prism 8.3软件进行绘图。在生科云中进行菌群分析(https://www.bioincloud.tech)。在Compound Discoer3.2软件上处理代谢组学数据,并用Microbiome Analyst 进行分析和绘图(https://www.microbiomeanalyst.ca/faces/home.xhtml)。
2 结果与分析
2.1 EGCG对小鼠粪便微生物组成和多样性的影响
如图1-a所示,在门水平上,拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)占据肠道微生物组成的85%以上,且在空白组和EGCG组含量基本一致。剩余15%左右的菌主要是疣微菌门(errucomicrobia)、变形菌门(Proteobacteria)、脱铁杆菌门(Deferribacteres)和放线菌门(Actinobacteria)等。值得注意的是,EGCG组显著增加了errucomicrobia并降低了Deferribacteres。
在属水平上,图1-b展示了相对丰度排名前20的分组柱状图,为了进一步确认关键生物学标志物,进行了LEfSe分析,结果如图1-c所示。相较于空白组,EGCG组阿克曼氏菌属(Akkermansia)(P=0.009)、Muribaculaceae科未分类的属(P=0.023 1)、厌氧棒状菌属(Anaerostipes)、双歧杆菌属(Bifidobacterium)、罗姆布茨菌属(Romboutsia)等丰度显著增加。Mucispirillum菌属(P=0.046 1)、Lachnospiraceae NK4A136 group菌属(P=0.047 8)、理研菌属(Alistipes)(P=0.014 5)、Family Ⅷ UGG-001菌属、Eubacterium xylanophilum group菌属(P=0.034 1)、Eubacterium brachy group菌属、Lachnospiraceae UCG-006菌属等丰度显著降低。
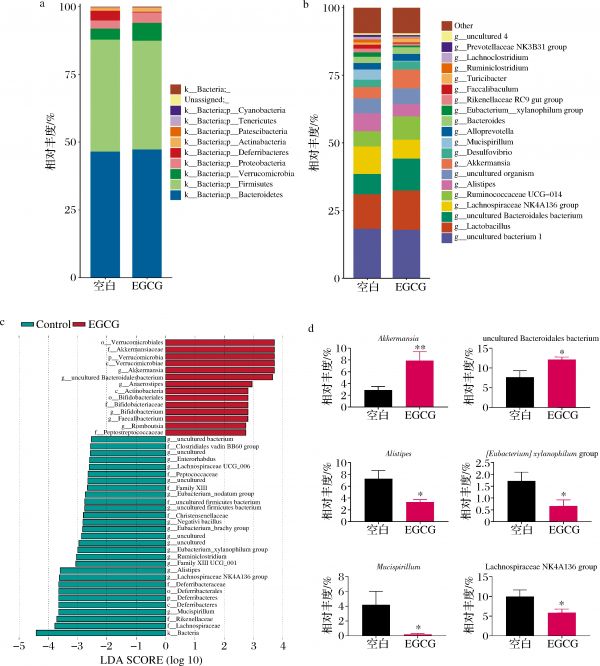
a-门水平丰度柱状图;b-属水平丰度柱状图;c-LEfSe分析结果图;d-属水平单菌丰度图
图1 EGCG对小鼠粪便微生物组成的影响
Fig.1 Effect of EGCG on fecal microbial composition of mice 注:ns 表示没有统计学差异;*表示P<0.05;**表示P<0.01(下同)
图1-d展示了其中6个单菌的丰度,其他的菌属虽然出现了明显的变化,比如Anaerostipes是在空白组中相对丰度为0,摄入EGCG后增殖的一种菌,但因为单菌丰度小于1%,因此没有进行P值的统计和分析,也未在图1-d中展示相对丰度的变化。
Akkermansia是在摄入EGCG后变化最为明显的一种菌,这是一种由DERRIEN等[12]在健康人粪便中分离出来的一种黏液降解菌。Akkermansia既降解黏蛋白获取能量,又刺激宿主分泌黏液、增强黏液层厚度,因此其丰度与肠道屏障和宿主免疫关系密切。近年来。诸多研究证明了Akkermansia可以在糖尿病[13]、肥胖[7]、上皮性肿瘤[14]等多种疾病中发挥益生功能。其主要益生机制是增加黏液层厚度、保护肠道屏障完整性[15]。此前,一些研究发现口服EGCG能在缓解结肠炎[8]和肥胖[9]等疾病的同时提高Akkermansia的丰度。本实验结果证明,EGCG在小鼠健康状态下也能促进Akkermansia的丰度,因此这种促进作用与小鼠的疾病状态无关。近日,一项体外研究证明了EGCG能直接促进Akkermansia丰度的增长[16]。本实验为定向促进体内Akkermansia丰度提供了依据。
Muribaculaceae菌科成员也是黏蛋白单糖的主要利用者,其作为共生菌与其他4个菌株一起可以阻止致病菌艰难梭菌的定植[17],且促进了益生菌Bifidobacterium的增殖。而脱铁杆菌门下脱铁杆菌科中唯一的属——Mucispirillum显著降低。Mucispirillum是一种螺旋形细菌,分布在肠分泌黏液层,被认为具有降解黏液蛋白层的能力。这是一种高致病性的菌株,大量的研究已经将Mucispirillum与炎症性肠病联系起来[18]。总而言之,补充EGCG促进了有益菌丰度的增加,抑制了有害菌的定植,促进了肠道菌群的健康。
接下来使用肠道菌群的多样性(Shannon指数)和丰富度(Chao 1指数)表征α多样性,如图2-a、图2-b所示。EGCG组较空白组Shannon指数无显著差异,即通过加权物种均匀度反映的群落复杂程度未发生改变;Chao 1指数出现显著下降,即物种操作分类单元(operational taxonomic units,OTU)总量下降。这可能是EGCG发挥了其抗菌作用,抑制了一些菌的生长。通过LEfSe分析的结果也可以看到,增加OTU数的物种少于减少OTU数的物种。
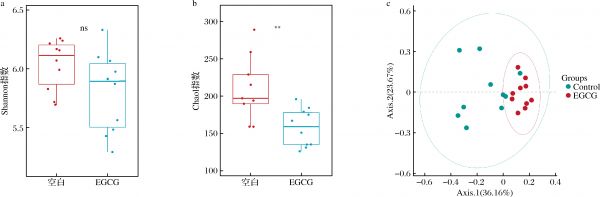
a-Shannon指数;b-Chao 1指数;c-主坐标分析
图2 EGCG对小鼠粪便微生物多样性的影响
Fig.2 Effect of EGCG on fecal microbial diersity of mice
基于Bray-Curtis距离,β多样性用主坐标分析表示。如图2-c所示,空白组小鼠肠道微生物在空间上分布的较为分散,而补充EGCG能显著改变菌落结构,在空间上形成聚集状态。过往的研究结果中,摄入类似的多酚类物质会使空白组和实验组分属在不同的区域,表示微生物组成具有显著性差异[19]。本实验中空白组微生物结构个体间差异较大,分散在了不同的位置。但摄入EGCG 4周后,能明显看到在空间上形成了聚集的状态,表明EGCG能够改变健康小鼠肠道菌群使得组内差异逐渐缩小并与未摄入EGCG的菌群结构具有显著差异。
2.2 EGCG对小鼠SCFAs的影响
EGCG的摄入会改变健康小鼠的肠道菌群,肠道代谢产物可能也会随之发生变化,因此我们测定了靶向代谢组即SCFAs和非靶向代谢组来探究肠道代谢产物的变化。小鼠结肠内容物中主要SCFAs浓度检测结果如图3所示,补充EGCG能显著提高乙酸、丙酸、丁酸浓度(P<0.05),而异丁酸、异戊酸和戊酸虽有升高的趋势,但没有显著性变化。
SCFAs通常是由肠道有益细菌代谢膳食纤维等碳水化合物所产生的代谢物,具有多种有益功能,如阻止有害细菌和病原体的入侵、控制食欲、为结肠细胞提供能量、对抗慢性炎症等作用[20]。过往研究报道Akkermansia可以产生乙酸和丙酸,并且与肠道中产丁酸盐细菌协同合作促进丁酸的产生,从而激活G41和G43蛋白偶联受体,并改善宿主糖脂代谢异常[7]。EGCG的补充促进了产SCFA菌如Akkermansia、Bifidobacterium等菌的增加,虽然我们不能确定其中的因果关系,但乙酸、丙酸、丁酸含量的增加再次证明了补充EGCG有益于健康小鼠的肠道健康,我们猜测Akkermansia丰度的增加可能是出现这一变化的主要原因。
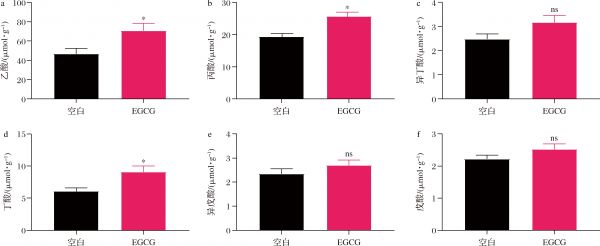
a-乙酸浓度;b-丙酸浓度;c-异丁酸浓度;d-丁酸浓度;e-异戊酸浓度;f-戊酸浓度
图3 EGCG对小鼠结肠SCFA含量的影响
Fig.3 Effect of EGCG on SCFA content in colon of mice
2.3 EGCG对小鼠粪便代谢物的影响
对小鼠粪便进行非靶向代谢物分析,在阳离子和阴离子模式下得到了438个有效峰。基于正交偏最小二乘判别分析(orthogonal partial least-squares discrimination analysis, OPLS-DA),不同组之间明显分离(图4-a),曲线解释率 预测精度Q2=0.827。采用多因素分析与单变量分析相结合的方法对样本组间的差异进行评价。根据OPLS-DA得到的IP值,选择IP>1的代谢物作为潜在的生物标志物,此外采用t检验(P<0.05)和倍数变化(FC>1.2或<0.8)进一步筛选差异物质。最终,有98个变量被确认为组间显著差异的生物标志物,用聚类热图(图4-b)统计了两组间最丰富的前25个代谢物,与空白组相比,实验组中胸腺嘧啶脱氧核苷(thymidine)、2′-脱氧鸟苷(2′-deoxyguanosine)、鸟嘌呤(guanine)、2′-脱氧腺苷(2′-deoxyadenosine)、花生四烯酸乙酯(arachi donic acid ethyl ester)的丰度较高。并进行了KEGG (Kyoto Encyclopedia of Genes and Genomes)通路分析,结果如图4-c所示,两组间差异富集的前3个通路为苯丙氨酸、酪氨酸和色氨酸的生物合成,嘌呤代谢和不饱和脂肪酸的生物合成(P<0.05)。
预测精度Q2=0.827。采用多因素分析与单变量分析相结合的方法对样本组间的差异进行评价。根据OPLS-DA得到的IP值,选择IP>1的代谢物作为潜在的生物标志物,此外采用t检验(P<0.05)和倍数变化(FC>1.2或<0.8)进一步筛选差异物质。最终,有98个变量被确认为组间显著差异的生物标志物,用聚类热图(图4-b)统计了两组间最丰富的前25个代谢物,与空白组相比,实验组中胸腺嘧啶脱氧核苷(thymidine)、2′-脱氧鸟苷(2′-deoxyguanosine)、鸟嘌呤(guanine)、2′-脱氧腺苷(2′-deoxyadenosine)、花生四烯酸乙酯(arachi donic acid ethyl ester)的丰度较高。并进行了KEGG (Kyoto Encyclopedia of Genes and Genomes)通路分析,结果如图4-c所示,两组间差异富集的前3个通路为苯丙氨酸、酪氨酸和色氨酸的生物合成,嘌呤代谢和不饱和脂肪酸的生物合成(P<0.05)。
相比于空白组,EGCG组中显著富集了胸腺嘧啶脱氧核苷、2′-脱氧鸟苷、鸟嘌呤、2′-脱氧腺苷、花生四烯酸乙酯等物质。胸腺嘧啶脱氧核苷是基本核糖核苷中的一种,酸化后是RNA链上的一个基本单元,脱氧后变成DNA的组成部分。在医学上用于乳腺癌、卵巢癌、原发性支气管肺癌和消化道肿瘤等疾病的辅助化疗,能降低肿瘤治疗中DNA的损伤和凋亡;2′-脱氧鸟苷作为一种重要的原料,用来合成抗病毒、抗肿瘤的核酸药物如寡脱氧核苷酸等;鸟嘌呤可以用作抗病毒药物阿昔洛韦中间体;2′-脱氧腺苷可作为重要中间体合成2′-氟-2′-脱氧腺苷、阿昔洛韦、双脱氧腺苷等抗病毒、抗癌、抗艾滋病药物。本研究中显著富集的代谢产物都与抗病毒、抗癌药物有关。EGCG具有的抗病毒、抗癌等功效可能与其生成的代谢产物有关。
代谢通路气泡图(图4-c)显示,苯丙氨酸、酪氨酸和色氨酸的生物合成是显著富集的代谢通路。苯丙氨酸作为一种必需氨基酸,在体内大部分经由羟化酶生成酪氨酸,并且可以跟酪氨酸一起合成重要的激素和神经递质,参与机体糖脂代谢。显著性通路还有不饱和脂肪酸的生物合成。基于这2个与糖代谢和脂肪代谢的通路,对小鼠进行了OGTT以及血浆脂代谢相关指标的测定。

a-OPLS-DA得分图;b-前25个代谢物聚类热图;c-代谢通路气泡图
图4 EGCG对小鼠粪便代谢物判别分析、聚类分析和代谢途径的影响
Fig.4 Effects of EGCG on discriminant analysis, cluster analysis and metabolic pathway of fecal metabolites in mice
2.4 差异菌和差异代谢物的Spearman相关性分析
在之前的分析中用LEfSe分析确定了两组间的差异菌,用OPLS-DA模型筛选出差异代谢物。代谢产物在肠道中的分布取决于肠道菌群的组成和功能,因此,采用Spearman相关性分析来探究属水平差异菌和前30个差异代谢物之间的关系。如图5所示,差异代谢物与差异菌之间具有强相关性。
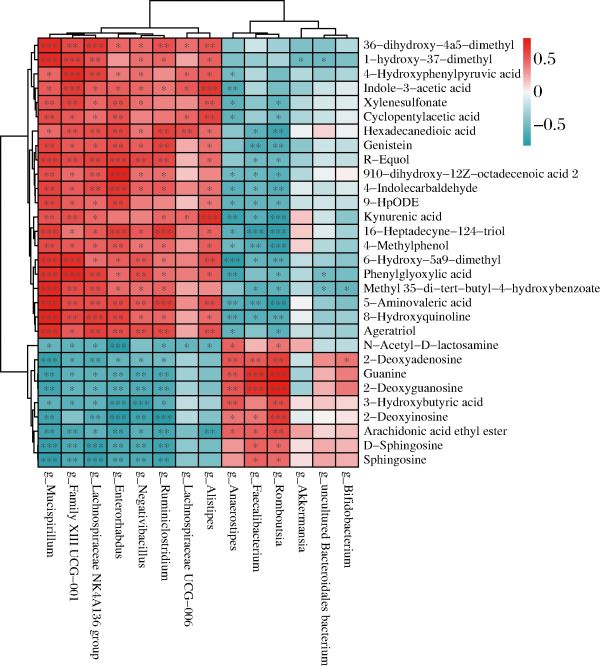
图5 Spearman相关性分析结果聚类热图
Fig.5 Clustering heatmap diagram of the Spearman’s rank correlation analysis
EGCG组显著富集的2′-脱氧鸟苷、鸟嘌呤、2′-脱氧腺苷、花生四烯酸乙酯等物质与Romboutsia属、Faecalibacterium属、Anaerostipes属呈显著正相关。推测EGCG可能通过增加Romboutsia属、Faecalibacterium属、Anaerostipes属的增殖来促进2′-脱氧鸟苷、鸟嘌呤、2′-脱氧腺苷、花生四烯酸乙酯等物质的增加,从而发挥其抗病毒和抗癌的生理功能。
2.5 EGCG对小鼠OGTT和血浆生化指标的影响
补充EGCG显著提高了Akkermansia菌,这是一种被公认与肥胖症状具有负相关的菌,并且在分析代谢物中发现显著富集了与糖代谢和脂肪代谢的相关通路。因此,我们对发现的标志菌和标志代谢物变化可能产生的生理意义通过OGTT和血浆生化指标的测定进行了验证。
根据灌胃葡萄糖0、15、30、60、90、120 min的血糖值绘制了OGTT曲线(图6-a)并计算了线下面积(图6-b)。2组小鼠灌胃葡萄糖15 min后血糖水平急速上升,之后的105 min内血糖水平逐渐下降。空白组灌胃后15、30、60 min的血糖值显著高于EGCG组,90、120 min两组间血糖值无显著差异。说明2组小鼠在2 h内都能恢复正常血糖值,但EGCG组小鼠血糖恢复水平高于空白组。同时,空白组线下面积显著高于EGCG组。可以得出,补充4周EGCG有益于小鼠血糖代谢能力。
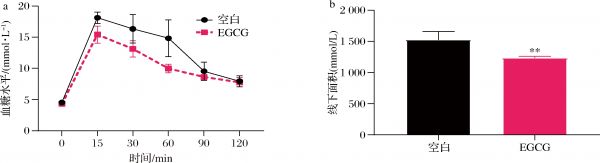
a-OGTT曲线;b-OGTT曲线下面积
图6 EGCG对小鼠葡萄糖耐量的影响
Fig.6 Effects of EGCG on glucose tolerance in mice
如图7所示,补充EGCG显著提高了低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、显著降低了甘油三酯(triglyceride,TG),但总胆固醇(total cholesterol,TC)和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)无显著性差异。总的来说,补充EGCG对小鼠血脂水平影响不大。本研究结果与COLLINS等[21]和刘振云等[22]的研究结果一致,即EGCG具有改善血糖、降低血脂的功能,且本研究验证了这些功能与菌群和代谢物具有潜在关联的生理意义。
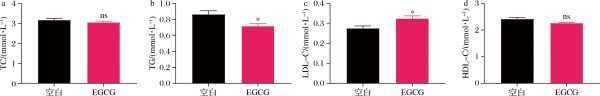
a-血浆TC;b-血浆TG;c-血浆LDL-C;d-血浆HDL-C
图7 EGCG对小鼠血浆生化指标的影响
Fig.7 Effects of EGCG on plasma biochemical indices in mice.
3 结论
本研究对小鼠粪便菌群16S rRNA进行测序,结果证明,EGCG能改变健康小鼠肠道菌群的结构和组成,促进了Akkermansia、Bifidobacterium等有益菌丰度的增加,抑制了Muribaculaceae等有害菌的定植,促进了肠道菌群的健康。EGCG不仅可以促进肥胖和结肠炎疾病模型小鼠体内Akkermansia属丰度的增加[8-9],也能促进健康小鼠体内该菌丰度的增加,结合最近的一项体内实验,为定向促进体内Akkermansia丰度提供了依据。靶向代谢物分析结果表明,EGCG的摄入显著提高了乙酸、丙酸和丁酸的含量,这与产SCFA菌丰度的增加有关。非靶向代谢物分析结果表明,相对于空白组,EGCG组提高了胸腺嘧啶脱氧核苷、2′-脱氧鸟苷、鸟嘌呤、2′-脱氧腺苷等与抗病毒和抗癌药物有关的代谢产物。基于差异菌和差异代谢物之间的Spearman相关性分析,我们推测EGCG可能通过增加Romboutsia属、Faecalibacterium属、Anaerostipes属的增殖来促进2′-脱氧鸟苷、鸟嘌呤、2′-脱氧腺苷等物质的增加,从而有助于发挥其抗病毒和抗癌的生理功能。最后我们重新验证了与差异菌和差异代谢物相关的生理功能,证明EGCG显著改善了小鼠血糖代谢水平。本研究为EGCG发挥健康益处及产品开发提供了科学依据。
参考文献
[1] KHAN N, MUKHTAR H.Tea polyphenols in promotion of human health[J].Nutrients, 2018, 11(1):39.
[2] GAN R Y, LI H B, SUI Z Q, et al.Absorption, metabolism, anti-cancer effect and molecular targets of epigallocatechin gallate (EGCG):An updated reiew[J].Critical Reiews in Food Science and Nutrition, 2018, 58(6):924-941.
[3] 韩晓阳, 陈悦, 杨洋, 等.表没食子儿茶素没食子酸酯的抗感染作用研究进展[J].中国现代应用药学, 2021, 38(20):2 616-2 620.
HAN X Y, CHEN Y, YANG Y, et al.Adances in the anti-infectie effects of epigallocatechin gallate[J].Chinese Journal of Modern Applied Pharmacy, 2021, 38(20):2 616-2 620.
[4] XI Y, XU P F.Diabetes and gut microbiota[J].World Journal of Diabetes, 2021, 12(10):1 693-1 703.
[5] LEEMING E R, JOHNSON A J, SPECTOR T D, et al.Effect of diet on the gut microbiota:Rethinking interention duration[J].Nutrients, 2019, 11(12):2862.
[6] WANG S Z, LI Z L, MA Y T, et al.Immunomodulatory effects of green tea polyphenols[J].Molecules (Basel, Switzerland), 2021, 26(12):3755.
[7] EERARD A, BELZER C, GEURTS L, et al.Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J].Proceedings of the National Academy of Sciences of the United States of America, 2013, 110(22):9 066-9 071.
[8] WU Z H, HUANG S M, LI T T, et al.Gut microbiota from green tea polyphenol-dosed mice improes intestinal epithelial homeostasis and ameliorates experimental colitis[J].Microbiome, 2021, 9(1):184.
[9] SHENG L L, JENA P K, LIU H X, et al.Obesity treatment by epigallocatechin-3-gallate-regulated bile acid signaling and its enriched Akkermansia muciniphila[J].FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2018, 32(12):fj201800370R.
[10] WANG L L, HU L J, XU Q, et al.Bifidobacteria exert species-specific effects on constipation in BALB/c mice[J].Food & Function, 2017, 8(10):3 587-3 600.
[11] FAN Z X, ROSS R P, STANTON C, et al.Lactobacillus casei CCFM1074 alleiates collagen-induced arthritis in rats ia balancing treg/Th17 and modulating the metabolites and gut microbiota[J].Frontiers in Immunology, 2021, 12:680073.
[12] DERRIEN M, AUGHAN E E, PLUGGE C M, et al. Akkermansia muciniphila gen. no., sp. no., a human intestinal mucin-degrading bacterium[J]. International Journal of Systematic and Eolutionary Microbiology, 2004, 54, 1 469-1 476.
[13] DEPOMMIER C, EERARD A, DRUART C, et al.Supplementation with Akkermansia muciniphila in oerweight and obese human olunteers:A proof-of-concept exploratory study[J].Nature Medicine, 2019, 25(7):1 096-1 103.
[14] ROUTY B, LE CHATELIER E, DEROSA L, et al.Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors[J].Science, 2018, 359(6 371):91-97.
[15] REUNANEN J, KAINULAINEN , HUUSKONEN L, et al.Akkermansia muciniphila adheres to enterocytes and strengthens the integrity of the epithelial cell layer[J].Applied and Enironmental Microbiology, 2015, 81(11):3 655-3 662.
[16] XIA Y, ZHANG X X, JIANG M X, et al.In itro co-metabolism of epigallocatechin-3-gallate (EGCG) by the mucin-degrading bacterium Akkermansia muciniphila[J].PLoS One, 2021, 16(12):e0260757.
[17] PEREIRA F C, WASMUND K, COBANKOIC I, et al.Rational design of a microbial consortium of mucosal sugar utilizers reduces Clostridiodes difficile colonization[J].Nature Communications, 2020, 11(1):5 104.
[18] HERP S, DURAI RAJ A C, SALADO SILA M, et al.The human symbiont Mucispirillum schaedleri:Causality in health and disease[J].Medical Microbiology and Immunology, 2021, 210(4):173-179.
[19] ANONYE B O.Commentary:Dietary polyphenols promote growth of the gut bacterium Akkermansia muciniphila and attenuate high-fat diet-induced metabolic syndrome[J].Frontiers in Immunology, 2017, 8:850.
[20] 钟方为, 李庚喜, 曾立.基于肠道菌群和短链脂肪酸代谢探讨绞股蓝总皂苷改善大鼠非酒精性脂肪肝病的实验研究[J].中国中药杂志, 2022, 47(9):2 500-2 508.
ZHONG F W, LI G X, ZENG L.Gynostemma pentaphyllum saponins alleiate non-alcoholic fatty lier disease in rats by regulating intestinal flora and short-chain fatty acid metabolism[J].China Journal of Chinese Materia Medica, 2022, 47(9):2 500-2 508.
[21] COLLINS Q F, LIU H Y, PI J B, et al.Epigallocatechin-3-gallate (EGCG), A green tea polyphenol, suppresses hepatic gluconeogenesis through 5′-AMP-actiated protein kinase[J].Journal of Biological Chemistry, 2007, 282(41):30 143-30 149.
[22] 刘振云, 左高隆, 林勇.茶叶中EGCG改善肥胖大鼠肠黏膜屏障损伤的作用研究[J].茶叶通讯, 2021, 48(3):529-535.
LIU Z Y, ZUO G L, LIN Y.Effects of EGCG in tea on improing intestinal mucosal barrier injury in obese rats[J].Journal of Tea Communication, 2021, 48(3):529-535.
相关知识
百趣代谢组学分享:黑木耳多糖对小鼠肠道微生物及代谢表型的影响
茶叶活性成分调节肠道菌群影响脂质代谢
Protein & Cell:肠道菌群及其代谢物在代谢性疾病中的作用
:肠道菌群及其代谢产物:膳食营养素与肥胖相关疾病的桥梁
辐射威胁:揭示辐射对人体健康和肠道菌群的影响及防护
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
肠道菌群与健康:探究发酵食品、饮食方式、益生菌和后生元的影响
肠道3M:微生物组、代谢和代谢组,从基础走向未来
谷物调节肠道菌群,促进代谢健康
环境污染对肠道菌群和免疫系统的影响
网址: 表没食子儿茶素没食子酸酯对健康小鼠肠道菌群及代谢组学的影响 https://www.trfsz.com/newsview709662.html
推荐资讯
- 1男女激情后不宜做哪些事 4181
- 2从出汗看健康 出汗透露你的健 3839
- 3早上怎么喝水最健康? 3633
- 4习惯造就健康 影响健康的习惯 3283
- 5五大原因危害女性健康 如何保 3187
- 6连花清瘟、布洛芬等多款感冒药 2957
- 7男子喝水喉咙里像放了刀子一样 2455
- 810人混检核酸几天出结果?1 2225
- 9第二轮新冠疫情要来了?疾控中 2219
- 10转阴多久没有传染性?满足四个 2163