顶刊综述
编译:微科盟小木,编辑:微科盟茗溪、江舜尧。
微科盟原创微文,欢迎转发转载,转载须注明来源《微生态》公众号。
导读
从免疫调节到药物代谢,肠道微生物群在宿主生理的各个方面都发挥着作用。肠道微生物群组成的变化与各种疾病及其对药物的反应有关。因此,了解不同的生活方式和环境因素如何塑造肠道微生物群的组成至关重要。除了一般认为的饮食因素外,小分子药物最近已被确定为微生物群组成的主要影响因素。其他外源性物质(如环境或化学污染物)也可以影响肠道细菌群落。本文综述了肠道细菌与抗生素、宿主靶向药物、天然食品化合物、食品添加剂和环境污染物的相互作用机制。虽然外源性物质可以影响细菌的生长和代谢,但细菌反过来可以对这些化合物进行生物积累或化学修饰。这些相互作用可以在复杂的外源性物质-微生物群-宿主关系中表现出来。本综述强调需要研究与污染物和食品添加剂相互作用的潜在机制,以破译肠道微生物群的动态和进化。
论文ID
原名:Multimodal interactions of drugs, natural compounds and pollutants with the gut microbiota
译名:药物、天然化合物和污染物与肠道微生物群的多模式相互作用
期刊:Nature Reviews Microbiology
IF:78.297
发表时间:2022.1
通讯作者:Kiran R. Patil
通讯作者单位:英国剑桥大学医学研究理事会毒理学组
DOI号:10.1038/s41579-022-00681-5
综述目录
1 前言
2 外源性物质和肠道微生物组成
2.1 抗生素的附带损害
2.2 人类靶向药物引起的特异性改变
2.3 天然食品成分和食品添加剂的作用
2.4 农药和其他污染物的影响
3 外源性物质-细菌相互作用机制
3.1 外源性物质抑制生长
3.2 外源性物质促进生长
3.3 外源性物质调节细菌代谢
3.4 外源性物质对病毒组和毒力的影响
3.5 肠道细菌代谢外源性物质
3.6 肠道细菌的外源性生物累积
4 外源性物质混合物
5 结论及未来展望
主要内容
1 前言
肠道微生物群是人体最大的微生物群落,其生理重要性在其形式和功能上都是显而易见的。一个典型的成年微生物群中估计有3.8×1013个细菌,超过了人类体细胞的数量,占总体重的比例约为200克。在遗传水平上,肠道微生物群包含的基因大约是人类基因组的30倍,代表着巨大的代谢能力。事实上,肠道微生物群参与多种宿主功能,包括食物消化、解毒、内分泌功能、神经信号、免疫调节和病原体防御。肠道细菌在这些功能中的重要作用反映在肠道微生物群组成与炎症性肠病、癌症、肥胖、2型糖尿病、心脏代谢疾病和神经系统疾病等疾病之间的联系上。肠道微生物群与生理和健康的紧密联系主张将肠道微生物群视为人体器官。
这个充满微生物的超器官与身体其他部位之间的相互作用在很大程度上取决于其微生物组成,主要是通过分泌的代谢物。近年来,各种综述描述了微生物代谢产物对宿主生理的影响,例如,显示了短链脂肪酸如何与2型糖尿病和神经障碍等疾病相关。大约68%的肠道代谢组可以用微生物组成来解释,在血液中检测到许多与细菌相关的代谢物。因此,了解各种内在和外在因素如何影响肠道细菌及其代谢至关重要。虽然已经查明了若干这样的因素,但对其影响的程度和机制基础了解甚少。已知的内在因素包括宿主基因组成、年龄、性别和排便(图1a);外部影响包括饮食、酒精消费、药物和其他环境因素(图1b)。尽管在解释肠道微生物群变异方面,预计环境因素已超过了遗传差异,但由于许多混杂因素,影响程度大小的确定仍然很困难。然而,已证明药物对微生物群的变化有很大的影响。二甲双胍就是一个很好的例子,二甲双胍是一种广泛用于2型糖尿病治疗的药物;研究发现,与药物相关的微生物群变异比仅与疾病相关的微生物群变异更明显。此外,与大多数内在因素相比,外在因素(如饮食和药物)是可以改变和适应的。因此,了解环境和肠道微生物群之间的相互作用将对设计改善健康和精准医疗的策略至关重要。
环境因素(如饮食和药物)与肠道微生物群之间的相互作用是双向的。饮食和药物可以改变微生物组成,反过来,肠道细菌可以化学转化这些化合物 (图1c);例如用于治疗心血管疾病的地高辛和用于治疗帕金森病的左旋多巴。一些研究还表明环境污染物和其他外源性物质(包括农药、重金属和亚硝胺)对肠道微生物的影响与这些化合物的活化、失活和毒性有关。
通过皮肤接触、吸入或摄入,每天都会发生外源性物质接触。我们可以通过补充剂或药物或通过受污染的食物和水不自觉地摄入外源性物质。肠道微生物群可以在吸收之前或之后与摄入的化合物相互作用。口服或摄入的物质要么被小肠吸收并在肝脏中代谢,要么通过小肠进入结肠,在那里它们可以被肠道微生物群代谢,相当于“第二个肝脏”。此外,之前吸收的物质或通过不同暴露途径进入体内的物质,可以通过胆道分泌循环回到肠道,并与肠道微生物群相互作用。许多不同种类的细菌都有可能与外源性物质相互作用,而特定化合物的影响和代谢程度往往取决于肠道微生物群的组成。考虑到肠道微生物群可能接触大量外源性物质(>25,000)(图2;补充表1),了解外源性物质-微生物群相互作用的程度和性质对于揭示个体间和个体内微生物群变异、动态和进化的机制基础至关重要。
本篇综述讨论了广泛接触的外源性物质对肠道微生物群组成的影响,并重点介绍了已知的外源性物质-肠道细菌相互作用模式。这些化合物可分为四类:(1)抗生素,(2)宿主靶向药物,(3)天然食品化合物和食品添加剂,(4)环境污染物和化学品。通过多种实验方法揭示的相互作用涵盖了体内相关性以及机制见解。我们尽可能关注直接相互作用和分子机制,并涵盖比之前综述范围更广的外源性化合物。
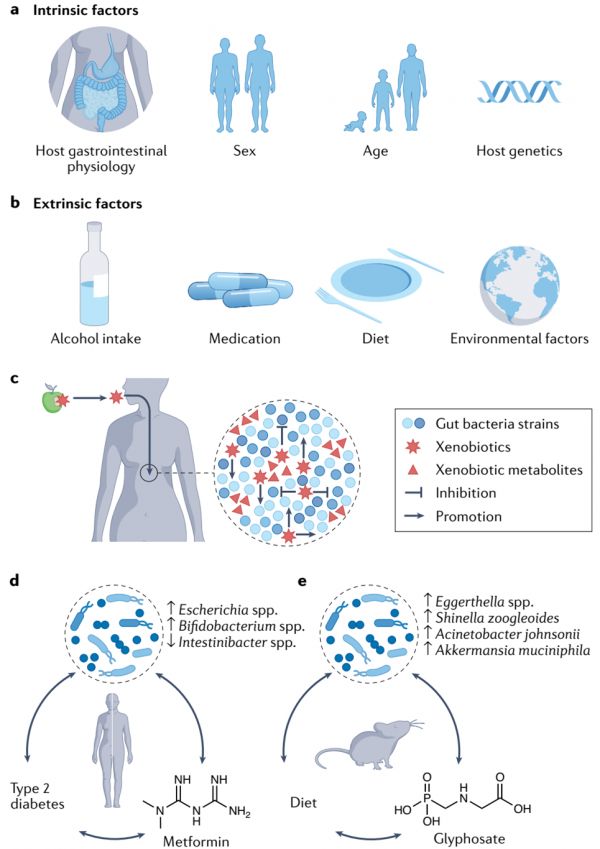
图1 肠道微生物群与外源性物质的相互作用。
a 影响肠道微生物群组成的内在因素包括宿主胃肠道生理、性别、年龄和宿主遗传等。b影响肠道微生物群组成的外部因素包括酒精摄入、药物、饮食和其他环境因素。c摄入的外源性抗生素可以通过抑制或促进细菌的生长来影响肠道微生物群的组成。反过来,细菌可能代谢外源性物质,从而改变它们在宿主中的活性。d二甲双胍是治疗2型糖尿病的一种常用药物,它会影响肠道微生物群的组成。这种组成的改变至少在一定程度上与二甲双胍治疗的抗糖尿病作用有关。e由于食品污染而摄入的农药草甘膦会改变肠道微生物群的组成。
2 外源性物质和肠道微生物组成
2.1 抗生素的附带损害
抗生素对肠道微生物群有很强的短期影响,并导致多种细菌菌株的细胞损伤。对广谱抗生素利福昔明、环丙沙星、甲硝唑和万古霉素的体外和人体研究表明,它们在减少总微生物量以及α多样性和丰富度方面具有深远的短期影响。此外,这些研究表明,肠道微生物群的组成发生了巨大的变化,拟杆菌门(Bacteroidetes)减少,厚壁菌门(Firmicutes)增加,包括拟杆菌属(Bacteroides)和粪杆菌属(Faecalibacterium)在内的几个属的丰度减少,产生短链脂肪酸丁酸的属也大幅减少(相对丰度从27%下降到0.3%),这表明抗生素可能会破坏肠道微生物群的规模。
除了短期影响外,抗生素还与肠道微生物组成的长期变化有关。环丙沙星和克林霉素可减少物种丰富度并改变微生物组成,包括拟杆菌属的减少和粪杆菌属与Alistipes的增加,持续时间可达12个月。因此,肠道微生物群恢复到干预前水平取决于抗生素化合物和宿主特异性因素,如基线微生物群组成。抗生素对共生生物的负面影响可以为低丰度物种(有时甚至是病原体)打开一个生态位。一项在接受美罗培南、庆大霉素和万古霉素混合物治疗的健康男性中进行的研究发现,肠道细菌和其他致病菌大量繁殖,双歧杆菌(Bifidobacterium)和其他产丁酸菌减少,这被认为可以抵御病原菌。这些研究强调,抗生素治疗对微生物群的损害可能会通过减少有益代谢物的产生或通过打开病原菌的生态位进一步对宿主产生负面影响。
2.2 人类靶向药物引起的特异性改变
与抗生素相比,人类靶向药物是一个更大、更多样化的药物组。一些药物,如抗糖尿病药和抗抑郁药的使用时间往往比抗生素长得多,甚至是终生使用。由于在宿主靶向药物的开发过程中很少考虑与细菌的相互作用,因此它们对肠道微生物群组成的影响比抗生素更出人意料,研究也更少。二甲双胍是为数不多的例子之一(图1d),已证明二甲双胍可能通过调节金属稳态影响肠道微生物群中的微生物物种丰度和代谢通路。事实上,与未经治疗的患者相比,接受二甲双胍治疗的2型糖尿病患者的肠道微生物群组成显著不同,大肠杆菌属(Escherichia spp.)增加,Intestinibacter spp.减少,这一差异之前被错误地与疾病状态联系在一起。此外,已证明这种改变的微生物群组成在一定程度上有助于二甲双胍的抗糖尿病作用。例如,与二甲双胍治疗前接受2型糖尿病患者粪便移植的小鼠相比,接受二甲双胍治疗的患者粪便移植的无菌小鼠的糖耐量有所改善,但机制尚不清楚。除了这个众所周知的例子,最近的一项meta分析显示,17种药物与单个微生物类群的水平相关,其中质子泵抑制剂、抗糖尿病药物(二甲双胍)和泻药与微生物类群的相对丰度相关性最强。其他宿主靶向药物对肠道微生物的影响也被注意到,如抗精神病药、他汀类药物、受体阻滞剂和血管紧张素转换酶(ACE)抑制剂。越来越多的证据表明,多种宿主靶向药物可以以药物依赖性方式改变肠道微生物群的组成,因此,需要考虑这些相互作用在微生物群动态和药物反应中的作用。
2.3 天然食品成分和食品添加剂的作用
大量营养素和微量营养素都会影响肠道微生物群的组成。除此之外,食物中天然存在的化合物的数量是巨大的。FooDB是最大的食品成分、化学和生物学资源库,列出了超过55,000种天然化合物。已显示影响肠道微生物群组成的天然存在的外源性物质包括植物化学物质;已证明橄榄、甘菊、肉桂和生姜的草本提取物会影响肠道微生物组成。这些提取物的共同作用是抑制大肠杆菌属(Escherichia)和志贺菌属(Shigella),这与胃肠道失调有关,并有利于产生丁酸的粪球菌属(Coprococcus)和丁酸单胞菌属(Butyricimonas)的生长。此外,单一的天然外源性化合物,如姜黄素,也被证明可以改变几种肠道细菌的丰度。姜黄素是姜黄中的一种主要成分,其消费量与梭菌属(Clostridium)和拟杆菌(Bacteroides)的增加以及Blautia和瘤胃球菌属(Ruminococcus)的减少有关。茶多酚增加了与益生菌功能相关的双歧杆菌物种,减少了拟杆菌和普雷沃氏菌(Prevotella),而在一些植物中发现的生物碱小檗碱则减少了单形拟杆菌(Bacteroides uniformis)的丰度。
除了天然食品成分外,食品添加剂也可能与肠道微生物组成相互作用并形成肠道微生物群。人工甜味剂和乳化剂是使用最广泛的食品添加剂。商业上可获得的甜味剂代糖、糖精和三氯蔗糖以及乳化剂羧甲基纤维素和聚山梨醇酯-80已被证明能促进小鼠肠道微生物群组成的变化和失调。这些变化包括三氯蔗糖导致的厚壁菌门减少和双歧杆菌属增加,代糖导致的变形菌门增加和大肠杆菌过度生长,以及糖精导致的拟杆菌门增加和梭菌目减少,这与2型糖尿病有关。此外,羧甲基纤维素和聚山梨醇酯-80均能促进炎症反应,降低微生物群落多样性,并与拟杆菌目相对丰度的增加和梭菌目相对丰度的减少有关。
2.4 农药和其他污染物的影响
人类在无意中消耗了大量的环境污染物,如农药、环境化学品、加工污染物、霉菌毒素和重金属(图2)。迄今为止,这些污染物对人类微生物群的影响尚未得到彻底的研究。然而,暴露于各种环境污染物与肠道微生物群组成的变化有关。
农药,包括杀虫剂、杀菌剂和除草剂,在食品生产中广泛使用,因此是食品污染物的主要类别。2018年,美国食品和药物管理局(FDA)和欧洲食品安全局(EFSA)分别在食品中检测出212种和358种不同的农药残留。此外,2020年,英国食品农药残留问题专家委员会在2460份食品样本中检测出123种农药残留,42%的样本中至少含有一种农药残留。最近的一项研究在英国双胞胎队列(n=130)中筛查了186种农药,在所有尿液样本中检测到拟除虫菊酯和/或有机磷杀虫剂。例如,>96%的样品中检测到拟除虫菊酯氯氰菊酯和氯菊酯,75%的样品中检测到有机磷酸二乙酯。草甘膦是唯一检测到的除草剂,存在于53%的样本中,这突显出人类暴露于污染物的情况普遍存在,因此肠道微生物群也可能接触污染物,应进行系统调查。各种类型的农药已被证明会影响肠道微生物群的组成和与微生物群相关的代谢物,如短链脂肪酸、胆汁酸和三甲胺。一项对小鼠的研究报告称,与肠道微生物群的相互作用可能会导致有机磷酸盐的不良反应,如糖耐量降低。
毒死蜱和草甘膦是最广泛使用的有机磷酸盐之一,它们都与啮齿类动物肠道微生物群组成的变化有关。即使在与膳食暴露相关的低浓度(1-3.5 mg/kg/天)下,毒死蜱和草甘膦暴露也会导致大鼠肠道微生物群组成的改变。最近的另一项研究采用多组学方法研究了草甘膦对大鼠肠道微生物群和代谢组的影响(图1e),结果显示草甘膦暴露不仅导致Eggerthella spp.、Shinella zoogleoides、Acinetobacter johnsonii和Akkermansia muciniphila的相对丰度增加,还导致肠道代谢物水平的变化,表明肠道细菌中的莽草酸途径受到抑制,这是草甘膦作为除草剂的主要机制。由于莽草酸途径不存在于人和动物细胞中,草甘膦通常被认为是安全的。然而,人类肠道微生物群中这一途径的抑制对宿主健康的影响尚不清楚。然而,这些发现表明,在评估农药和其他环境化学品对健康的不利影响时,需要考虑肠道微生物群中的生化途径。
N-亚硝胺因其致癌和毒性被认为是一类重要的环境污染物。N-亚硝胺是一种多样的化学物质,包括300多种不同的化合物。据估计,每人每天接触N-亚硝胺的总剂量在1900-25,000 ng之间,具体取决于生活方式的选择,烟草制品的消费造成的接触剂量最高(~22,000 ng/天),其次是食物(~1,900 ng/天)、酒精饮料(~1,000 ng/天)和饮用水(~120 ng/天)。此外,近年来,药物中的N-亚硝胺含量超过每日26.5 ng的可接受摄入量,导致FDA召回超过1,400种产品,例如二甲双胍和降压药缬沙坦。虽然饮用水中高浓度的各种N-亚硝胺(mg/L)已被证明在啮齿类动物模型中具有致癌性,但人类对单一N-亚硝胺的暴露通常要低几个数量级(ng/L),因此尚未进行广泛的研究。一项在雄性大鼠中以环境相关剂量补充N-亚硝胺混合物的研究显示,微生物群的组成明显向致肥胖模式转变。这一转变包括厚壁菌门与拟杆菌门的比例增加,以及Alistipes和Ruminococcus属的富集。此外,补充亚硝胺二氯乙腈会影响微生物群落组成和微生物代谢物丰度,包括参与鞘脂信号通路和脂肪酸生物合成的代谢物。这些结果表明,N-亚硝胺在与人体接触相关的浓度(ng/L)下可能会影响微生物群组成和宿主健康。
霉菌毒素是有毒的真菌次级代谢物,是食物中的污染物。已经确定了300多种不同的霉菌毒素,其中一些经常在食物中发现,如黄曲霉毒素、赭曲霉毒素、伏马菌素、棒曲霉素、玉米赤霉烯酮和单端孢霉烯。最近对EFSA和其他大型全球调查数据的文献回顾和分析估计,超过60%的食品样品中含有霉菌毒素,其中20%的霉菌毒素水平超过了欧盟的监管限制水平。一项对小鼠的研究表明,赭曲霉毒素处理(210 μg/kg体重)导致微生物群落多样性减少和乳杆菌属(Lactobacillus)丰度增加,这已被证明在赭曲霉毒素解毒中发挥作用。此外,一项将小鼠暴露于与人体估计摄入量(10 μg/kg体重)相关的剂量下9个月的研究也显示,几个细菌门、科和属的丰度发生了变化,包括双歧杆菌属减少和臭杆菌属(Odoribacter)增加,这与肠道炎症有关。这些研究结果表明,需要考虑霉菌毒素与肠道微生物群的相互作用及其对宿主健康的影响。
重金属也是食品和饮用水中常见的污染物。人体肠道微生物群有助于控制和吸收这些有毒金属。例如,肠道微生物群已被证明可以保护老鼠免受砷中毒。与抗生素处理或无菌小鼠相比,具有天然肠道微生物群的小鼠在器官中积累的砷更少,在粪便中排泄的砷更多,这表明肠道微生物群在介导重金属毒性方面可能至关重要。反过来,重金属暴露也会影响肠道微生物群的多样性和组成。镉、砷、铜、铅和铝暴露都与肠道微生物群在门和属水平上的组成改变有关,并导致多样性降低。此外,锌暴露不仅会影响小鼠肠道微生物群的组成,还会增加艰难梭菌(Clostridioides difficile)感染的易感性和疾病的严重程度,这凸显了了解重金属对肠道微生物群影响的重要性。
兽用抗生素和药物的残留也可能污染食品,特别是动物产品。2018年,EFSA发现,354,517个肉类、鸡蛋、牛奶和蜂蜜样品中有0.3%不符合欧盟规定,并且超出了外源性物质残留允许限度。这些不合格的样品含有兽药,如抗菌剂和具有合成代谢作用的物质。尽管这些残留物的摄入浓度远低于用于治疗的药物,但它们也可能影响肠道微生物群的组成,这需要进一步研究。
其他几种食品污染物,包括食品接触材料、植物毒素或工业化学品,在食品生产、包装或制备过程中都可能进入我们的食品。正如上述示例所强调的,不同种类的污染物有可能改变体内肠道微生物群的组成,这强调了在其安全性评估中需要考虑微生物群介导的对健康的影响。
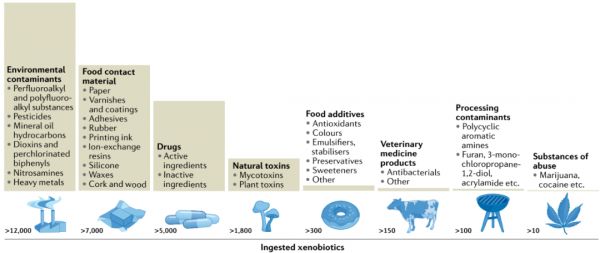
图2 外源性物质摄入的概述。
通过我们的饮食,我们消耗了大量的天然化合物。FooDB是食品成分、化学和生物学的最大资源库,列出了797种不同的食品,其中含有15,750种已检测到的天然化合物,以及55,176种预测的化合物。除了食物中存在的天然化合物外,我们每天还会摄入许多其他的外源性物质,其中许多还不为人知。图表并不全面,旨在概述可能定期摄入的各种外源性物质的范围。所示信息来自多个不同的数据库,可在补充表1中找到。此外,并不是每个人在其一生中都将接触到上述所有的外源性物质,接触情况因生活方式、职业和地理位置而异。
3 外源性物质-细菌相互作用机制
人类队列和动物研究已经证明了外源性物质的摄入与微生物群组成和功能之间的众多关联。然而,了解其潜在机制对于将这些发现应用于健康环境至关重要,需要在物种和菌株水平上进行深入调查。目前为止,已经描述了六种主要的外源性物质-肠道细菌相互作用模式,并进行了概述(图3, 4;表1)。
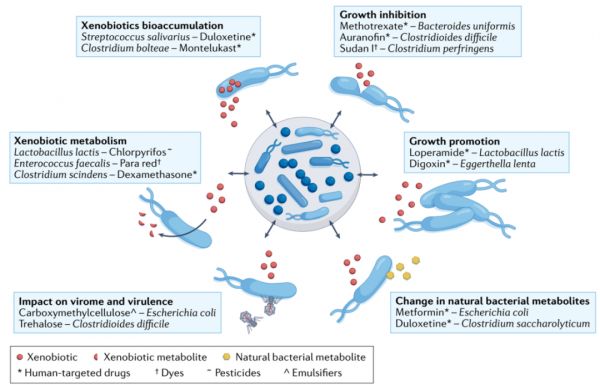
图3 外源性物质-肠道细菌相互作用。
已知外源性物质与肠道微生物群之间有六种相互作用模式:外源性物质抑制细菌生长、外源性物质促进细菌生长、外源性物质引起细菌自身代谢的变化、外源性物质对细菌病毒组和毒力的影响、细菌的外源性代谢和细菌的外源性生物积累。通过抑制或促进某些细菌的生长或干扰细菌的自身代谢,外源性物质直接有助于塑造肠道微生物群的组成及其代谢功能。此外,肠道细菌可以代谢或生物积累外源性物质,从而改变其活性或毒性。这种代谢或生物积累取决于肠道微生物群的组成,而产生的外源性物质代谢物反过来又会影响肠道微生物群的组成。所有的相互作用都可能以各种组合发生,并取决于肠道微生物群的组成。(更多外源性物质-细菌相互作用的例子见表1)。
3.1 外源性物质抑制生长
最常报道的相互作用模式是外源性物质对细菌生长的抑制。在一项大规模的体外实验中,144种抗生素中有78%对40种被测肠道细菌菌株中的至少一种显示出抗菌活性,其中许多菌株是人类肠道的常见成员,如普通拟杆菌(Bacteroides vulgatus)和单形拟杆菌(B. uniformis)。大多数抗生素影响几种菌株,没有确定的特异性模式。同一项研究发现,在835种人类靶向药物中,24%对40种测试菌株中的至少1种有效。与抗生素相比,这些人类靶向药物影响的菌株数量都更少,这凸显了它们的特异性作用,而不是抗生素的广泛附带损害。这一发现表明,人类靶向药物比抗生素更能靶向细菌细胞内的特定途径,而抗生素可能只存在于特定的菌株中。但这项体外筛选发现,人类靶向药物会影响健康人类肠道中常见的几种物种,这支持了队列研究中观察到的群落规模影响。例如,二甲双胍通过抑制叶酸代谢来影响大肠杆菌的生长。此外,抗精神病药氯丙嗪和抗抑郁药阿米替林已被证明可以抑制由ArcB转运体介导的外排,这是一种常见的耐药介质。
与食物有关的外源性物质也被证明可以抑制细菌的生长。人工甜味剂三氯蔗糖、糖精和安赛蜜对大肠杆菌HB101和K-12的生长有抑制作用。此外,一项体外研究观察了7种香料提取物(黑胡椒、辣椒、肉桂、生姜、牛至、迷迭香、姜黄)对88种不同菌株的影响,发现至少部分受试香料抑制了所有4种受试瘤胃球菌(Ruminococcus)和一些Fusobacterium和Clostridium的生长。
其他对肠道细菌生长有不良影响的食品污染物包括染料、霉菌毒素和持久性有机污染物。染料苏丹红I、II、III、IV和Para Red对11种肠道菌株中至少1种具有生长抑制作用。最近的一项研究表明,链格孢霉毒素(一种有毒的真菌代谢物)的复合提取物能够抑制多种细菌菌株的生长,如丰富的B. vulgatus菌株。此外,4种持久性有机污染物(2,3,7,8-四氯二苯并呋喃(TCDF)、2,3,7,8-四氯二苯并对二噁英(TCDD)、多氯联苯PCB-123和PCB-156))在0.6和6 μM浓度下对六种细菌中的长双歧杆菌(Bifidobacterium longum)表现出显著的生长抑制作用。这些例子表明,抑制肠道细菌的生长可能是多种外源性物质的共同特征。
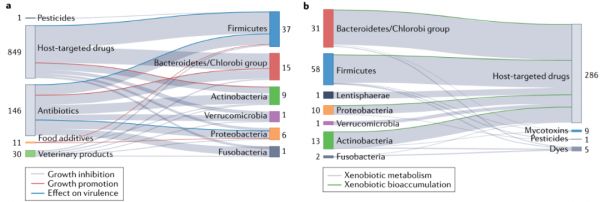
图4 物种水平上研究外源性物质-肠道细菌相互作用的概述。
a 外源性物质对细菌生长促进或抑制及对细菌毒力的影响。b肠道细菌菌株的外源性生物转化或生物积累。与生长抑制和生物转化相比,生长促进和外源性生物积累只是最近才开始被评估,因此,其代表性还不足。迄今为止的研究还主要集中在抗生素和宿主靶向药物上,而忽略了环境污染物等其他外源性物质。此图中的信息是由系统屏幕编译而成的(补充表2)。旁边的数字表示每一类化合物的数量,而细菌门旁边的数字表示已在实验中证明了外源性物质-物种关系的细菌种类的数量。
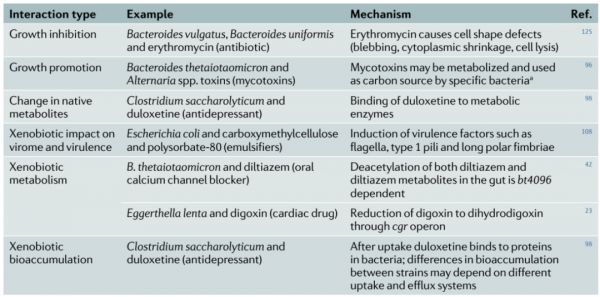
表1 外源性物质-肠道细菌相互作用的示例。
3.2 外源性物质促进生长
一项体外研究调查了7种香料提取物对88种细菌的影响,发现至少有1种香料提取物促进了所有33种受试双歧杆菌和乳杆菌菌株的生长。此外,另一项研究发现,一些药物也可能促进某些细菌种类的生长,如孟鲁司特促进B. uniformis和洛哌丁胺促进乳酸乳球菌(Lactococcus lactis)。后者是一个有趣的观察结果,因为洛哌丁胺被用于治疗腹泻,而L. lactis是一种益生菌,有时也被用来治疗这种疾病。在低浓度(0.5 μg/mL)条件下,链格孢霉毒素复合提取物也能促进Bacteroides caccae和Bacteroides thetaiotaomicron的生长。此外,还发现持久性有机污染物TCDD在6 μM浓度下对副干酪乳杆菌(Lactobacillus paracasei)的生长有轻微的促进作用。
生长抑制比生长促进更常见:在375种药物-细菌相互作用中,15种抑制生长,只有5种促进生长;56种不同浓度的链格孢毒素-细菌相互作用中,17种在高浓度(50 μg/mL)或低浓度(0.5 μg/mL)下表现出生长抑制作用,只有2种在低浓度下表现出促生长作用;24种持久性有机污染物-细菌相互作用中,4种抑制生长,1种促进生长。也有综述表明,不同的天然外源性物质或食品添加剂具有促生长作用;然而,大多数研究是在复杂的微生物群落中进行的,这使得很难评估单一物种的生长效果。此外,对促进生长机制的研究和了解较少。一种可能的解释是,外源性物质为细菌提供了营养来源。例如,已证明肺炎克雷伯氏菌(Klebsiella pneumoniae)和弗格森埃希氏菌(Escherichia fergusonii)使用抗生素氯霉素作为碳源。综上,与抑制作用相比,外源性物质促进生长的报道较少(图4),但当相关细菌对群落生态或功能至关重要时,它可能在群落环境中发挥关键作用。
3.3 外源性物质调节细菌代谢
除了影响生长,一些外源性物质也被证明改变肠道细菌的新陈代谢。尽管越来越多的证据强调细菌代谢的重要性,但细菌代谢如何影响药物治疗和宿主健康的知识仍然有限。有几项研究报道了外源性物质给药后粪便代谢组的变化,但只有很少的研究在单一菌株水平上进行了研究。研究二甲双胍作用机制的研究报告称,二甲双胍不仅影响细菌叶酸和蛋氨酸代谢,还改变了中枢途径,包括上调三羧酸循环和下调糖酵解和精氨酸降解。此外,最近的一项研究对六种与抗抑郁药物度洛西汀一起孵育的菌株进行了代谢产物分析。其中,解糖梭菌(Clostridium saccharolyticum)、植物乳杆菌(Lactiplantibacillus plantarum)、大肠杆菌和乳酸乳球菌(L. lactis)的胞外代谢产物丰度发生了显著变化。
特别是C. saccharolyticum,其外代谢组发生了很大的变化,包括氨基酸和核苷酸相关通路的变化。这也被证明与通过代谢交叉喂养的群落组成有关,如直肠真杆菌(Eubacterium rectale)的间接增加所示。除了药物,咖啡中发现的一种生物碱——天然的外源性物质葫芦巴碱也显示出改变细菌代谢的潜力。弗氏柠檬酸杆菌(Citrobacter freundii)与葫芦巴碱在富含胆碱的培养基中孵育可显著减少三甲胺的生成,三甲胺可在体内转化为促动脉粥样硬化代谢物氧化三甲胺。总之,最近的研究提出,调节细菌代谢是外源性物质-细菌相互作用的基本模式之一。
3.4 外源性物质对病毒组和毒力的影响
近年来,外源性物质对肠道病毒组和肠道细菌毒力的影响是近年来日益受到关注的一种相互作用模式。肠道病毒群以噬菌体为主,噬菌体是可以感染细菌的病毒,从而改变细菌的丰度和代谢。最近的一项研究表明,包括抗生素丝裂霉素、化疗药物氟达拉滨和心脏药物地高辛在内的几种药物可导致人类肠道细菌分离物中的原噬菌体诱导,表明噬菌体介导的作用可能会改变肠道微生物群的组成。此外,乳化剂羧甲基纤维素和聚山梨醇酯-80已被证明通过直接诱导黏附侵袭性大肠杆菌中与毒性相关的基因(如鞭毛、1型菌毛和长极性菌毛的毒力因子)来促进慢性炎症。膳食海藻糖也被证明会增加艰难梭菌菌株RT027和RT078的疾病严重程度和毒力,这可能通过增加毒素的产生来实现。此外,人工甜味剂糖精、三氯蔗糖和阿斯巴甜已被证明能增加体外模型肠道细菌大肠杆菌NCTC10418和粪肠球菌ATCC19433粘附、侵入和杀死宿主上皮的能力,这被认为与毒力因子的表达增加有关。这些例子表明,在研究外源性物质、肠道微生物群和宿主之间的关系时,不仅要考虑微生物群,而且还要考虑病毒组的重要性。
3.5 肠道细菌代谢外源性物质
肠道细菌对药物的酶促修饰(生物转化或代谢)是一种众所周知且被广泛认可的相互作用模式。最近一个著名的例子是心脏药物地高辛,它在药物反应中显示了微生物群依赖性的有效性。体外和小鼠研究已经证明,只有Eggerthella lenta的特定菌株(例如DSM2243)负责肠道中地高辛的失活,从而从机制上深入了解微生物群组成如何影响患者之间地高辛疗效的不同。此外,化疗药物,如氟嘧啶5-氟脲嘧啶或喜树碱,对宿主模式生物秀丽隐杆线虫的影响因其细菌饮食而异。例如,与喂食大肠杆菌BL21G的蠕虫相比,喂食大肠杆菌HB101的蠕虫表现出对卵孵化的化疗药物的最低抑制浓度高80倍(8μM vs. 0.1μM),这表明微生物可以通过药物激活增强或抑制氟嘧啶的作用。微生物药物代谢的其他例子是癌症前药伊立替康的激活或癌症药物吉西他滨的失活。由于β-葡萄糖醛酸酶在肠道中的激活或再激活,伊立替康即使静脉注射给药也会引起胃肠道毒性。另一方面,已证明吉西他滨可被γ-变形菌(Gammaproteobacteria)抑制活性,而γ-变形菌大部分属于常见科肠杆菌科(Enterobacteriaceae)和变形菌科(Proteobacteriaceae)。
最近的研究表明,肠道细菌的转化非常普遍。一项针对271种药物筛选76种细菌菌株的体外研究发现,这些药物中约三分之二的水平被至少一种细菌菌株显著降低,并且每种菌株都能代谢11到95种药物。此外,本研究还鉴定并验证了30种微生物编码的酶,它们能将20种药物转化为59种代谢物。这些酶在人类肠道微生物群中的丰富程度部分解释了菌群间药物代谢能力的差异。另一项使用个性化肠道微生物群培养的研究发现,438种筛选药物中有57种(涵盖28个药理学类别)被代谢,包括45种新描述的药物-微生物群相互作用。这些研究表明,肠道微生物群参与了一系列药物的代谢,通过确定个体的药物代谢能力,可以预测对特定药物或治疗的反应。最近的一项研究调查了甲氨蝶呤(一种治疗类风湿性关节炎的常用药物)的疗效,不仅证明了治疗前微生物群组成与治疗反应之间的相关性,还表明利用机器学习的方法,可以从微生物群的组成预测对甲氨蝶呤的反应。虽然已经确定了肠道细菌代谢药物之间的一些化学相似性,如酰胺、硝基、偶氮或脲基团,但迄今为止的数据集还不足以概括微生物群进行的化学转化类型。
与治疗药物类似,环境污染物也可能被肠道微生物群代谢,从而影响其在宿主体内的生物利用度或毒性。乳酸乳球菌、发酵乳杆菌(Lactobacillus fermentum)和大肠杆菌的体外培养表明,这些菌株在15天内降解农药毒死蜱的能力分别为初始浓度的70%、61%和16%。有趣的是,每个菌株产生不同的代谢物,这表明毒死蜱微生物降解可能涉及多种途径。
霉菌毒素也被肠道细菌生物转化。一项调查隐藏的霉菌毒素(即与糖、谷胱甘肽或硫酸盐结合的霉菌毒素)代谢的研究表明,这些霉菌毒素在人类粪便样本中可被有效水解,这可能导致更高的霉菌毒素暴露,因为未隐藏的霉菌毒素被更有效地吸收。另一项研究调查了14种不同菌株代谢隐藏的霉菌毒素或降解游离霉菌毒素(即脱氧雪腐镰刀菌烯醇、T2和HT2毒素)的能力。一些细菌菌株具有这种能力,如青春双歧杆菌(Bifidobacterium adolescentis),这是一种存在于人类肠道中的丰富菌株。
不同的染料,如苏丹红I、II、III、IV和Para Red也被肠道微生物群代谢。一项体外研究表明,35种被测试的细菌中有33种能够降解这些染料中的至少一种。这表明,代谢这些类型染料的能力在人类肠道细菌种类中广泛存在。此外,最近的一项研究表明,偶氮染料Red 40(世界上最广泛使用的食用着色剂之一)以微生物群依赖的方式促进IL-23表达失调的小鼠结肠炎。丰富的E. faecalis和Bacteroides ovatus菌株可在体外降解Red 40,并参与Red 40诱导的小鼠结肠炎。另一种常见的食品污染物是多环芳烃(PAHs),它可以在高温烹饪过程中产生。PAHs对人体具有毒性、致癌性和雌激素作用。肝脏中的细胞色素P450酶可以激活多环芳烃生成更多的活性代谢物,这被认为是导致其致癌性的原因。除此之外,一项体外研究还考察了肠道微生物群在人体肠道模拟系统中代谢不同PAHs的能力。只有微生物消化的多环芳烃和未修饰的化合物具有雌激素活性,说明肠道微生物群也参与了人体PAHs的生物激活。
本节中的示例展示了肠道微生物群代谢各种化合物的潜力,从而改变其在宿主中的生物利用度、有效性和毒性。
3.6 肠道细菌的外源性生物累积
肠道细菌对外源性物质的积累只是最近才被认识到。一项研究调查了14种肠道细菌菌株对复杂链格孢菌(Alternaria spp.)的影响。霉菌毒素提取物显示这些霉菌毒素与细菌细胞颗粒相关的不同趋势。链格孢酚、链格孢酚甲基乙醚和链格孢霉素不仅被许多菌株耗尽,而且还在细菌颗粒中积累。这种积累与这些化合物的亲脂性有关,在革兰氏阴性细菌如B. vulgatus和B. thetaiotaomicron中更常被观察到。另一项调查药物-细菌相互作用的研究发现,在药物耗尽的29种相互作用中,有17种不是由细菌的生物转化引起的,而是由生物累积引起的。例如,几种细菌(如Streptococcus salivarius、Clostridium saccharolyticum和E. coli)会积累度洛西汀,这是一种广泛使用的抗抑郁药。这一发现挑战了细菌与药物相互作用的主要模式是生物转化的观点。此外,一些药物表现出生物累积或降解的潜力,这取决于细菌菌株,而大多数菌株能够根据药物的不同进行这两种类型的相互作用。这些发现可以解释其他研究的结果,这些研究显示药物耗尽而没有检测到药物代谢产物。因此,在解释外源性物质在物种和群落水平上的影响及其对宿主的影响时需要考虑生物累积。
4 外源性物质混合物
目前为止,大多数关于微生物群-外源性物质相互作用的研究一次只关注一种化合物,这种情况并不一定反映体内条件。药物通常与含有大量天然化合物和污染物的食物一起服用。由于所有摄入的化合物将同时存在于肠道中,因此,不仅要确定外源化合物的单一效应,还要确定其组合效应,因为单一化合物对单一菌株或群落的效应可能与复杂混合物对单一菌株或群落的效应不同。
一些研究表明,不同的饮食和环境因素可以影响药物的作用,显示出组合效应。例如,双酚A,一种用于塑料食品包装的化学物质,降低了雷帕霉素等抗癌药物的功效;饮食,如嘧啶或维生素B6或B9,调节了秀丽隐杆线虫(C. elegans)肠道细菌对抗癌药物氟嘧啶的激活。此外,越来越多的研究表明,与单一物质相比,外源性物质的组合对肠道微生物群的影响不同。精氨酸抑制了特定E. lenta菌株对地高辛的失活,表明蛋白质消耗的增加可能会降低体内地高辛的代谢。与农药草甘膦相比,草甘膦配方中的化学物质组合对肠道细菌的影响也不同,如益生菌鼠李糖乳杆菌(Lactobacillus rhamnosus)菌株,这表明草甘膦和配方化合物之间存在协同作用。另一项研究在6种细菌菌株上测试了79种化合物的组合,包括抗生素、宿主靶向药物和食品添加剂,发现了协同作用和拮抗作用,后者更为常见。在本文中,针对大肠杆菌中不同细胞过程的药物之间显示出拮抗作用,例如食品添加剂香草醛(可增加有氧呼吸控制蛋白ArcA的水平)和抗生素氯霉素(一种蛋白质合成抑制剂)。较少观察到的协同作用仅发生在靶向同一过程的化合物之间,例如影响多药转运体MdfA的香草醛和大肠杆菌中蛋白质合成的进一步抑制剂抗生素大观霉素。在Prestwick药物库(包含FDA批准和EMA批准的药物)中搜索红霉素拮抗剂,红霉素通过引起细胞形状缺陷(如起泡、细胞质收缩和裂解)对常见的肠道细菌B. vulgatus具有杀菌作用,经鉴定,双香豆素和托芬那酸能够在不影响红霉素杀死病原菌的情况下挽救B. vulgatus。此外,一项体外研究发现,186种生物活性化合物中有45种与抗生素(如三氯生)对大肠杆菌MC1061的生长具有协同作用。这些结果表明,使用外源性物质组合可以减少抗生素和其他药物的不良反应,但也强调需要系统地研究外源性物质组合,以更好地了解外源性物质塑造微生物群的程度和机制,反之亦然。
结论及未来展望
作为饮食或药物的一部分,人类食用各种各样的可与肠道微生物群相互作用的外源性化合物。其中一些外源性物质可以影响肠道微生物群的组成和功能,而细菌反过来又可以改变外源性物质的活性和毒性。根据肠道微生物群的组成,许多相互作用(例如地高辛或氟嘧啶)因人而异。对这些个体间差异的进一步研究将增进知识并促进饮食或医疗干预的个性化方法的开发。
此外,大多数关于环境微生物群与宿主相互作用的研究都集中在单一因素上,如饮食、药物或环境污染物。为了全面了解环境-微生物群-宿主相互作用,同时考虑多种因素至关重要。之前的综述已经描述和总结了系统性方法,可以用来帮助阐明药物-微生物群-宿主的相互作用。例如,已证明结合计算策略的体外和体内实验可用于解开宿主和微生物对药物代谢的贡献,这种方法可适用于其他外源性化合物。
在进行或比较研究时需要考虑的另一个重要因素是外源性物质浓度。外源性物质对单个菌株或完整的微生物群的影响取决于其受试浓度。例如,一项全面的药物筛选显示,在较高的药物浓度下,更多的物种被抑制。此外,香料提取物和链格孢霉毒素对生长的抑制或促进作用取决于其浓度。例如,B. thetaiotaomicron在低浓度霉菌毒素(0.5 μg/mL)下表现出促进生长的作用,而在高浓度霉菌毒素(50 μg/mL)下表现出抑制生长的作用,这强调了在评估外源性物质效应时考虑浓度的重要性。观察到更多的细菌种类在较高浓度下受到抑制可能是由于多种因素,如渗透压或pH值的变化,或由于化合物摄取和与大分子结合的变化。重要的是要注意,“高”或“低”浓度取决于环境和化合物。此外,研究中使用的浓度也依赖于模型。对于人类或动物研究,浓度通常(mmol范围)高于体外细胞研究(μmol范围)。
虽然在体内胃肠道暴露水平相应的浓度下进行测试是理想的,但这种信息很少可用。在微生物群研究中纳入粪便样本、尿液和血浆的代谢组学分析的趋势可以为特定化合物的浓度及其在个体和时间点之间的变化提供一个概念。此外,对废水中外源性物质浓度的分析可以提供关于不同地点药物和环境污染物暴露趋势的额外信息。
随着更多的机械数据变得可用,机器学习方法可以帮助预测化学结构和细菌基因组信息下的相互作用。虽然一些数据库已经涵盖了超过13,000种外源性物质-肠道细菌相互作用,但其中超过11,000种相互作用涉及药物。为了能够成功地实现机器学习方法,需要一个包含各种外源性物质类别(图2)和各种细菌物种的大数据集。事实上,由于研究的缺乏,外源性物质类别比本文中概述的要多得多。未来的研究应重点关注食物和药物中常见且经常摄入的物质,但也要考虑通过吸入、皮肤吸收和注射进入人体的其他物质和化合物。
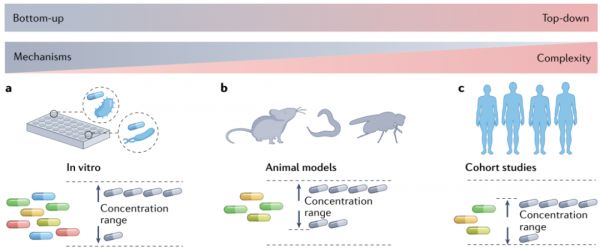
图5 用于研究外源性物质-微生物群落-宿主相互作用的模型。
a基于体外培养肠道细菌菌株研究的自下而上方法有助于揭示分子机制。然而,体外研究可能并不总是与体内环境相关。此外,许多菌株的丰度很低,培养困难,这阻碍了菌株的鉴定和检测。b动物模型,包括老鼠、苍蝇和蠕虫,提供了一种折中方法,允许在控制的环境下研究体内微生物群的相互作用。将研究结果从动物模型转化到人类可能很困难,因为动物对外源性物质、微生物群组成和宿主-微生物群相互作用的生理反应不同。c基于人类队列的研究,即所谓的自上而下的方法,与功能研究和临床应用直接相关。然而,这些研究受到许多难以控制的混杂因素的影响,如生活方式、饮食和药物摄入。因此,往往很难建立外源性物质和微生物群之间的因果联系和精确的潜在机制。研究中使用的外源性物质浓度在自下而上和自上而下的研究中往往各不相同。在动物模型研究中使用的浓度(mmol范围)通常高于体外研究(μmol范围)。虽然原则上可以在动物模型中使用范围广泛的浓度,但通常选择较高的浓度以确保生理读数是可能的,并将动物数量限制在伦理上可接受的水平。人体研究的浓度受到队列访问(观察性研究)或安全考虑(干预性研究)的限制。此外,在人类和动物模型中,化合物在到达肠道细菌之前要经过宿主的消化过程,而在体外研究中,细菌直接暴露在化合物中。
虽然现在有许多实验方法来确定微生物群与外源性物质的相互作用,但每种方法都有其自身的局限性,这使得将实验结果转化为临床或健康咨询具有挑战性(图5)。需要大规模的人类研究(自上而下的方法)来建立外源性物质和肠道微生物群之间的联系。自上而下研究发现的相互作用与功能研究和临床应用相关。然而,由于生活方式、饮食和药物摄入等许多难以控制的混杂因素,此类研究颇具挑战性。因此,通常很难建立外源性物质和微生物群之间的因果联系,并确定其潜在机制,这需要后续研究来测试提出的相互作用。另一方面,体外研究(自下而上的方法)可以揭示肠道细菌菌株的分子机制,但很难推断出体内条件。此外,许多肠道细菌菌株在肠道中的丰度很低和/或难以培养,这妨碍了它们在实验室条件下的鉴定和检测。动物模型,如小鼠、大鼠或蠕虫,提供了一种折中的方法,微生物群与宿主的相互作用机制可以在控制的环境中进行体内研究。
然而,将动物模型的研究结果转化到人类可能很困难,因为动物和人类在疾病进展、外源性反应、微生物群组成和宿主-微生物群相互作用的特性方面存在许多生理差异。未来,可摄取的测量和报告设备(如含有活细菌的磁性水凝胶)或微生物电子设备,可以提供原位外源性物质浓度的信息,从而揭示现实条件下外源性物质-微生物群-人类相互作用。了解每种方法的可能性和局限性对于结合不同的研究类型以加深我们对肠道微生物群的理解至关重要。我们设想,更多融合自上而下和自下而上方法的研究将提供机制见解,从而实现模型指导的外源性物质-微生物群相互作用的预测。
本文由“健康号”用户上传、授权发布,以上内容(含文字、图片、视频)不代表健康界立场。“健康号”系信息发布平台,仅提供信息存储服务,如有转载、侵权等任何问题,请联系健康界(jkh@hmkx.cn)处理。
相关知识
中国健康医疗大数据研究综述——基于期刊论文的分析
顶刊综述丨NAT MED(IF:82): 心脏代谢健康、饮食和肠道微生物组: 宏组学视角
顶刊综述丨NAT REV MICROBIOL (IF:78): 胆汁酸和肠道微生物群: 代谢相互作用和对疾病的影响
疾病监测是什么期刊
眼科顶刊《Ophthalmology》刊发红光治疗联合角膜塑形镜的随机对照临床试验
重磅综述
《柳叶刀》综述:腰痛已成全球性疾病!哪些因素易诱发腰痛?
健康旅游研究综述
撤稿量全球第一!医学教授 210 篇论文被撤,指南被迫重写,顶刊发文怒斥
Lancet综述:炎症性肠病患者的孕期指南
网址: 顶刊综述 https://www.trfsz.com/newsview88815.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






