基于生物有效性的蔬菜重金属健康风险精细化评估研究进展
刘龙一, 马娇阳, 侬代倩, 宗大鹏, 王成尘, 王海波, 杨金木, 向萍. 基于生物有效性的蔬菜重金属健康风险精细化评估研究进展[J]. 环境化学. doi: 10.7524/j.issn.0254-6108.2023112704
LIU Longyi, MA Jiaoyang, NONG Daiqian, ZONG Dapeng, WANG Chengchen, WANG Haibo, YANG Jinmu, XIANG Ping. Accurate health risk assessment of heavy metals in vegetables based on their bioavailability: A critical review[J]. Environmental Chemistry. doi: 10.7524/j.issn.0254-6108.2023112704
Citation:LIU Longyi, MA Jiaoyang, NONG Daiqian, ZONG Dapeng, WANG Chengchen, WANG Haibo, YANG Jinmu, XIANG Ping. Accurate health risk assessment of heavy metals in vegetables based on their bioavailability: A critical review[J]. Environmental Chemistry. doi: 10.7524/j.issn.0254-6108.2023112704基于生物有效性的蔬菜重金属健康风险精细化评估研究进展
刘龙一1,2, , 马娇阳1,2, 侬代倩1,2, 宗大鹏1,2, 王成尘1,2, 王海波3, 杨金木4, 向萍1,2, , 通讯作者:E-mail:ping_xiang@126.com1. 西南林业大学环境修复与健康研究院,生态与环境学院,昆明,6502242. 云南省环境污染与食品安全及人体健康创新团队,昆明,6502243. 通海县土壤肥料工作站,通海,6531994. 通海县乡村振兴发展服务中心,通海,653199 收稿日期: 2023-11-27 录用日期: 2024-03-18 网络出版日期: 2024-08-13摘要: 近年来我国蔬菜重金属污染问题受到了广泛关注,目前蔬菜重金属污染健康风险评估模型主要基于总量和生物可给性进行,可能高估重金属的健康风险,而以重金属的生物有效性作为评价基础能够进一步精细化健康风险评估. 本文综述了蔬菜重金属生物有效性健康风险评估的方法(健康风险评价公式、体内模型、体外模型),同时分析了蔬菜中重金属生物有效性的影响因素,主要包括矿物质、营养成分、微塑料和食品的加工处理方法,并提出构建以生物有效性为基础的健康风险评估模型可以实现健康风险精细化评价. 未来,可以将共培养细胞模型应用于重金属生物有效性研究,添加胰腺等其他器官作为生物有效性的测定终点,并关注重蔬菜中生物有效态重金属对不同人群的影响.
English Abstract
全文HTML
蔬菜是人类饮食中重要的组成部分, 可以提供各种微量元素、维生素、碳水化合物等多种营养物质,能够预防多种疾病,保证人类的身体健康[1]. 根据2022年发布的《中国居民膳食指南(2022)》,人体每天应摄入300 g的蔬菜[2]. 但是蔬菜易吸收重金属,食用蔬菜是重金属进入人体的主要途径之一. 重金属(类物质)普遍存在于农业土壤和作物等介质中,对环境质量、粮食安全和人类健康构成潜在威胁[3]. 目前,全球61个地区共36种蔬菜受到重金属污染,其含量超过了不同组织规定的允许限度[4]. 根据Chopra等[5]研究,在印度德拉敦市地区,蔬菜可食用部分的金属浓度都超过了印度允许的限值. 此外,有研究评估了孟加拉国坦盖尔区大米和蔬菜中铬(Cr)、镍(Ni)、铜(Cu)、砷(As)、镉(Cd)和铅(Pb)的浓度及其可能的人类健康风险,结果表明水稻和蔬菜中Cr、Ni、Cu、As、Cd和Pb的日摄入量(EDI)值均高于最大容许日摄入量(MTDI);所有金属的日摄入量(EDI)值均高于最大容许日摄入量(MTDI),其中Ni、Cu、As、Cd和Pb的目标危险系数(THQ)值超过阈值[6]. 同样地,我国也面临严重的重金属污染的问题. Cui等[7]采集了云南省14种不同叶菜的样本,测定了样品中的铅(Pb)、镉(Cd)、砷(As)和铜(Cu)含量,并使用危害商和危害指数(HI)计算了对人类健康的风险,所有叶菜的HI值均大于1,表明存在对人类健康的风险.
长期以来,许多研究集中在重金属积累方面,重金属的总浓度一直被认为是健康风险评估的重要指标[8]. 目前越来越多的研究发现,基于总量进行评估往往被认为会高估其健康风险,而生物可给性被认为能够进行更准确的健康风险评估. 生物可给性是,污染物或营养物质在肠胃系统中可以溶出至胃或肠道消化液中的部分,即能被人体吸收的相对含量,是物质被生物可能吸收的最大值[9]. 因此,研究者们开发出许多基于生物可给性健康风险评估方法,例如,生理提取实验法(Physiologically based extraction test,PBET)、体外胃肠模拟法(In vitro gastrointestinal,IVG)、可溶性生物可给性研究联合会方法(Solubility bioaccessibility Research Consortium,SBRC)、德国标准研究院法(Deutsches institut für normung e.V,DIN)等[10]. Tian等[11]收集了云南的224种经常食用的蔬菜,测定了蔬菜中重金属(类)的总含量和生物可给性,蔬菜中Cr、Cd、As、Pb、Cu、Zn、Ni在胃期的生物可及性为0.41%—93.8%. 与总重金属(类)相比,基于生物可及性的健康风险显著降低. 有研究发现,基于蔬菜中重金属的生物可给性进行健康风险评估,结果显示目标危险商(THQ)<1无健康风险,但随后通过进行的毒理学实验却发现,两种蔬菜肠道食糜处理Caco-2细胞在暴露8 h之后,细胞活力明显下降[1]. 基于生物可给性的体外胃肠模拟方法虽然在健康风险评估方面可行,但由于缺乏人体胃肠细胞成分,很难模拟胃肠道的实际功能(见图1);此外,蔬菜中的重金属进入消化系统后,并不会完全被小肠吸收,只有一部分能够通过小肠的黏膜进入人体内部,因此,体外胃肠模拟很难获得准确的毒理学数据,需要进行毒理学验证[12 − 13].
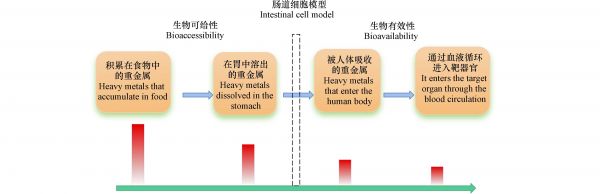
有学者提出,将通过胃肠道吸收进入人体内循环的重金属含量占重金属总量的比值定义为生物有效性(bioavailability),能够更好地对于蔬菜重金属人体暴露展开健康风险评估[14]. 在这个定义中,生物有效性不仅仅是从肠道吸收,还包括在身体组织中的使用和储存. 借鉴药理学的研究策略,基于生物有效性的人体肠道上皮细胞模型(如Caco-2、Caco-2/HT29-MTX和Caco-2/HT29-MTX/Raji B等二维或三维模型)被广泛用于重金属污染的研究. 有研究分析了一些典型的高地球化学背景区干燥野生牛肝菌中As基于总量、生物可给性、生物有效性的日摄入量,发现基于生物有效性的日摄入量最低[15]. 如表1所示,通过黑牛肝菌消费的总砷(T-EDI)的EDI为50.4 μg·kg−1体重,该值显著高于粮农组织/世界卫生组织基于健康的指导值,然而,As(Bac-EDI、Bac-EDI-c和Bav-EDI-c)的生物可给性(生的和熟的)和生物有效性(熟的)的EDI值低于2.1 μg·kg−1·d-1[15]. EDI评估受As的生物可给性和生物有效性的显著影响,不存在与食用牛肝菌摄入As相关的健康问题的严重风险[15],基于总量来进行健康风险评估并不准确. 此外,诸多研究报道了蔬菜重金属污染问题,但是基于生物有效性的研究相对较少,而各种蔬菜之间的重金属生物有效性是不同的[16]. 本文综述并总结了现有报道中与蔬菜重金属生物有效性相关的两个方面:(1)蔬菜重金属健康风险评估模型(2)蔬菜中重金属生物有效性的影响因素;以期为蔬菜的健康风险精细化评估模型建立提供研究思路和参考.
1. 蔬菜重金属污染健康风险评估方法(Health risk assessment method for heavy metal pollution in vegetables) 1.1. 基于数学模型的健康风险评价公式重金属污染的蔬菜被人体摄入后,会对人体造成严重损伤. 通过健康风险评估能够预测重金属对人体产生的危害. 健康风险评估是指定量估计特定时期内,化学物质对人体健康会造成的损伤以及导致这种损伤的可能性[17]. 目前在国际上人体健康风险测量方法主要包括致癌风险评价,非致癌风险评价等. 许多研究利用数学公式推算蔬菜重金属污染的健康风险,例如Islam等[18]研究孟加拉国广泛食用的蔬菜中重金属的健康风险,通过收集蔬菜中重金属的含量等相关数据计算重金属估计每日日摄入量,对该地区的蔬菜重金属污染进行健康风险评价;Cao等[19]通过健康风险指数(HRI)评估废水灌溉土壤蔬菜的健康风险. 主要评价公式如表2所示. 表2中公式是进行人体健康风险评估的重要方法,但是通过公式的计算无法对某一污染物进行精确评估;公式中的参数具有很大的不确定性. 例如研究人员计算某种有毒金属的每日金属摄入量(DIM)时,由于有毒金属没有相应的推荐日摄食量(RDA),只能通过其他途径假设它的RDA跟该种有毒金属的DIM比较;此外研究人员在平均体重(BW),接触频率(EF),癌症斜率因子(CSF)和口服参考剂量(RfD)的选择上同样会影响最终风险评估的精确性,因此参数在很大程度上决定了污染物的风险程度. 蔬菜中的重金属浓度是人体健康风险评价公式中很重要的参数,目前人体健康风险评价公式是基于污染物的总量来计算的,即假设污染物100%被人体吸收,但是很多研究表明重金属进入人体肠道之后无法完全被人体吸收,因此基于总量计算会高重金属的摄入量,并且要重视参数的选择[25].
1.2. 体外胃肠模拟耦合肠道细胞模型的健康风险评价估总浓度经常被用来评估蔬菜中重金属的健康风险,但可能会高估它们的健康风险,因为并非蔬菜中的所有金属都可被人类完全吸收,而关于其生物可给性的信息很少[1]. 因此,生物可给金属已被用于更精确的风险评估. 蔬菜重金属生物可给性主要采用PBET法和欧洲标准法(UBM,Unified BARGE Method)等方法进行测定. 针对不同体外消化方法,叶菜中不同重金属的生物可给性如图2所示. 采用PBET法测定蔬菜重金属生物可给性在胃期呈现出Cd>As>Cu>Pb>Cr的趋势,不同种类金属元素通过同一种体外消化方法测定的生物可给性具有明显差异. 这种差异可能是由于不同蔬菜品种或者蔬菜中重金属的浓度造成的. Cr的生物可给性最低,可能是由于金属价态的影响导致. 通过不同方法测定同一种重金属生物可给性也具有明显差异,例如Cd和As胃期的生物可给性呈现出UBM>SBRC>PBET的趋势. 这与Zheng等[26]的结果一致. 这是由于利用体外模型进行测定时,UBM和SBRC法的胃pH值较高,因此促进了重金属的溶解. 用于食物消化的酶不同,也能够影响重金属的溶解;这解释了通过SBRC法测定Pb生物可给性较高的原因. 此外,在胃期重金属生物可给性普遍高于肠期;但是通过PBET法测定As的肠期的生物可给性比胃期平均高8.2%,这是由于在PBET法中添加柠檬酸和苹果酸能够促进As的溶解[26].
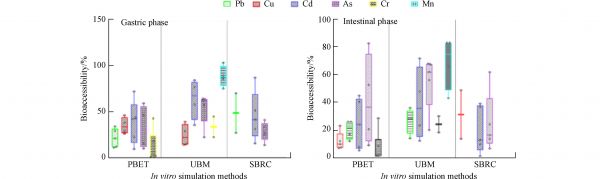
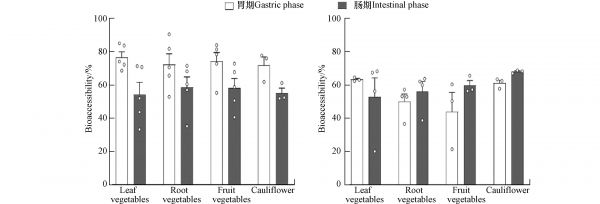
图3是根据UBM法测定不同类型蔬菜的Cd和As的生物可给性,结果显示在胃期,叶菜中的As和Cd的生物可给性最高;表明不同类型蔬菜重金属生物可给性也存在差异. 差异性主要与蔬菜重金属含量的差异有关,重金属生物可给性随着蔬菜中重金属含量的升高而升高[40]. 此外,有研究表明,不同种类蔬菜内部细胞壁结构存在显著差异,这可能影响重金属的生物可给性,例如胡萝卜的细胞壁比番茄厚并且细胞壁孔隙度更低[41]. 但有研究表明体外胃肠模拟法也存在着缺陷,例如许多体外方法没有模拟肠上皮的摄取过程[42]. Li等[15]采集云南各地的牛肝菌,测定As的含量并测算出As的摄入量. 如表1所示,根据牛肝菌中As总浓度测算的摄入量,以及根据As的生物可给性和生物有效性测算的As摄入量完全不同,呈现总量>生物可给性>生物有效性的趋势. 基于生物有效性肠道细胞模型是一种新的健康风险评估方法,Caco-2细胞系来源于人类结肠癌,与人体的肠道上皮细胞结构相似,具有肠道细胞的多种功能和特性,是建立肠道细胞模型的良好材料[43]. 重金属的跨肠细胞转运是重金属对人体内脏器官产生毒害的前提,因而肠细胞模型在重金属生物有效性、吸收转运和毒性机制研究中受到特别关注[1].
目前,有研究者们采用体外消化和Caco-2细胞相结合的方法进行蔬菜重金属污染的研究. 例如Ramiro等[44]利用胃肠模拟消化/和Caco-2细胞测定Fe蛋白的积累,确定了5种蔬菜中Fe的生物有效性. 但是Caco-2单细胞模型也存在一定的缺陷,在Caco-2细胞不断分化的同时,跨细胞的渗透性增加,并且由于Caco-2细胞之间结构紧密细胞旁路通透性比人体肠道低,导致低估肠道对于重金属的吸收[45]. 最有效地改进方法是利用共培养技术将多种细胞进行联合培养;其中值得注意的是Caco-2细胞和HT29/HT29-MTX细胞的共培养模型. HT29属于人类结肠腺癌细胞系,通过甲氨蝶呤处理,HT29细胞可以分化成自身的亚克隆细胞系HT29-MTX,而HT29-MTX细胞能够分化可以分泌黏液的杯状细胞[46]. Vázquez等[47]通过使用Caco-2单培养和Caco-2/HT29-MTX共培养细胞模型,评估了Hg(Ⅱ)和甲基汞的运输和细胞保留,并且研究了黏液层对于Hg的运输和在细胞中积累的影响. 结果表明,共培养模型降低了细胞的渗透系数,因此Hg在细胞中的积累量增加了. 此外,共培养模型与单细胞模型相比提高了细胞旁路的渗透性,Calatayud等[48]使用不同比例的肠上皮模型(Caco-2单培养和Caco-2/HT29-MTX共培养)研究不同形态的As的肠道吸收特征,结果显示,与Caco-2单细胞模型相比, As(V)的渗透系数显著增加,这是由于共培养模型细胞旁路的渗透性显著增加的缘故,黏液层能够阻滞一部分3价As的渗透. 因此共培养细胞模型能够增加细胞旁路渗透性,分泌粘液层可以阻滞对重金属的吸收,进一步还原肠道上皮结构. 共培养细胞模型能够进一步还原肠道上皮的结构,但这只是体内肠道消化吸收系统的简化培养模型. 研究人员基于刚刚提到的两种模型,开发了具有3种细胞类型(Caco-2、HT29- MTX和Raji B细胞)的三重共培养模型. 通过添加淋巴细胞(Raji B细胞),能够诱导Caco-2细胞分化成M-细胞表型,增强肠道细胞模型的吸收能力;与单一Caco-2细胞模型相比,分化后的M细胞形态特征发生变化,例如柱状形状发生改变,界缺失,微绒毛变短等[49, 50]. Araújo等[51]建立Caco-2、HT29-MTX和Raji B细胞的三重共培养模型,并通过实验证明了在共培养的过程中,三种细胞都能各自保留它们的功能,并诱导M细胞表型分化;因此三重共培养模型是一种比较好的研究生物有效性的体外模型.
尽管单细胞模型存在诸多缺点,但在重金属生物有效性的研究方面仍然应用十分广泛. 目前,共培养细胞模型在以蔬菜为介质重金属生物有效性的研究方面应用较少,人体每天要摄入定量的蔬菜,肠道上皮高度暴露于蔬菜成分,包括一些受污染的蔬菜中的有害物质,因此可以将2D、3D共培养肠道细胞应用于蔬菜重金属生物有效性的研究方向. 近几年来,越来越多的研究开始应用肠道类器官作为体外模型,类器官是指:器官特异性细胞的集合,这些细胞从干细胞或器官祖细胞发育而来,并能以与体内相似的方式经细胞分序(cell sorting out) 和空间限制性的系别分化而实现自我组建[52]. 人小肠类器官主要分为两种类型,一种是以多能干细胞(PSCs)分化产生的人类肠道类器官(human intestinal organoids),简称hIOs;另外一种是由肠道隐窝干细胞分化产生的人肠道类肠(human intestinal enteroids),简称HIE.与2D模型相比,类器官模型拥有多种类型细胞,例如肠细胞、杯状细胞、多能干细胞、潘氏细胞. 此外,类器官包含了肠道的多种功能,例如吸收和分泌活性;同时还能模拟肠道的损伤修复和稳态恢复的能力[52 − 53]. 尽管如此,肠道类器官还存在一些缺陷,例如类器官只包含了肠道上皮细胞的类型. 但是,作为一种新型的体外模型,肠道类器官在重金属暴露,生物有效性方面的研究还处于起始阶段,因此具有很大的发展前景.
1.3. 基于生物有效性的动物模型健康风险评估重金属生物有效性是评估人类摄入蔬菜后,接触重金属情况的最有效方法之一. 但是由于直接以人体为实验对象具有诸多问题,因此促进了动物模型的发展. 目前主要的动物模型包括:猪、小鼠、兔、灵长类动物等[20]. 例如Roberts等[54]利用食蟹猴测定土壤中As的生物有效性,并证明了猴子可以作为动物模型进行生物有效性的研究;但是由于花费高以及伦理问题等因素,猴子目前并不是使用最为广泛的动物模型[55 − 56]. 目前,重金属的生物有效性的研究已经扩展到食品基质,如蔬菜等;Juhasz等[57]利用猪作为动物模型选取4种蔬菜评估 As在蔬菜中的生物有效性; Wang等[8]利用小鼠评估了14种蔬菜中Cd的相对生物有效性;因此,动物模型在蔬菜重金属生物有效性相关研究中十分重要. 在研究蔬菜基质的过程中,猪和小鼠成为使用最为广泛的动物模型. 猪和人类幼儿在胃肠道的生理结构,以及形态上的相似性,因此猪是目前研究重金属生物有效性最具吸引力的动物模型之一. 猪的体型庞大在测定过程中可以反复抽血,但是抽血过程中需要具有专业的知识和技能;此外猪的生长周期较长,饲养的成本较高,并不能完全替代其他动物模型[58].
小鼠作为动物模型在科学研究中的用途广泛. 在医学中可以作为药物识别,与猪相比,小鼠兼具成本效益和易于操作等优点,同时适合大量培育,适合大样本实验[59]. 此外,有研究报道,虽然小鼠与人类之间的血统相隔较远,但是有85%以上的基因组序列在小鼠和人类之间是保守的,并且小鼠和人类的肠道在生理特征方面有许多的相似之处[60, 61]. 有研究表明,可以通过改变小鼠的饮食成分和基因表现性来确定生物变异对于胃肠道对于重金属吸收的影响[62]. 因此小鼠是目前进行蔬菜重金属生物有效性研究最合适的动物模型之一. 但是,与猪相比,小鼠的体型较小也不适合进行重复抽血,需要多只小鼠在不同时间间隔进行. 目前动物模型进行实验主要采用以下四种暴露方法:单次灌胃法(SGD)、重复灌胃法(RGD)、日常重复喂养(DRF)以及自由获取食物(FAD),此外动物模型生物有效性的终点以血液和肝脏、肾脏等器官为主. 然而由于生理上的差异,动物与人吸收重金属的能力不同. 与人类的胃肠道相比,其代谢和大小具有很大差异. 例如小鼠在重金属吸收后产生的代谢产物会与人体有很大不同[61]. 将暴露于试验材料后动物组织或尿液中的金属积累与可溶性参考物(如砷酸钠(NaH2AsO4)、乙酸铅(Pb(AC)2)和氯化镉(CdCl2))的金属积累进行比较,在这种情况下,可以在很大程度上减少动物和人类之间在金属吸收方面的差异,这种方法被称为相对生物有效性(RBA). 因此使用动物生物测定法测量的金属RBA可用于人类健康风险评估[63 − 65].
尽管猪和小鼠已经成为使用最为广泛的动物模型,但是两种动物之间生物有效性存在着较大的差异. 有研究表明猪的重金属RBA要高于小鼠,这主要是由于猪和小鼠在肠道结构以及大小方面的差异[58, 66]. 并且动物模型存在成本高,提取暴露困难等缺点,因此动物模型在蔬菜重金属生物有效性的研究和测定方面还存在一定的缺陷. 基于此,在今后的研究中应当对不同动物模型的生物有效性进行对比,同时进一步完善重金属生物有效性健康风险评估的方法.
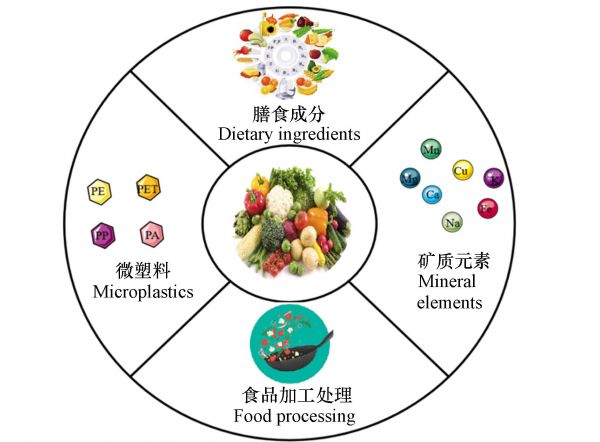
2. 蔬菜重金属人体生物有效性的影响因素(Influencing factors of human bioavailability of heavy metals in vegetables)众所周知,蔬菜具有富集重金属的能力,因此蔬菜是重金属通过口服进入人体的重要基质. 此外蔬菜中含有多种物质能够影响重金属的生物有效性,包括矿物质、植酸,抗坏血酸等物质,除了蔬菜本身以外,对蔬菜食品的加工也能够影响重金属的生物有效性(图4).
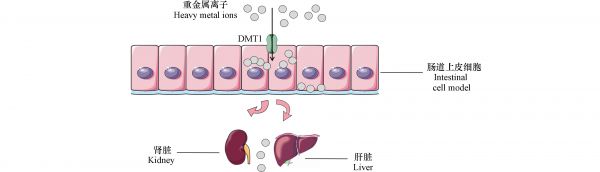
蔬菜中含有多种矿物质,不同的矿物质会影响重金属的生物有效性. Li等[16]采用9种不同食物基质饲养小鼠通过禁食和饲喂状态下,测定3种污染的土壤中Pb的RBA,结果表明禁食状态下Pb-RBA总体高于饲喂状态下的Pb-RBA,此外,9种不同食物中的Pb-RBA也不相同,矿物质含量高的小鼠饲料的Pb-RBA最低,这说明食物中的成分能够影响重金属的生物有效性,并且矿物质能够减少肠道对Pb的吸收,值得注意的是,白菜中的矿物质含量高于小鼠饲粮,但是白菜的Pb-RBA高于小鼠饲粮. 这可能是由于白菜中的有机酸抑制了Pb与矿物质的共沉淀从而促进了肠道对Pb的吸收. Wang等[8]使用小鼠测定了14种蔬菜中Cd的RBA,结果显示白菜的Cd-RBA显著低于菠菜和苋菜,在增加了Ca的叶面施用后发现水菠菜的Cd-RBA降低. Fu等[67]也证明了Ca和Fe能够抑制肠道对蔬菜中Pb和Cd的吸收. Clemente等[68]将As(Ⅲ)和As(Ⅴ)的标准溶液和食品样品添加到NCM460和HT-29MTX细胞培养物中,发现在暴露于各种膳食复合物后,Fe2+将As(Ⅲ)和As(Ⅴ)的渗透系数分别减少了54%和30%左右,降低了As的生物有效性,这可能是由于Fe与As形成不溶性盐,减少了As的吸收. 被重金属污染的蔬菜被人体摄入经过胃肠的消化分解,蔬菜内部的矿物质和有毒金属一同被肠道吸收,在这个过程中可能产生拮抗作用. 早期研究表明,肠道中DMT1介导Pb和Fe2+的转运(图5);因此Fe2+与Pb在转运过程中产生拮抗作用;DMT1蛋白基因的3`端非翻译区存在铁反应元件(IRE)能够与铁调节蛋白结合,当细胞中Fe的水平增加时,IRE会失去活性;因此Fe可以调节DMT1的表达抑制Pb吸收[69, 70]. 此外,Zn也可以抑制Pb的吸收;金属硫蛋白(MT)富含半胱氨酸,参与重金属的运输调节,Zn和Pb通过胃肠道中MT的半胱氨酸的结合位点产生竞争;进而影响Pb的生物有效性[71, 72]. 有研究报道DMT1功能失调的小鼠仍然能吸收Cd,这表明Cd能够通过多种途径被肠道吸收;Cd能够通过钙(Ca)的转运蛋白CaT1以及CaV3.1 (α1G) t型Ca通道被肠道吸收,因此Ca和Cd能够产生拮抗作用;缺Ca能够增加CaT1在肠道中的表达,并且CaT1参与了在缺Ca的情况下肠道对Cd的吸收,增加了Cd在肝脏和肾脏的积累[73 − 76]. 因此人体矿物质均衡度是影响肠道对有毒金属的吸收的重要因素. 蔬菜中的矿物质不仅能够影响肠道对有毒金属的吸收,各种矿物质成分之间也能够相互作用影响微量金属的生物有效性. 例如,Ca和Zn都可以对Fe的吸收产生影响;有研究表明,Zn能够促进肠道对Fe的吸收,金属转录因子1 (MTF-1)被证明是铁转运蛋白(FPN1)的转录因子,细胞中Zn的浓度上升能够诱导MTF-1进入细胞核,与FPN1启动子的结合来促进FPN1的转录[77]. 而Ca是Fe吸收的抑制剂,但有证据表明Ca的抑制时间较短;虽然Ca对于Fe转运体DMT1没有亲和力,但Ca能够对肠细胞中DMT1介导的铁转运产生非竞争性抑制作用,并且是依靠胞外作用实现的; 但目前Ca对Fe吸收的抑制作用的机制尚不清楚,还需要进一步的研究来具体阐明[78 − 80]. 此外,Ca对Zn的吸收也有影响;Bertinato等[81]通过喂养大鼠含有不同含量的Ca、Zn、植酸(PA)的日粮评估了Zn的生物有效性,结果表明高浓度的Ca和PA能够大幅降低Zn的生物有效性,测定[PA]/[Zn]和[PA×Ca]/[Zn]摩尔比分别为22-75和0.9-14.9 moL·kg−1,并进一步确定当PA/Zn的摩尔比确定的前提下,Ca依靠浓度依赖性影响Zn的生物有效性. 因为Ca能与Zn、PA形成共沉淀复合物,这种复合物比单一离子与PA形成的复合物更难溶解[82]. 总的来说,微量元素的相互作用说明微量元素缺乏往往不会单独发生,而是数种元素缺乏并存[83].
蔬菜中有纤维素、多酚、有机酸、植酸、膳食纤维等多种膳食成分,不同的膳食成分对重金属和矿物质的影响是不同的. 有机酸在蔬菜水果中广泛分布,常见的蔬菜中的有机酸有草酸、抗坏血酸等. 在人体内部,被肠道吸收的Fe主要分为两种类型,血红素铁和非血红素铁,后者是蔬菜水果以及谷类中主要存在的形式;抗坏血酸是非血红素铁吸收的有效促进剂,不仅有利于Fe的溶解,它还可以作为能够将非血红素铁还原为亚铁的十二指肠细胞色素的电子供体;此外抗坏血酸能够防止多酚和植酸盐对非血红素铁吸收的抑制作用[84, 85]. 而草酸主要存在于菠菜、苋菜、甜菜、马齿苋等植物中. 早期的研究报道,测定菠菜中镁(Mg)的生物有效性要低于羽衣甘蓝,这是由于菠菜中草酸的含量高于羽衣甘蓝,而这两种蔬菜中的其他成分不太可能影响Mg的吸收,因此,极有可能是由于可溶性草酸与镁形成复合物,减少了镁的吸收[86]. 众所周知,植酸盐作为一种抗营养素,高度带负电离子在很广的pH值范围内,可以和Fe2+、Zn2+、Ca2+和Mg2+等二价阳离子产生静电作用形成难溶性的复合物,从而显著抑制这些矿物质的吸收;而这些复合物的溶解度取决于矿物质与植酸盐的摩尔比,人体矿物质和植酸盐摄入的多少[87 − 89].
蔬菜中的膳食成分还能够通过作用于矿物质间接影响有毒金属的生物有效性. 例如,蔬菜中有机酸可能抑制Fe与Pb的共沉淀,增加Pb的生物有效性;同样地,植酸盐在肠道中可以抑制Ca的活性,形成不能溶解的植酸钙,减少Ca与Cd的拮抗作用,增强Cd的生物有效性[8, 16]. 除了有机酸和植酸盐以外,多酚也是重要的膳食成分. Xia等[90]通过体外消化/Caco-2细胞模型测定了大米、牛奶、番茄、大蒜、苹果、海带和猪肉等7种食物基质中Pb的生物有效性,发现Pb在7种食品基质中的平均生物有效性介于0.60%和6.33%之间,苹果组的生物有效性是最低的,这是由于苹果中的多酚能够降低Pb的生物有效性. Clemente等[68]发现西蓝花及其所含膳食成分半胱氨酸能够减少As(Ⅲ)和As(Ⅴ)的生物有效性. 此外,有研究报道,As可能与蔬菜中的多糖形成不可消化的复合物,或者溶解的As被分配到多糖上从而减少As的生物有效性;虽然目前没有相关证据表明,多糖是否能够对As的吸收产生影响,但是已经有研究证明果糖经磷酸化之后能够增加Caco-2细胞对Fe的吸收[44, 57].
2.3. 蔬菜加工处理蔬菜摄入是重金属暴露的有效途径. 人们在摄入蔬菜之前,一般会将蔬菜的可食用部分经过加工处理,例如用水清洗,蒸、煮、炒等;另外在烹饪过程中适当加入一些调味品,因此不同的加工处理方法可能会影响蔬菜中重金属的生物有效性. 传统意义上煮、蒸、炒等烹饪方式能够显著减少蔬菜中单宁和植酸的含量;而有证据表明单宁和植酸等的含量减少能够提升重金属的生物有效性,在非洲地区传统的蔬菜保存方法(煮沸-晒干,盐渍化-晒干)也能够降低植酸、单宁、草酸等抗营养因子的含量,这是由于煮沸能够破坏细胞壁导致抗营养因子被释放,植酸和单宁等物质具有水溶性,从而导致含量减少[91 − 93]. Pelfrenede等[40]采用UBM法测定并评估烹饪对蔬菜中Cd的生物可给性的影响,结果表明蒸煮能够提高豆荚、胡萝卜和韭菜中Cd的生物可给性,而油炸降低了马铃薯中Cd的生物可给性. Fu等[67]采用体外消化/Caco-2细胞模型的方法测定煮熟的和未经过处理的菠菜和小白菜中Pb和Cd的生物有效性,结果显示生的小白菜和菠菜的重金属的生物有效性为11.2%和9.4%,煮熟之后重金属的生物有效性为6.1%和3.2%;此外,蔬菜中添加醋酸增强了Pb和Cd的生物可给性,但是降低了生物有效性,这可能是因为乙酸和重金属形成了不易被肠道细胞吸收的复合物. 因此,以未经处理的生蔬菜中重金属的生物可给性和生物有效性的值作为健康风险评估的参考或许不准确,蔬菜食品一般需要进行加工处理才会被人体摄入.
2.4. 微塑料目前,每年世界上能够产生大量的不可回收不可降解的废弃塑料;因此废弃塑料在环境中大量积累;微塑料(塑料<5 mm)存在于自然界的各个角落,已经成为环境和人类健康重大威胁[94]. 此外,有证据表明,已经在蔬菜和水果中检测到MPs;但是蔬菜对MPs的吸收转运机制目前仍不清楚[95]. Canha等[96]比较了里斯本城市花园种植的生菜与农村地区种植的生菜以及超市购买的样品中MPs的含量. 在所有洗涤过的叶片中都检测到微塑料,平均含量在(6.3±6.2)MPs·g-1至(29.4±18.2 )MPs·g-1之间. 除了在食物中积累,在日常饮食过程中,一些食物容器是用塑料制成的,例如外卖餐盒,Cui等[97]调查146个外卖餐盒发现每周点1—2次外卖的人可能会消耗大约170—638种微塑料. 此外利用微波炉加热塑料的食物容器产生蒸汽等等都可能是人体口服摄入MPs的途径. 有研究发现,MPs被人体摄入以后,对肠道产生许多显著影响;例如Chen等[98]研究小鼠摄入2 µm聚氯乙烯(PVC) MPs后,肠道功能受到显著影响,微生物结构紊乱,引发肠道炎症和肠道功能的紊乱;研究发现PVC-MPs能够减少肠道粘液相关基因Muc1、Muc2、Muc3、Klf4、Retnlb表达;此外,PVC-MPs可能通过改变肠道中某些微生物的丰度从而影响肠道代谢,这些结果表明微塑料能够破坏肠道黏膜的完整性,增加肠道的通透性,这与Jin等[99]的结果一致;因此微塑料有可能通过破坏肠道黏膜提高重金属生物有效性. 但Chen等[94]发现,暴露于聚乙烯球(PE-30和PE-200)两种微塑料的小鼠模型,减少了肠道对Ca、Cu、Zn、Mn和Mg的吸收;研究发现,暴露于200 µg·g−1浓度PE-200的小鼠的十二指肠中的紧密连接蛋白的相关基因(claudin 4, occludin, ZonaOccludins 1 (ZO-1), and cingulin)的mRNA显著上调;这可能是由于PE-200的粒径较大(200µm)进入肠道后造成机械性损伤引起肠道负反馈机制修复,从而使肠道细胞链接更紧密;因此微塑料粒径大小可能对肠道吸收产生不同的影响. 此外,他们还发现微塑料对As的生物有效性也有重要的影响,但目前对于影响机制尚不清楚;微塑料能够上调部分肠道代谢物,这些代谢物可能增加Fe的生物有效性,减少Fe和As的共沉淀[94, 100]. 目前关于微塑料对重金属生物有效性影响的研究还相对较少,关于微塑料与重金属的相关机制还需要进一步探索.
2.5. 不同研究方法、模型的影响体外模型是目前测定重金属生物有效性最主要的方式之一,相较于动物模型,体外模型操作简便,成本低. 目前体外模型测定生物有效性的方法众多,包括胃肠模拟法和肠道细胞模型. 体外胃肠模拟主要测定重金属的生物可给性,包括PBET、SBET、DIN、UMB、IVG等方法,在测定的过程中,重金属的生物可给性受到多种因素的影响:pH值、消化酶类型、胃肠相添加的不同成分等;因此选择不同方法测定重金属的生物可给性和生物有效性存在一定差异. 在人体肠道细胞模型中,Caco-2细胞被广泛用于测定重金属生物有效性;但是早期研究表明Caco-2细胞与人体十二指肠的基因表达差异明显,并且基因表达差异与药物渗透性差异一致. 此外,Vázque等[47]利用多种肠道细胞模型(Caco-2单一培养和Caco-2/HT29-MTX不同比例共培养)测定Hg的生物有效性,结果发现HT29-MTX分泌的黏液层能够显著减少Hg的系数. 因此,各种体外模型方法测定生物有效性和生物可给性存在显著差异.
目前,关于蔬菜中重金属的生物有效性的研究相对较少,因此,蔬菜中营养成分影响重金属生物有效性的具体机制还有待进一步研究. 例如,在矿物质中Ca影响Fe的生物有效性,但是具体机制尚不清楚;同样地,蔬菜中的多酚类物质能够降低Pb的生物有效性,但同样缺乏相关证据表明多酚如何降低Pb的生物有效性. 当前关于食品加工尤其是烹饪对蔬菜中重金属的生物有效性的影响的研究较少,在以后的研究中可以考虑食品加工的因素,这有利于进行精确化的健康风险评估. 此外,微塑料与食品加工和蔬菜中重金属的生物有效性有着紧密的联系;应进一步加强微塑料影响肠道微生物丰度的具体机制和对食物基质中Pb、Cd等重金属的生物有效性的影响的研究.
3. 结论与展望(Conclusions and prospects)目前蔬菜重金属健康风险主要基于总量和生物可给性,这可能高估重金属的健康风险,生物有效性是蔬菜重金属健康风险精确化评估的重要手段. 本综述从蔬菜重金属污染现状、健康风险评估方法、影响蔬菜中重金属生物有效性的影响因素方面讨论了目前蔬菜重金属生物有效性研究的进展,为蔬菜重金属精确化健康风险评估提供理论依据. a)目前健康风险评价公式的参数主要基于总量,并且参数的选择有很大的不确定性; b)在测定生物有效性的过程中,体内模型主要采用猪和小鼠进行研究;但是两种模型都存在的一定的缺陷. 使用动物生物测定法测量的金属RBA可以在很大程度上减少动物和人类之间在金属吸收方面的差异,可用于人类健康风险评估. c)体外模型与体内模型相比存在简单、快速、经济、有效等方面的优点. 针对重金属生物有效性的研究主要是采用Caco-2肠道细胞模型和体外消化相结合的方法. 由于Caco-2细胞单培养模型无法模拟肠道消化吸收的真实情况,因此研究者们陆续开发了共培养细胞模型和三重共培养细胞模型. d)蔬菜中的矿物质、营养成分、以及对蔬菜食品加工处理和微塑料都可以影响到重金属的生物有效性,并且不同的体外消化方法测定的重金属的生物可给性和生物有效性是不同的.
准确评估蔬菜中重金属的生物有效性仍然面临诸多挑战,对未来蔬菜重金属生物有效性研究提出几点建议:
(1)体内动物模型测定应该对不同种动物之间的重金属生物有效性进行对比,此外重金属生物有效性测定终点应添加胰腺等其他器官作为生物有效性的测定终点.
(2)目前共培养细胞模型和三重共培养细胞模型在重金属生物有效性研究方面应用较少. 而类器官作为一种新型的体外模型肠道重金属暴露,生物有效性方面的研究还处于起始阶段,因此在肠道类器官作为体外模型具有很大的发展前景.
(3)重金属对人体的健康风险评估的研究主要集中于健康人群,但是缺乏对疾病人群的研究. 非酒精性脂肪肝(NAFLD)是指>5%的肝细胞变性无纤维化和肝细胞损伤. 已有证据表明脂肪肝患病人群肠道通透性提高,因此未来对重金属生物有效性的研究应该关注对疾病人群的影响.
参考文献 (100)相关知识
环境污染物联合暴露的人体健康累积风险评估研究进展
PM2.5污染与低出生体重发生风险关联的研究进展
环境污染与健康风险的评估.pptx
聚焦城市化背景下大气环境健康风险研究
生态系统健康研究进展
研究进展
医学地理和环境健康研究的主要领域与进展
蛋白质基于调节肠道微生物群的健康作用研究进展
重金属宫内暴露对胎儿DNMT3B基因甲基化的影响
孕期全氟烷基化合物暴露对胎儿生长发育影响的研究进展
网址: 基于生物有效性的蔬菜重金属健康风险精细化评估研究进展 https://www.trfsz.com/newsview88934.html
推荐资讯
- 1发朋友圈对老公彻底失望的心情 12775
- 2BMI体重指数计算公式是什么 11235
- 3补肾吃什么 补肾最佳食物推荐 11199
- 4性生活姿势有哪些 盘点夫妻性 10428
- 5BMI正常值范围一般是多少? 10137
- 6在线基础代谢率(BMR)计算 9652
- 7一边做饭一边躁狂怎么办 9138
- 8从出汗看健康 出汗透露你的健 9063
- 9早上怎么喝水最健康? 8613
- 10五大原因危害女性健康 如何保 7828






